第五节 酶促反应的动力学
酶促反应动力学(kinetics of enzyme-catalyzed reactions)是研究酶促反应速度及其影响因素的科学。这些因素主要包括酶的浓度、底物的浓度、pH、温度、抑制剂和激活剂等。在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。但必须注意,酶促反应动力学中所指明的速度是反应的初速度,因为此时反应速度与酶的浓度呈正比关系,这样避免了反应产物以及其他因素的影响。
酶促反应动力学的研究有助于阐明酶的结构与功能的关系,也可为酶作用机理的研究提供数据;有助于寻找最有利的反应条件,以最大限度地发挥酶催化反应的高效率;有助于了解酶在代谢中的作用或某些药物作用的机理等,因此对它的研究具有重要的理论意义和实践意义。
一、酶浓度对反应速度的影响
在一定的温度和pH条件下,当底物浓度大大超过酶的浓度时,酶的浓度与反应速度呈正比关系(图2-7)。
二、底物浓度对反应速度的影响
在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(rectangular hyperbola)(图2-8)。
|
| |||||||||||||
|
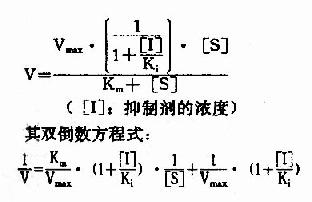
在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系,表现为一级反应。随着底物浓度的升高,反应速度不再呈正比例加快,反应速度增加的幅度不断下降。如果继续加大底物浓度,反应速度不再增加,表现为0级反应。此时,无论底物浓度增加多大,反应速度也不再增加,说明酶已被底物所饱和。所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。 (一)米曼氏方程式 解释酶促反应中底物浓度和反应速度关系的最合理学说是中间产物学说。酶首先与底物结合生成酶椀孜锔春衔?中间产物),此复合物再分解为产物和游离的酶。 Michaelis和Menten在前人工作的基础上,经过大量的实验,1913年前后提出了反应速度和底物浓度关系的数学方程式,即著名的米椔戏匠淌?michaelis menten equation). V=Vmax[S]/Km+[S] Vmax指该酶促反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。当底物浓度很低时,[S]《Km,则V≌Vmax/Km[S],反应速度与底物浓度呈正比。当底物浓度很高时,[S]》Km,此时V≌Vmax,反应速度达最大速度,底物浓度再增高也不影响反应速度(图2-9)。
图2-9 酶与不同浓度的底物相互作用模式 (二)米-曼氏方程式的推导 米-曼氏方程式提出后又经riggs和Haldane的充实和发展,经补充和发展的米-曼氏方程工推导如下:
式中K1、K2、K3、K4分别为各向反应的速度常数。 从式(1)中知,ES的生成途径来自E+S和E+P,但其中E+P生成ES的速度极小(尤其在起始阶段,P的生成很少),可以忽略不计,又因为底物浓度大大超过酶的浓度,[S]》[E],中间产物ES中的S浓度可以忽略不计,因此,ES的生成速度为:
|

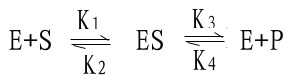 (1)
(1)