第二节 基因工程载体
基因工程是要按人们的意愿去有目的地改造,创建生物遗传性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分离或改建的基因和核酸序列自身不能繁殖,需要载体携带它们到合适的细胞中复制和表现功能。对理想的基因工程载体一般至少有以下几点要求:
①能在宿主细胞中复制繁殖,而且最好要有较高的自主复制能力。
②容易进入宿主细胞,而且进入效率越高越好。
③容易插入外来核酸片段,插入后不影响其进入宿主细胞和在细胞中的复制。这就要求载体DNA上要有合适的限制性核酸内切酶位点。
④容易从宿主细胞中分离纯化出来, 这才便于重组操作。
⑤有容易被识别筛选的标志,当其进入宿主细胞、或携带着外来的核酸序列进入宿主细胞都能容易被辨认和分离出来。这才介于克隆操作。
常用的载体有质粒,噬菌体和病毒等。
一、质粒载体
质粒(plasmid)是细菌或细胞染色质以外的,能自主复制的,与细菌或细胞共生的遗传成分。其特点如下:
①是染色质外的双链共价闭合环形DNA(covalently closed circuar DNA,cccDNA),可自然形成超螺旋结构,不同质粒大小在2-300 kb之间,<15kb的小质粒比较容易分离纯化,>15kb的大质粒则不易提取。
②能自主复制,是能独立复制的复制子(autonomous replicon)。一般质粒DNA复制的质粒可随宿主细胞分裂而传给后代。按质粒复制的调控及其拷贝数可分两类:严紧控制(stringent control)型质粒的复制常与宿主的繁殖偶联,拷贝数较少,每个细胞中只有1个到十几个拷贝;另一类是松弛控制(relaxed control)型质粒,其复制宿主不偶联,每个细胞中有几十到几百个拷贝。每个质粒DNA上都有复制的起点,只有ori能被宿主细胞复制蛋白质识别的质粒才能在该种细胞中复制,不同质粒复制控制状况主要与复制起点的序列结构相关。有的质粒的可以整合到宿主细胞染色质DNA中,随宿主DNA复制,称为附加体,例如细菌的性质粒就是一种附加体,它可以质粒形式存在,也能整合入细菌的DNA,又能从细菌染色质DNA上切下来。F因子携带基因编码的蛋白质能使两个细菌间形成纤毛状细管连接的接合(conjugation),通过这细管遗传物质可在两个细菌间传递。
③质粒对宿主生存并不是必需的。这点不同于线粒体,线粒体DNA也是环状双链分子,也有独立复制的调控,但线粒体的功能是细胞生存所必需的。线粒体是细胞的一部分,质粒也往往有其表型,其表现不是宿主生存所必需的,但也不妨碍宿主的生存。某些质粒携带的基因功能有利于宿主细胞的特定条件下生存,例如,细菌中许多天然的质粒带有抗药性基因,如编码合成能分解破坏四环素、氯霉素、氨芐表霉素等的酶基因,这种质粒称为抗药性质粒,又称R质粒,带有R质粒的细菌就能在相应的抗生素存在生存繁殖。所以质粒对宿主不是寄生的,而是共生的。医学上遇到许多细菌的抗药性,常与R质粒在细菌间的传播有关,F质粒就能促使这种传递。
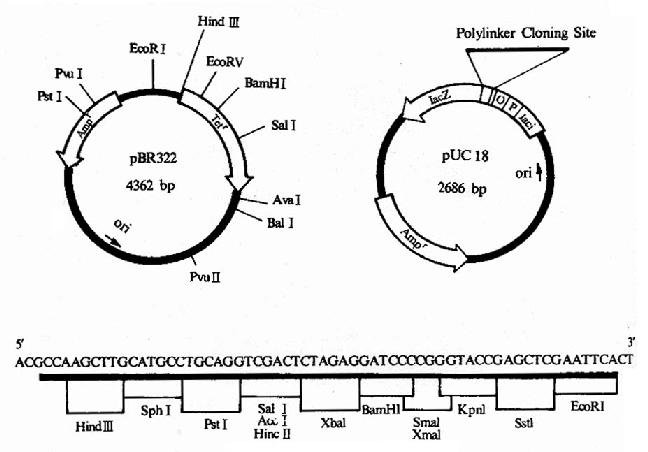 图20-2 pBR322及pUC18图谱
图20-2 pBR322及pUC18图谱
现在分子生物学使用的质粒载体都已不是原来细菌或细胞中天然存在的质粒,而是经过了许多的人工的改造。从不同的实验目的出发,人们设计了各种不同的类型的质粒载体,近年来发展很快,新的有特定用途的质粒不断被创建。图20-2给出最常用的大肠杆菌克隆用质粒pUC19的图谱,此质粒的复制起点处序列经过改造,能高频率起动质粒复制,使一个细菌pUC19的拷贝数可达500-700个;质粒携带一个抗氨芐青霉素基因,编码能水解β-内酰胺环,从而被坏氨芐青霉素的酶,当用pUC19转化细菌后放入含氨芐青霉素的培养基中,凡不含pUC19者都不能生长,结果长出的细菌就是都含有pUC19的;pUC19还携带细菌lac操纵元中的lacI和lacZ基因编码,β-半乳糖苷酶N端状146个氨基酸的段落,当培养基中含有诱导物IPTG和Xgal时,lacZ ' 基因被诱导表达产生的β-半乳糖苷酶N端肽与宿主菌表达的C端肽互补而具有β-半乳糖苷酶活性(质粒和宿主编码的肽段各自都没有酶活性,两都融为一体而具酶活性,称为α-互补,α-complementation),半乳糖苷酶水解Xgal而使菌落呈现蓝色;在lacZ '中间又插入了一段人工设计合成的DNA序列,其中密集多个常用的限制性核酸内切酶的位点,使外来的基因和序列能很方便地被插入此位置,当外来序列插入后则破坏了lacZ '编码的半乳糖苷酶活性,生长的菌落就呈白色,这种颜色标志的变化就很容易区分和挑选含有和不含有插入序列或基因的转化菌落,称为蓝白筛选法。
除常用的大肠杆菌质粒载体外,近年来发展了许多人工构建的其它能用于微生物、酵母、植物等的质粒载体。含有不止一个ori、能携带插入序列在不同种类宿主细胞中繁殖的载体称为穿梭载体(shuttle vectors)。
二、噬菌体载体
噬菌体(phage)是感染细菌的一类病毒,有的噬菌体基因组较大,加入λ噬菌和T噬菌体等;有的则较小,如M13、f1、fd噬菌体等。用感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
λ噬菌体由头和尾构成,其基因组是长约49kb的线性双链DNA分子,组装在头部蛋白质外壳内部,其序列已被全部测出。λ噬菌体感染时,通过尾管将基因组DNA注入大肠杆菌,而将其蛋白质外壳留在菌外。DNA进入大肠杆菌后以其两端12bp的互补单链粘末端环化成环状双链,可以两种不同的方式繁殖(图20-3):①溶菌性方式(lytic pathway):在营养充足,条件适合细菌繁殖时,利用宿主菌中的酶类和原料,λDNA上基因可按调控的顺序表达合成构成噬菌体头、尾和尾丝所需的各种蛋白质,λDNA经多次复制合成许多子代λDNA,于是装配成许多子代的λ噬菌体,最后裂菌,释放出许多新的λ噬菌体。②溶原性方式(lysogenic pathway):进入细菌的λDNA可整合(integrate)入细菌的染色质DNA中,随细菌染色体DNA复制,传给细菌后代,这个稳定潜伏在细菌染色质DNA中的λDNA称为原噬菌体(prophage),含有原噬菌体的细菌称为溶源菌(lysogen)。λDNA的整合是可逆的,原噬菌体可从宿主DNA中切出,进入溶菌性方式的繁殖。
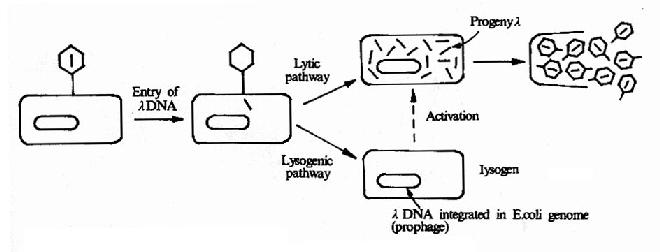 图20-3 λ噬菌体的溶菌和溶原繁殖方式
图20-3 λ噬菌体的溶菌和溶原繁殖方式
λ噬菌体整个基因组如图20-4所示,可分为三个部分,①左臂:从A到J长约20kb,其中的基因编码构成头部、尾部、尾丝对组装完整噬菌体所需要的蛋白质。②中段:长约20kb,是λDNA整合和切出,溶原生长所需的序列。③右臂:长约10kb,是调控区,控制溶菌和溶原生长最重要的调控基因和序列、以及λDNA复制起始均在这区域内。左右臂包含λDNA复制、噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生长所需全部序列;对溶菌生长来说,中段是非必需的。
利用λ噬菌体作载体,主要是将外来目的DNA替代或插入中段序列,使其随左右臂一起包装成噬菌体,去感染大肠杆菌,并随噬菌体的溶菌繁殖而繁殖。现在广泛使用的λ噬菌体载体也是已作过许多人工改造的,主要的改造是:①设计去除λDNA上的一些限制性酶切点。这是因为λDNA较大,序列中的限制性酶切点过多,妨碍其应用。②在中段非必需区,替换插入某些标志基因如上述的可供蓝白筛选lacI-lacZ’序列,和多克隆位点等。由此可构建出两类λ噬菌体作载体;一类是插入型载体,可将外来序列插中段,常用的λgt系列载体,一般容许插入5-7kb外来DNA;另一类是转换型载体,即可用外来DNA替代中段,如IMBL系列载体。
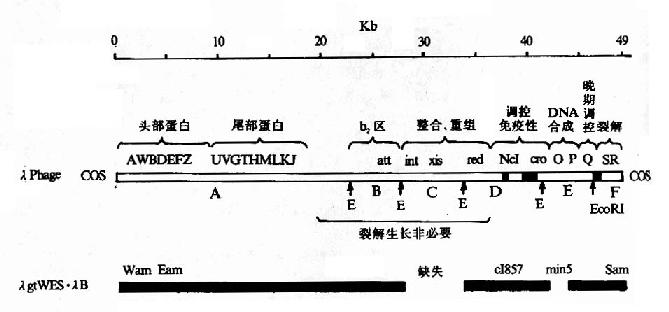 图20-4 野生型λ噬菌体DNA及相应的λ噬菌体DNA图谱
图20-4 野生型λ噬菌体DNA及相应的λ噬菌体DNA图谱
插入或置换中段外来的DNA长度是有一定限制的,当噬菌体DNA长度大于野生型λ噬菌体基因组105%或小于78%时,包装而成的噬菌体存活力显著下降。所以λ噬菌体载体可插入长5-20kb的外来DNA,这比质粒载体能插入的DNA长得多;而且包装的λ噬菌体感染大肠杆菌要比质粒转化细菌的效率高得多,所以λ噬菌体载体常用于构建cDNA文库或基因组文库。但λ噬菌体载体的克隆操作要比质粒载体复杂。
如果将左右臂和中段都去除,仅留下λDNA而端包装噬菌体所必需的cos序列,再加上质粒的复制序列、标志基因、多克隆位点等,就可构成cos质粒或称为粘粒的载体。粘粒可插入45kb长的外源DNA,然后用λ噬菌体外壳蛋白包装成噬菌体,感染大肠杆菌后,粘粒的DNA能以质粒的形式在细菌中繁殖而被克隆。所以粘粒主要用于DNA文库的构建。
三、动物病毒载体
质粒和噬菌体载体只能在细菌中繁殖,不能满足真核DNA重组需要。感染动物的病毒可改造用作动物细胞的载体。由于动物细胞的培养和操作较复杂、花费也较多,因而病毒载体构建时一般都把细菌质粒复制起始序列放置其中。使载体及其携带的外来序列能方便地在细菌中繁殖和克隆,然后再引入真核细胞。目前病毒载体常用者有改造来自猴肾病毒SV40(Simian Virus 40)、逆转录病毒和昆虫杆状病毒等,使用这些病毒载体的目的多为将目的基因或序列放入动物细胞中表达或试验其功能、或作基因治疗等(见后)。
人基因组十分庞大,约含4×109bp,建立和筛选人的基因组文库,要求有容量更大的载体,酵母人工染色体(yeast artificial chromosome,YAC)载体应运而生。YAC含有酵母染色体端粒(telesome)、着丝点(centromere)及复制起点等功能序列,可插入长度达200-500kb的外源DNA,导入酵母细胞可以随细胞分裂周期复制繁殖供作克隆,成为人基因组研究计划的重要
校对时间:99-11-24 9:13 孟红霞
, http://www.100md.com