五、药物不良反应的判定及报告
治疗不良反应(adverse reaction)应包括药物治疗、手术治疗及其他治疗的各种不良反应在内。现以药物治疗不良反应为例。
(一)药物不良反应的严重性
表6-7 英国医药安全委员会报告药物不良反应的报告数和死亡百分比(1964.1~1976.6)
|
药 物 |
报 告 数 |
死亡(%) |
|
氟 烷 |
380 |
42 |
|
羟基保泰松 |
709 |
23 |
|
保泰松 |
1364 |
26 |
|
阿司匹林 |
410 |
26 |
|
氯丙嗪 |
584 |
20 |
|
三氟丙嗪 |
306 |
15 |
|
苯巴比妥 |
353 |
14 |
|
氯氮卓 |
567 |
13 |
|
丙咪嗪 |
446 |
12 |
|
地西泮 |
698 |
11 |
|
阿密替林 |
489 |
10 |
|
吲哚美辛 |
329 |
12 |
|
Frusemide |
576 |
10 |
药物治疗不良反应包括毒性作用、过敏反应、致畸作用等副作用。在英国,由于社会人群中约有80%的成人每周因各种原因应用某些药物,致使药物不良反应发生率及死亡率和经济损失都是很大的。国内早期主要对解热止痛药、安眠药、磺胺、抗生素等所引起的过敏反应,以及对心、肝、肾、颅神经、造血系统等的毒性作用有较多的研究。近来发现再生障碍性贫血有增长的趋势,继发性占53.1%,其中75.4%有明显的诱因,以化学药物所致为最多。
1973年美国药物不良反应的发生率约6%,占住院人数的4%~10%。从英国医药安全委员会(SMC)公布的54 000份报告中,可以大致了解引起不良反应的药物及其危害程度(见表6-7)。
(二)药物不良反应的概念及判断
世界卫生组织对药物不良反应作如下定义:因药物产生的任何有害或不需要的反应统称为药物不良反应(adverse drug reaction)。
药物不良反应通常是指在常用量条件下,由于药物或药物相互作用而发生的与治疗目的无关的意外的有害反应。至于因误用和滥用药物以及服药自杀等所造成的后果均不属药物不良反应。
我国所制定的《药品不良反应监察报告制度》(草案)中明确规定不良反应的具体范围为:①所有危及生命、致残直至丧失劳动能力或死亡的不良反应;②新药投产使用后所发生的各种不良反应;③疑为药品所引致的畸形、突变、癌变;④各种类型的过敏反应;⑤非麻醉药品产生的药物依赖性;⑥疑为药品间互相作用导致的不良反应;⑦其他一切意外的不良反应。
判断不良反应是否与药物有关可以用Karch和Lasagna所提出的标准:①不良反应是在服药后还是在服药同时发生的;②是否符合该种药物的不良反应类型;③停药后是否有所改善;④再次使用时是否重复出现和得到再次治疗;⑤反应能否用已知疾病的特征和其他治疗解释。将符合以上五项条件的多少,判断为“肯定”、“很可能”、“可能”、“可疑”和“否定”。见表6-8。
表6-8 药物不良反应的判断标准
|
标准 |
肯 定 |
很可能 |
可 能 |
可 疑① |
|
合理的时间顺序 |
是 |
是 |
是 |
是 |
|
已知药物的反应类型 |
是 |
是 |
是 |
否 |
|
去除原因可以改善 |
是 |
是 |
是或否 |
是或否 |
|
再次给药可重复出现 |
是 |
?② |
?② |
?② |
|
反应可有另外解释 |
否 |
否 |
是 |
否 |
①有待进一步观察再分类 ②因医德所限不允许再重复
(三)判断药物不良反应方法
确定某种不良反应是否与某种药物有因果联系,多数情况下仅靠个例调查分析是十分困难的。一般在群体中运用流行病学方法判断。
1.泊松(普哇松,Poisson)分布法 某种药物的不良反应出现频率一般均小于1%,这时可用泊松分布来判断某种不良反应究竟是否由某种药物所引起。
例如:用某种药物治疗40人,其中1人出现精神抑郁症,这种抑郁症既可能因药物所引起,也可能在不吃药物的人群中出现。判断的方法是先假设这1例抑郁症是不吃药物人群中出现的,然后计算其概率有多大再根据此概率的大小,检验该假设是被接受还是被拒绝,就可得出结论。例如据了解过去抑郁症在人群中的发生率为0.1%,故本例可适用泊松分布来进行判断。
利用泊松分布的概率密度函数
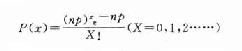 (式6-7)
(式6-7)
分式中n=治疗人数,p=人群中抑郁症的发生率,e为自然对数底=2.7183。
40人中出现该抑郁症1人的概率
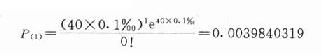
还可计算在40人中出现抑郁症2,3,4…40人的概率,这些概率更小了。
为计算方便起见,可计算1例也不出现的概率:

然后以1-0.99600799=0.00399201,此概率代表出现1例及多例的总概率。这总概率<0.005,说明这一例在不吃药的人群出现的概率太小,假设被拒绝。因而可以认为40个服药人中出现一例抑郁症与服药有关,应停止临床应用该药物。
2.干预试验法 干预试验可判断药物与不良反应的关系。
如反应停(商品名Grippex)有安眠和镇静作用,常为孕妇所使用。在联邦德国,从1959年开始在市场销售,1960年销售量迅速上升。1960年底和1961年初出生短肢畸形病例数亦随之上升。两条曲线相隔3个季度,故反应停销售量曲线正与这些病例的母亲怀孕初期相吻合。1961年12月对反应停进行干预,从联邦德国市场撤消,反应停停止出售后,1962年下半年以后出生的儿童便很少发生这种畸形。说明此不良反应是反应停所致。见图6-6。
(四)药物不良反应的监测
药物不良反应已成为一个全球性的问题。
我国卫生部根据《中华人民共和国药品管理法》第24条,25条规定:为保证人民用药安全制定了“药品不良反应监测报告制度”。
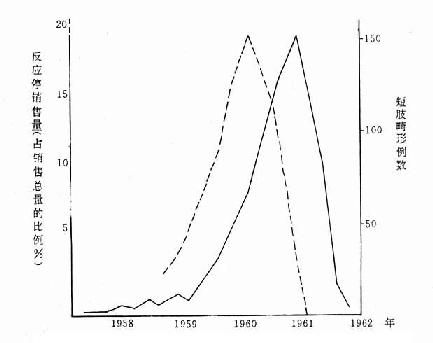
图6-6 联邦德国反应停销售总量(虚线)与短肢畸形病例数(实线)
的时间分布(Davis and Dobbling.1974)
监测的目的在于及时发现上市后药物未预料到的严重不良反应。确立已知或新发现不良反应的情况,对药物不良反应进行流行病学调查,以及研究其机制和后果等。
监测方法:
(1)医院为中心的监测系统:可以按照划区或医疗分工,与卫生院、诊所、保健站等形成监测网,省、地(市)医院内专设流行病学(或临床流行病学)科承担药物监测,包括药物不良反应的登记、分析和进行专题研究,为国家药政部门提供信息和药物生产使用的依据。美国波士顿1965年开始的药物监测协作计划(BCDSP),是以医院为中心进行药物监测的,具有代表性的项目。
上海市进行药物监测的试点工作,选择9所医院的部分病房,对1200名住院病人进行为期3个月至1年的药物不良反应监测。如上海市部分医院的内科和儿科,药物不良反应的发生率分别为39%和12.9%。
(2)义务报告系统:英国自1964年起实行药物不良反应报告制度,即黄卡系统(yellow card system)。黄卡是随药附送的一种预付邮资和写明地址的明信卡,所以来源极为广泛,可来自医生,亦可来自患者,有代表性的耗资低。该系统对深入研究和观察药物不良反应起着“信号”作用。如ibutenac(抗炎止痛药)在投入市场后不久,英国药物安全委员会就收到40例肝损害的报告,决定立即终止销售。
(3)生命统计:药物不良反应的信息可以来自国家的生命统计,可在死亡报告中单列药物不良反应一项原因作统计分析。此法虽然简便经济,但是不能得到详尽的资料。
(4)记录连结:许多国家建立了记录连结(record linkage)体系,记录每个人出生后到死亡的重要健康和疾病问题,贮存在计算机内,对于研究药物或遗传同环境因素的致病作用是非常有用的,可以选择适当的对照,甚至配比的对照者进行病例对照研究。例如孕期子宫照射增加子女发生白血病的危险性,孕期使用已烯雌酚致女儿青春期阴道腺癌的研究,都是应用记录连结完成的。
(5)加强药政管理,认真贯彻执行《中华人民共和国药品管理法》,严格新药、新制剂的审批及作好老药复审再评价工作,充分应用立法权减少药品所造成的生命损失,以法律武器来保障人民的用药安全。
校对时间:99-11-23 14:34 杜育苗
, http://www.100md.com