第三节 放射性同位素标记核酸探针
最常用的同位素是α-32PdNTP,3HdNTP,及35SdNTP,多用缺品平移法、末端标记法,随机引物延伸法和反转录标记法。在以mRNA制备cDNA时,同时掺入标记的脱氧核苷酸,制出cD-NA标记探针。
一、缺口平移法
在适当的浓度的DNase I作用下在一双链DNA上制造一些缺口,再利用大肠杆菌DNA聚合酶I 的5’—3’外切酶活性依次切除缺口下游的核酸序列,同时将四种脱氧三磷酸核苷(其中一种用放射性标记)利用该酶5’—3’聚合活性补人缺口,使缺口逐个平称并在平移过程中形成标记的新生核酸链。此法也适用于探针的非放射性标记。如32P标记DNA探针(缺口平移法):反应体积为25μl,内含0.3μgDNA片段,4μl 0.2μmol/L dNTP, 1.1×106Bq [α-32P]dATP, 1μl2万倍稀释的DNA酶和2μl DNA聚合酶I,6μl缓冲液[为50mmol/L Tris·HCl(PH7.2)、10mmol/L MgSO4、1mmol/L二硫苏糖醇(DTT)和50μg/ml BSA],反应在14℃进行3h。标记DNA经Sephadex (G-50)柱层析回收。
二、末端标记法
在大肠杆菌T4噬菌体多聚核苷酸激酶(T4PNK)的催化下,将γ-32P-ATP上的磷酸连接到寡核苷酸的5’末端上。要求标记的寡核苷酸5’端必须带羟基。反应式为:
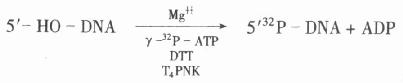
此法适用于标记合成的寡核苷酸探针。如将底物改为Bio –11 –dUTP,也可以在3’端标记上一个生物素。
寡核苷酸35S的3’—末端标记法:将下列液体依次加入Eppendorf管中。
寡核苷酸(1 pmol)1μl
10×Tailing buffer 2μl
[α-35S]2μl
双蒸馏水14μl
末端脱氧核苷酸酶1μl(10Unit)
混合后,置于37℃水浴中1.5h。取出反应管放入冰水中5min。加入下列液体:
TRNA(25mg/ml)3μl
1×TE(pH8.0)180μl
酚100μl
CTAA100μl
充分混合2min。离心15000r/min 5min。将上清液(约200μl)移入新的Eppendorf 管中,然后加入下列液体:
4mol/L醋酸胺100μl
100%酒精800μl
混匀,置冰浴中,15min。再15000r/min离心10min,在管底可见一白色沉淀块(含tRNA及寡核苷酸)。吸去管中液体,然后加入1000μl80%酒精,混合1~2min同上离心,吸除酒精(勿破坏沉淀块),将管置于40℃温箱中5min。加入适量的1×TE(pH8.0)及0.5mol/L DTT溶解沉淀。标记探针的最终浓度是0.5ng/μl,DTT的最终浓度为20mmol/μl。取出1μl标记探针测定比放射性,应在1.0×10dpm/μg以上。保存在-80℃中1~2个月。再次使用时应考虑到放射性同位素的衰减量。
三、应用特异单引物法标记DNA探针
应用探针DNA上的一个片段作为DNA引物,以环化探针DNA的重组质粒DNA为模板,在DNA聚合酶的作用下,通过变性,退火和延伸过程,使探针DNA得到标记。反应在0.5ml离心管内进行,总体积为25μl,内含50mmol/L Tris—HCl pH7.5, 10mmol/L MgCl2、BSA 5mmol/L、80ng引物DNA和0.1μg连接的DNA或0.1μg质粒。反应管在95℃变性5min,取出,稍离心,立即放入37℃C水浴保温2min使DNA退火,加入1UE. coli DNA聚合酶I,在37℃进行延伸反应。对环化基因,延伸18min,对质粒DNA延伸35min重复上述变性、退火和延伸过程1次。
四、双引物法标记DNA探针法
反应在0.5ml管内进行,反应体积为50μl,内含50mmol/L Tris(pH7.5)、10mmol/L Mg-Cl2、10mmol/L β-巯基乙醇和500μg BSA/ml,引物片段1和2各90ng,模板DNA0.1μg,[α-32P]dCTP 1.5×106Bq,dATP 、dGTP和dTTP各200μmol/L。标记反应包括3个步骤:
(1)变性:反应管在95℃水浴5min,然后离心;
(2)退火:37℃水浴2min;
(3)延伸:加入DNA聚合酶I 1u,37℃水浴18min。重复上述变性、退火、延伸过程1~2次,分别进行其标记率测定:取0.5μl反应液分别点于两张滤纸片上,烤干。一张经0.6mol/L三氯醋酸(TCA)、0.3mol/L TCA依次洗涤,每次10min,然后再用无水乙醇,醇醚混合液和乙醚洗涤各5min。两张滤纸分别放入闪烁瓶内,测定cpm值,达到108cpm/μg DNA以上。
五、聚合酶链反应(PCR)标记高活性DNA探针
在0.5ml离心管内进行,反应总体积为50μl,内含模板DNA350ng,DNA引物各50pmol/L, dGTP、dCTP和dTTP各200μmol/L,[α-32P]dATP 1.1×106Bq,反应缓冲液为67mmol/L Tris—HCl pH8.8含2.5mmol/L MgCl2、6.7mmol/L(NH4)2SO4、10mmol/L β-巯基乙醇、170mg/L BSA、6.7μmol/L EDTA和40μl/ml二甲亚砜。将反应管置于95℃水浴变性5min取出,加入Taq DNA聚合酶0.5~2u,在旋涡混合器上混匀简单离心一下,加入35μl石蜡油。放入65℃水浴2min,取出,立即进入PCR循环:91℃变性30s,51。C退火1min,68℃延伸2min。重复上述过程15次。最后将反应管置65℃水浴5min。反应完成,加入酵母tRNA10μg。分别测定参入和游离放射性计数,参入率为97.4%。标记DNA探针经醋酸钠酒精沉淀回收。将沉淀溶于10mmol/L Tris—HCl 、EDTA(pH8.0)100μl。用PCR方法标记的DNA探针特异性高,敏感性好,可测出的最低靶DNA量为10fg,利用PCR还可以作DNA探针的非放射性标记。
校对:2000/05/31 杨丽华
, 百拇医药