附录二 原位杂交组织化学常用试剂及处理
一、杂交前准备
(一)DEPC水是经DEPC处理过的灭菌蒸馏水。
DEPC即二乙基焦碳酸酯(diethylprocarbonate),可灭活各种蛋白质,是RNA酶的强抑制剂。原位杂交在杂交及其以前的各步处理中,所有液体试剂都应经DEPC处理。方法是:取市售DEPC 1ml,加入1L待处理水(蒸馏水等)中,经猛烈振摇后,于室温静止数小时,然后高压灭菌,以除去降解DEPC(DEPC分解为CO2和乙醇)。有些试剂可直接加入DEPC,终浓度一般为0.1%~0.4%,原则上在杂交及其以前的步骤中,所有液体试剂均需用DEPC处理,或用DEPC水配制,包括乙醇的稀释。此外,接触标本以及标本有关的空中的洗涤也需DEPC水洗涤。
注意:①DEPC是一种潜在的致癌物质,在操作中应尽量在通风的条件下进行,并避免接触皮肤。②含有Tris缓冲液的溶液中,不能加入DEPC。
(二)载玻片的处理
组织原位杂交,常在载玻片上进行,故载玻片的洗涤至关重要,必须保持清洁,并且不能有任何核酸的污染。处理方法如下:
(1)先经洗衣粉浸泡过夜,次日自来水冲洗后,泡酸数小时以上,取出后再用流水冲洗,双蒸水冲洗2~3次,置160℃以上烤箱中烧烤4h以上,或经15磅高压灭菌20min。经以上处理可清除载片上的核酸酶。
(2)HCl处理法

(三)硅化
【方法1】(1)将一扎新的盖玻片散开,在通风条件下于0.1mol/L的HCI中煮20min,等其冷却后,倒掉盐酸。
(2)用去离子水沉漂洗玻片,竖放在架子上自然干燥。
(3)硅化盖玻片:通风条件下,将单块的盖玻片在二甲二氯硅浣(dimethyldichorsilane,DMDC)液中浸几下,竖入在架子上干燥。
(4)收集干燥的盖玻片于一可耐热的petri氏盘(或培养皿)中,用去离子水漂洗数次,彻底清洗。
(5)用铝箔将装有盖玻片的培养皿包好,于180℃烘烤4h过夜。取出待冷至室温后,即可进行后续处理。
附:2%DMDC

配制:按比例两者充分混匀,静止待气泡消失即可使用。
用途:硅化玻片(载片、盖片均可)。
【方法2】将经过洗净的玻璃盖片分散开放在一金属网中,并将该网放入一接有真空泵的干燥器中。同时,在干燥器中放一盛有约1m二甲二氯硅浣(dimethyldiorosilane,DMDC)的小烧杯。盖好干燥器(确保密闭),抽真空约5min,然后让空气冲入。取出盛有盖片的金属网架,用锡箔纸包埋,于250℃以上烘烤4h以上,最好过夜。冷却后备用。
本法可用于玻璃及塑料器皿的硅化。塑料器皿只能于60℃烧干。
【方法3】APES(氨丙基三乙氧基硅浣)法

【方法4】
(1)49ml氯仿与1mg二甲二氯硅浣(DMDC)配液;
(2)倒入每个拟硅化的试管或离心管中,浸泡5min后用乙醇或重蒸水冲洗;
(3)玻璃器皿使用前位于180℃以上烘烤2h以上,塑料器皿应于60℃烘烤过夜。
注意:DMDC有毒且高度挥发,应于通风环境操作并戴口罩、手套,避免接触皮肤或吸入。
(四)载片的包被(粘贴)
1.沾附剂
(1)多聚赖氨酸(poly-L-Lycine,PLL)
储备液(0~5%)

按上述剂量充分混合,即为浓度为5mg/ml(0.5%)的PLL液。常分装成1ml的包装,-20℃存放。该液为储备液,可反复冻融,无明显影响。用前充分混合。
工作液(0.01%):

充分混合,静止待气泡消失。
(2)明胶液

配法:先称取明胶溶于500~800ml DEPC水中,加热搅拌助溶,待明胶完全溶解以后,加入甲明矾溶解后即可使用。注意,包被玻片时,明胶液温度最好保持在60℃左右,效果最佳。方法同PLL包被玻片。
2.多聚赖氨酸包被玻片的制备方法(其它包被剂相同)
(1)将事先准备好的经160℃以上烘烤,并冷却至室温的玻片(载片或盖片),在0.05%(也有用0.1%)的PLL液中上下浸蘸几下,分散开竖放在架子上,于空气中自然干燥,4℃备用。注意:①浸蘸时,务必使整个玻片完全浸于液体中,否则,包被不完全会产生标本脱落现象;②干燥过程中注意避免尘埃污染;③按上法处理的玻片通常可存放在一定时间(室温1月以上,4℃更长),但仍建议尽早使用。
(2)多聚赖氨酸1mg溶于10ml灭菌的去离子水或1mmol/L的Tris-HCl缓冲液中(pH7.0),将其涂布于玻片上,待干燥后即可使用。该法包被的玻片可用于细胞涂片和切片。
(3)将PLL工作液滴至盖玻片上5μl/片,用另一盖玻片以推血涂片方法推片,或用另一盖玻片紧贴于其上,相互磨擦以使两盖玻片相对的一面涂布上PLL。该法制备的玻片,只有一面是包被有PLL,故制备时,待其晾干后,应作好记号,然后保存后备用。
多聚赖氨酸可用于多种核酸杂交,方法简单,结果可靠,有许多其它方法不可比拟的优点。配制好的液体可存放于4℃或室温,但时间过长会解聚而失效,故建议使用时尽量新鲜配制。
(4)Vectabond粘附剂
该试剂是Vector公司新近推出的一种新型粘附剂。它与其它粘附剂的主要区别是:一般的粘附剂是通过物理性覆盖在玻片表面,天长日久,可能由于包被不完全或局部脱落而致切片等标本易于脱落。而Vectabond试剂是通过化学性作用,改变玻璃表面的分子结构,使标本贴附牢固,不易脱落,且保持时间长久,耗量小,价格便宜,一个包装7ml可配成350ml工作液使用。操作程序:
标本(铺片、切片等)→丙酮(5min)→Vectabond试剂工作液(5min)→dH2O(2×5min)→干燥(温箱,数小时过夜)→用铝箔包好,室温备用。
注意:制备和保存过程中避免污染。
经上述处理的载玻片一般可存放半年以上(4℃可更长)。
(五)硅鱼精子DNA的制备
(1)在50ml灭菌聚乙烯管中加入1g鲑精DNA,加入15ml DEPC水使其浸泡5min至2h;
(2)加入2.5ml 2mol/L HCl,室温放置,DNA形成白色沉淀,充分振摇至沉淀物相互缠绕在一起,用吸头尖端使之形成一球团状(2~3min);
(3)加入5.0ml 2mol/L的NaOH。摇动小管使DNA悬浮、溶解,将小管置50℃15min助溶;
(4)用DEPC水将混合物稀释至175ml(总体积),充分混合,注意确保管内已无颗粒状;
(5)加入20ml/L 1mol/L的Tris-HCl缓冲液(pH7.4);
(6)用2mol/L的HCl滴定至DNA溶解pH为7.0~7.5;
(7)用无菌微孔滤膜过滤液体,去除颗粒。260nm测定溶液的OD值,方法是:取20μl DNA液混合于980μl水中,混匀后测定,吸收值乘以50即为DNA浓度(μg/ml);
(8)制备好的DNA液储于-20℃备用,用前取出冻融后煮沸。
二、关于探针的标记
(一)cRNA探针的同位素标记
1.标记液(转录标记)

2.转录缓冲液

※:用地高辛或生物素标记时,用UTP替代。
3.标记终止液
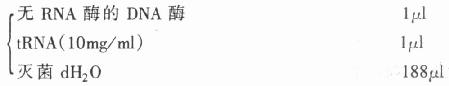
4.标记探针水解液

先用dH2O悬浮探针,再加入后两种试剂,轻轻振摇混合,于60℃条件下反应。
5.探针水解时间
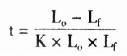
注:LO-探针初始长度(kb)
Lf-探针的终长度(kb)
K-0.11kb/min
6.探针水解终止液

每次加入充分混合,临用前配。
7.探针沉淀液

每次加入,充分混合,新鲜配制。
(二)寡聚核苷酸3’端标记(cRNA探针)
1.标记反应液

2.终止液:0.2mol/L EDTA
3.探针沉淀液

(三)cRNA探针非同位素标记(地高辛及生物素)
1.标记液

△:生物素标记时为10mmol/L的生物素-11-UTP
※:为检测标记率而加。
2.转录标记终止液
(1)0.2mol/L EDTA:用于地高辛标记法
(2)生物素标记终止液:
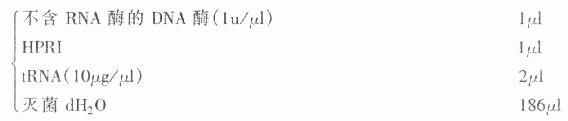
(四)DNA探针标记常用试剂的配制
(1)10 ×缺口平移缓冲液:200mmol/L Tris-HCl,pH7.4含50mmol/L MgCl2;100mmol/Lβ-巯基乙醇、1mg/ml BSA。
(2)缺口平移反应终止液:200mmol/L NaCl;10mmol/L Tris-HCl,pH7.4; 11mmol/L EDTA; 0.5% SDS。
(3)DNaseⅠ:干粉状DNaseⅠ(2000~3000u/mg)溶于20mmol/L Tris-HCl, pH7.5中(1mg/ml),10μl分装,-20℃保存一年。
(4)10×DNA聚合酶Ⅰ(Klenow片段)缓冲液:500mmol/L Tris-HCl,pH6.6;100mmol/L Mg-Cl2;10mmol/L DTT;0.5mg BSA。
(5)10×激酶缓冲液:500mmol/L Tris-HCl,pH7.4,50mmol/L MgCl2; 20mmol/L DTT; 1.0mmol/L亚精胺。
(6)10×随机引物标记缓冲液;500mmol/L Tris-HCl,pH6.6;100mmol/L MgCl2;10mmol/L β-巯基乙醇;500μg/ml BSA。
(7)1×加尾缓冲液:100mmol/L二甲胂化钾,pH7.0,1mmol/L CoCl2 0.2mmol/L DTT。
(8)1mol/L MgCl2:MgCl2 47.60g溶于500ml水中,100ml分装,高压灭菌,室温保存。
(9)0.25mol/L EDTA(Ph8.0):EDTA 52.02g溶于400ml水中,调pH至8.0,加水至500ml,100ml分装,高压灭菌,室温保存。
(10)4mol/L醋酸钠:取无水醋酸钠82g溶于200ml水中,用醋酸调pH至6.5,加水至250ml,高压灭菌,或0.45μm膜过滤,室温保存。
(11)10% SDS:10g SDS(十二烷基硫酸钠)溶于50ml水中,加水至100ml,分装后室温保存。
(12)20×SSC:取NaCl 175.3g;柠檬酸钠88.2g;加水至1000ml,用10mol/L NaOH调pH至7.0;高压灭菌,室温保存。
(13)无菌水:100ml去离子水或双蒸水,分装,高压灭菌,室温保存,开瓶后仅限一周使用。
(14)10×激酶缓冲液:500mmol/L Tris-HCl,pH7.4;100mmol/L MgCl2;50mmol/L DTT;10mmol/L亚精胺(非必需)。
(15)T4多聚核苷酸激酶:10u/μl,保存在甘油中,-20℃。
(16)TE缓冲液(Tris/EDTA):Tris,10mmol/L pH7.4(0.5ml 2mol/L贮存液),1.0mmol/L ED-TA,pH8.0(20μl 0.5mol/L)贮存液,加水至100ml,室温保存。
(17)2mol/L Tris-HCl pH7.4:Tris242.2g溶于850ml,加浓HCl 75ml ,边加边缓慢搅动,至pH7.4,于加水至1000ml。
(18)1mol/L DTT(二硫苏糖醇):3.0g DTT溶于20ml水中,分装,于-20℃贮存。
(19)0.5mol/L EDTA(乙二胺四乙酸二钠盐):在烧杯中先加入300ml水,加入93.5g EDTA-Na2·2H2O,充分混匀,加10mol/L NaOH调pH至8.0,加水至500 ml。
(20)10mol/L NaOH:200g NaOH溶于450ml水中,混匀,再加水至500ml。
(21)5mol/L NaCl:292.25g NaCl,加水至1000ml。
(22)1mol/L HCl:加86.2ml浓盐酸至913.8ml水中。
(23)1mol/L CaCl2:147g CaCl2:2H2O,溶于1000ml水中,高压灭菌,室温保存。
三、固定剂
进行原位杂交的组织或细胞标本常需经固定处理。尽管许多化学物质对组织/细胞有固定作用,但核酸原位杂交的理想固定液应具备如下特点:①能很好地保持组织细胞的状态;②对核酸无抽提、修饰及降解作用;③不改变被检核酸分子在组织细胞内的定位;④对核酸及探针的杂交过程无阻碍作用;⑤固定液本身对杂交信号无遮蔽、掩盖作用,如不使本底增加等;⑥理化性质稳定、价格低廉。
1.4%多聚甲醛(Paraformaldehyde,PFA)

配法:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH值至7.0,使呈清亮状(滴加),再加入约500ml 2×PBS※,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。
注意:①配制时应在通风条件下操作,并避免接触皮肤和吸入(戴手套及口罩),因PFA有较强的固定作用及毒性,对粘膜及皮肤有固定及毒性,刺激作用;②加热时,温度不宜过高,常为60~65℃,否则,PFA降解失效;③配制好的PFA虽可存放一定时间,但过久的液体,固定效果下降,建议尽早使用。
附:固定液用PBS的配制:

配法:按上述比例称取试剂,溶于DEPC水(也可用蒸馏水加DEPC)500~800ml中,过滤后,加水定容至1000ml,高压灭菌。通常配制成10×PBS的储备液,2×PBS和1×PBS可用DEPC水稀释获得。
除用DEPC水配制PFA外,也有用灭菌蒸馏水或经DEPC处理的0.01~0.1mol/L的PBS配制的,方法及注意事项同上。
4% PFA是目前原位杂交组织化学技术中最常用的固定液,它能较好地保持组织及细胞内的RNA,同时对形态保持也较好。通常组织块固定4~12h,载片固定时间在10~15min以内,RNA含量较为恒定。过度延长固定时间会引起细胞内生物大分子的过度交联, 影响探针的穿透力,降低杂交效率。
2.甲醛
①10%甲醛(Formaldehyde, FA)

量取二者充分混合而可。较适于检测RNA的组织及细胞固定,也可用于新鲜冰片切片后固定。
②10%福尔马林试剂:

较适于固定细胞。
③10%中性福尔马林
市售甲醛 100ml
Na2HPO4 4g
NaH2PO4 6.5g
DEPC水 ~1000ml
常用于石蜡样品切片的固定。
10%的甲醛由于有促进DNA双链分子交联的作用,干扰DNA变性,故不适于DNA杂交。在组织或细胞原位杂交中,可通过使用含50%甲酰胺的杂交液使DNA变性解链而解决。这类固定液在DNA/RNA杂交中有较好的效果。
3.4%戊二醛效果较40%差。
4.0.1%戊二醛常用于固定组织,适于新鲜组织冰冻切片及石蜡切片的后固定,常用于检测DNA的原位组织杂交方法。
5.乙醇/醋酸(或冰醋酸)将乙醇与醋酸按3:1的体积比充分混合即可。该液较适于固定细胞的原位杂交,尤其检测DNA时。
乙醇/醋酸虽广泛应用于原位杂交中,但RNA保留较差,可本底很低,即背景染色淡。
6.甲醇/醋酸(3:1)用前按体积比3:1比例充分混合即可。
7.甲醇/丙酮(1:1)适于培养细胞的原位杂交技术。
8.4%多聚甲醇-0.5%~ 1%戊二醛溶液在pH7.4磷酸缓冲液中,用于免疫电镜样品固定。
四、LB培养基
(一)液体LB培养基(Luria-Bertani培养基)

配制:取一1000ml的烧杯,将事先称取好的试剂加入杯内,加H2O约500~800ml搅拌使其溶解完全。用5N的NaOH调pH至7.0,加入H2O定容至1000ml。15磅高压灭20min。
(二)琼脂糖平板培养基
细菌培养用琼脂(或琼脂糖) 15g
液体培养基(如LB) ~1000ml
按浓度比例,将琼脂加入液体培养基(如LB)中,稍加搅拌,用纱布或纸封好瓶口,15磅高压灭菌20min。
五、小量质粒提取主要液体
1.溶液Ⅰ

2.溶液Ⅱ

3.溶液Ⅲ(3mol/L醋酸钠)

加热溶解后,再用冰醋酸(约40ml)调pH至4.8,补足H2O至200ml。
六、杂交前处理
1.蛋白酶(Proteinawe K, Pro.K) 蛋白酶K主要用于杂交前标本处理,其作用是使组织达到一定消化,利于检测分子的穿透,从而提高检测方法的敏感性,但各种组织在不同条件下消化程度不一,因此,具体应用时,应根据组织种类、温度确定反应时间及酶的浓度。过度消化可使组织形态结构遭到明显破坏,核酸分子也会受到影响。通常是将其配成储备液(1mg/ml),临用前,再配成工作液(约0.025mg/ml)。配制方法:

精心称药,将二者充分混合后,分装成小份,-20℃存放,用时再取出冻融,余者弃去。
(2)工作液(临用前配):
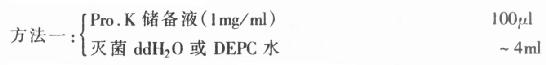
取储备液(1mg/ml)按1:40稀释,充分混合,即得约含Pro.K为25mg/ml的工作液。
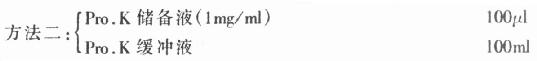
(3)关于P-K缓冲液的配制:

称取上述试剂,充分混合即可。
②1mol/L 的Tris-HCl(pH8.0):

先将Tris于800ml ddH2O中溶解,用HCl将pH调至8.0,ddH2O定溶于1000ml,高压灭菌,室温备用即可。
③0.5mol/L的EDTA:

称取EDTA溶于约600ml ddH2O中,常需60℃持续搅拌以助溶,滴加NaOH至pH接近8.0时,EDTA才开始溶解。待完全溶解后,冷却至室温,NaOH调pH至8.0,ddH2O定溶至1000ml,高压灭菌,室温备用。
2.甘氨酸
(1)1mol/L甘氨酸:

称取甘氨酸75g溶于ddH2O或DEPC水中,最后补足ddH2O定容至1000ml,高压灭菌备用。该液为储备液,-20℃储存。
(2)甘氨酸工作液(0.1mol/L):

将二者按1:10比例稀释,即得甘氨酸工作液。一般要求临用前新鲜配制。
甘氨酸有终止蛋白酶K作用的作用,以防过度消化。
3.0.25%醋酸-0.25%醋酸酐

配制:按上述配方,先以少许DEPC水溶解NaCl,然后加入三乙醇胺及浓HCl。DEPC水定容至约1000ml(997.5ml),临用前,一边摇动溶液一边加入醋酸酐,充分混合。注意操作时避免浓HCl 溅出,最好在通风条件下进行。
生物体内有些组织,如神经组织中的蛋白质,对带负电荷的核酸探针较易吸附。经该液乙酰化处理后,可使切片标本表现带上负电荷,有排斥带负电的核酸探针,减少非特异吸附,降低反应背景的作用。
4.RNA酶溶液

取RNA酶A溶解于100ml DEPC水中,分装成小份(1ml, 10mg/ml),-20℃储存。
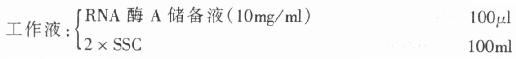
临用前,取RNA酶A储备液,用2×SSC溶解配成工作液(0.01mg/ml).
5.0.2%

取2ml Triton X-100加入998ml PBS中,充分振荡使其充分混合。
七、杂交用液
1.SSC(Standard Saline Citrate, SSC)
通常配成10×,20×,50×的储备液,如下:

配制:先称取上述两种试剂,溶于约800ml ddH2O中,滴加10N的NaOH,将pH值调至7.0,补足 ddH2O至1000ml,加入终浓度为0.1%~0.2%的DEPC,分装后高压灭菌,可室温保存。
该液主要用于配制予杂交液及杂交后的各种洗脱液,以保持一定的离子强度。此外,在用于杂交的湿盒内也常用5×的SSC以保持一定湿度。
2.Denhardt’s液
通常配成10×,50×或100×的储备液

配制:称取上述试剂,溶于800ml左右灭菌ddH2O中,定容至1000ml后,过滤后于-20℃保存备用。
该液用于配制杂交液及予杂交液等。
3.杂交液及予杂交液

※:临用前加;△予杂交液不加
配制:先以去离子甲酰胺与SSC于室温混合,加入硫酸葡聚糖于50℃促溶,依次加入其它成份。硫酸葡聚糖在室温常需数小时才能完全溶解。有时需旋涡振荡。定容后充分混合。根据使用方便可分装(最好用铝箔将瓶子包好)存于4℃,可达数月。注意,杂交缓冲液在使用前切忌污染。
变性被打断的无关DNA(常为鲑精DNA或鲱精DNA)可在予杂交及杂交前加入。此外,有许多物质如肝素、多聚腺甘酸、醋酸钠等多种成份,可根据需要加入杂交液中,上述配方所列只是不可缺少的基本成份。
配制好的杂交液不宜反复冻融,否则易产生硫酸葡聚糖沉淀现象。使用前最好加热至50℃,使其充分溶解后再加入探针分子。至于探针的浓度视实验目的、探针类型及标记方法而异。通常RNA探针分子浓度为0.5~2μg/ml,DNA探针浓度为1μg/ml,此外,如使用35S标记的探针,还需加入终浓度为100mmol/L的二硫苏糖醇(Dithiothreitol,DTT)至杂交液及杂交后的洗脱液中。
八、杂交后漂洗溶液
无论用何种标记方法及何种信号显示方法,在杂交后洗脱则是大同小异。在此,归纳几种带有共同性及常用的洗脱液。

该液常用于杂交后的初次洗脱,故离子强度(张力)较高。

该液常用于杂交后的第二次洗脱,离子强度较低,经过上述两套洗脱液洗后,有的还可用2×SSC,10%(0.1%)SDS洗脱。

主要是洗去残留的RNA,降低背景。用于以RNA为探针的原位杂交方法中。
4.Dig标记探针杂交后处理液

用ddH2O溶液并定容至1000ml。

用ddH2O溶解并定容至1000ml。

配制同上。

左旋咪唑有消除内源性磷酸酶的作用。
九、原位杂交信号显示
目前应用原位杂交方法中,信号的显示主要有放射自显影,酶底物及免疫金银等方法,在此归纳有关的主要试剂。
1.A-B显影液

称取上述试剂,按配方分别溶于50ml ddH2O中,于显影前,在室温将两者(A液及B液)按1:1混合,稍加摇动促进混合,即可将贴有切片标本的切片放入显影液,于室温避光(可暗室)反应5~15min。显影时间和温度相关,需自己根据情况摸索。终止反应只需将显影液倒出,自来水冲洗即可。倒出的AB显影液可暂时不扔,光镜下观察,若明显显影不够,还可重新或继续显影。AB显影液要求临用前配制,在显影时才将AB二液混合。否则,A液过久会产生黄色沉淀,增加背景。
AB液用于免疫金银法中,使金标记颗粒信号放大, 形成棕黑色沉淀。
2.DAB-H2O显色液

配制方法见附录一。
该液用于标本被标记上辣根过氧化物酶(HRP)的方法。产物为棕黄色。
3.NBT-BCIP显色液

配制方法,详见附录一。
该液用于有碱性磷酸酶标记物的方法中。产物为紫蓝色。
4.Kodak D-19显影液
<, http://www.100md.com(吴康 蔡文琴)