男性骨质疏松症
一、男性骨质疏松流行病学的特征
男性骨质疏松症患病率的评估目前一般仍参照1994年WHO 864号技术文件公布的骨质疏松定义和诊断标准,即按骨密度值低于青年人参考范围2.5SD来评估。
1.男性骨质疏松的患病率虽低于女性,但亦有相当严重程度。
美国男性骨质疏松的患病率:美国国家健康和营养调研(NHANES III)报告,采用DEXA测定股骨颈部位骨密度按WHO T-Score<-2.5标准进行评估,50岁以上的骨质疏松患病率男性为3%-6%,女性为13-18%;骨量低下男性为28-47%,女性为13-18%;骨量低下男性为28-47%,而女性为30-50%(JBMR,1997,12(11):1769-71)。Orwell进一步报告,根据检测部位和检测方法的不同,50岁以上男性骨质疏松的患病率,可有4-28%的差异(股骨颈部位9%,总髋部4%,L1-4椎体4%,跟骨5%,QCT椎体28%,前臂远端8%),若将QCT检测的结果则50岁以上男性骨质疏松的患病率在4-9%间(JBMR,2000,Suppl
, 百拇医药
1,s169),低于在美国明尼苏达州调研13%的报告(JBMR 1992,7:1005-1010),即美国两地报告50岁以上男性,骨质疏松的患病率为4-13%。
韩国男性骨质疏松患病率:应用DEXA技术,按WHO诊断标准,椎体和股骨颈部位分别为50-59岁组14.3%和1.5%,60-69岁组25.0%和12.5%,70-79岁组33.3%和27.3%(Osteoporos
Int 1997,7 Csuppl. S3:S88-90)。我国男性骨质疏松的患病率,北京地区报告60岁、70岁、80岁组分别为14.3%、20.9%和31.9%;上海地区报导20-49、50~、60~、70~、80~、90~岁组分别为2.8%、2.4%、4.1%、7.3%、9.7%和25.5%,总患病率为6.3%,50岁以上为6.1%,60岁以上为7.0%。
, 百拇医药
男性骨折率低于女性的可能原因:
(1) 骨量发育差异。在青春期男性骨量的积聚高于女性,总骨矿含量年青男性可达3100-3500克,而女性为2300-2700克;小梁骨宽度大于女性20%,皮质骨宽度亦明显大于女性,并延续终生。其次是骨髂体积如椎体横截面面积大于女性25%,具有更好的生物力学性能。
(2) 骨量丢失率的差异。增龄性的骨矿丢失,女性大于男性,尤其在长骨,皮质骨的空泡化更甚于男性,男性骨内膜面的丢失更多而外膜面的增生女性又小于男性。
(3) 跌倒机会少。
(4) 平均期望寿命男性短于女性,老年人口数量男性少于女性。
2.男性骨折的流行病学特征
总骨折发病率在青、中年期男性高于女性(Osteoporos,Int 1999,10:240-47),40-50岁期间女性骨盆、肱骨、前臂和股骨部位骨折更多见,总骨折发生率与男性相当,60岁以上老年人男性为29%,女性为56%(Osteoporos,Int.
, 百拇医药
1994,4(5):277-82),以后随着增龄女性骨折发病率快速增加,男性约晚5-10年自60岁后也出现类似变化(J.Epi
commun. Health 1990,44:241-245)。
图2 男女骨折不同部位患病率比较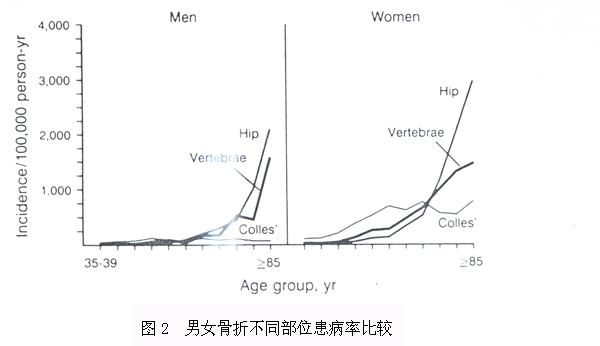
(请点击,可放大)
髋部骨折:按人年发病率统计,50岁以上人群男性为6-11%,女性为17-22.7%(J. Clin Epidemiol,1988,41(10):985-94)。来自美国74.5万老年人群研究,65岁以上男性老人髋部骨折的发病率为4-5/1000,女性8-10/1000,(Am.J.
, 百拇医药
Public Health,1990,80:871-73)。欧、澳洲的报告男和女的比例大致为1:2-3;在南欧男女两性髋部骨折率都较低,发病率大致相同;在亚洲,则两性极低。横向研究显示,50岁后男性髋部骨折的增龄危险性在5-6年后可达女性相同水平,即80岁的老年男性相当于75岁女性髋部骨折发生率(BMJ,1997,315(7102):221-5)。一年后髋部骨折的死亡率男性为女性的1.5倍。
椎体骨折:由于诊断标准不统一,椎骨骨折患者也常不收院治疗,流调材料尚有限制,长期以来认为椎体骨折在男性少见,近年调研,大致为女性之半
(Bone 1992,13S1-S10)。欧州地区报告65岁后椎体骨折的患病率实际上男性高于女性(JBMR 1996,11:1010-1018),大多呈前压迫型(楔形),压扁型则明显少于女性。
其他部位骨折:尺桡骨、肱骨、骨盆、股骨干部位的骨折在男性多见于年青时,中年期仍稳定在原来水平,但在女性则随增龄而快速增加,仅在75岁后男性的肋骨骨折才有增龄性变化。值得重视的有前臂远端骨折和胫骨骨折的男性老人,常是增加髋部骨折危险的信号。
, http://www.100md.com
3.导致男性骨折危险因素的特点:
(1) 骨量:骨密度与骨折的危险度在女性不论回顾性研究或前瞻性研究明确相关,而在男性则研究资料较少,但有限资料提示情况与女性类似,但男性一旦有骨折史则再次骨折的危险性较女性更强烈,即使发生在中年,也会明显增加晚年骨折的危险性。
(2) 跌倒:除骨量因素外,跌倒是妇女导致骨折另一重要决定因素,但在男性危害性小于女性,但在非外伤性骨折的男性患者身体不稳性(摇晃)和握力减小较非骨折的男性明显(BMJ,1993,307:1111-1115)。跌倒的方式男女有差别可影响骨折的类型。
二、男性骨量增龄性变化特点
1.骨量变化:
椎体部位:男性骨量峰值晚于女性2-4年而高于女性,增龄相关的骨丢失晚于女性但丢失速率快于女性(图3)。(Am J Epidemiol,1998,147:871-879)。
, 百拇医药
图3 男女在椎体部骨密度(BMD)和骨矿含量(BMC)的增龄性变化
(请点击,可放大)
周围骨:骨质骨量自50岁以后开始丢失速度低于女性,但纵向研究显示,丢失速率可达5-10%/10年,而不如以前估计的1-3%/10年。
2.骨结构变化:
男女两性变化类似均表现有增龄性的骨皮质空泡化,骨小梁数量减少、变薄,但在椎体组织形态上仍显示性别差异,小梁骨的丢失数以及小梁的断裂男性少于女性,骨骼负荷性能有较好的保留。
三、病理生理
男性骨质疏松症有类似女性绝经后骨质疏松症的发病机理,包括性激素、营养、体力活动、生活方式等因素,在女性性激素因素是主要因素,在男性则涉及雄激素的因素,但其与骨的联系远不如雌激素那样明确。
, 百拇医药
1.雄激素问题:
(1) 对骨细胞的作用:骨质疏松症的发病机理简而言之可视作成骨和破骨细胞之间功能失衡。成骨和破骨细胞表面均雄激素的受体,在每个成骨细胞表面有1000-3000个联结部位,并存在5a-还原酶,转化睾酮为具有最大生物活性的5a-脱氢睾酮(5a-DHT)。骨组织细胞还存在芳香化酶活性,可转化肾上腺睾酮为雌二醇,而雌激素在骨代谢起着重要作用。
雄激素大多数情况下具有刺激成骨细胞增殖和分化,调节成骨细胞生长因子和细胞因子的产生(见后)。脱氢表雄酮(DHEA)一般认为是前激素,在各种组织中转化为肾上腺睾酮。DHEA可导致人成骨细胞C-fos
mRNA快速下降,睾酮、5a-DHT和DHEA都能明显增加这些细胞转化生长因子的活性。
(2) 雄激素对骨密度的作用。
, 百拇医药
雄性激素对骨骼的作用在青春发育期就明显地表现出来,骨骼粗壮,长骨的皮质骨厚度与直径明显大于女性,但在老化增龄过程中,雄激素对骨密度的作用仍不明确,有的观察血中总睾酮水平或生物活性睾酮的水平与男性各部位的BMD明显相关(BMJ,1990,300:1361-64;Bone
Miner,1993,20:133-40),有些报告则并不相关,仅在桡骨处有轻度相关。
血循环中DHEA及其硫酸酯(DHEAS)是肾上腺雄激素主要成份,DHEAS经酶介转化为DHEA。血清DHEA 20岁时达峰值,以每10年下降10%,80岁后加速降低,是衰老过程中激素类变化最大的一种,与男性骨密度的相关性不确定,而在女性则与骨密度相关。
(3) 外源性雄激素对骨密度和骨转换的作用:
对性腺功能正常的患者作用不肯定,对性腺功能低下的患者则有明显作用。观察外源性雄激素对骨密度的作用多见于对绝经期妇的研究,而对男性老人相对较少。在正常性腺功能的男性骨质疏松患者,肌注睾酮后6个月后尿脱氧吡啶啉下降19%,I型胶原N端肽下降39%,椎体BMD增加5%,对髋部骨密度无影响(Bone,1996,18:171-77)。睾酮对BMD的影响,似乎取决于体内睾酮的水平在Snyder的研究中,睾酮治疗对低正常睾酮水平的男性BMD无明显作用,但在线性回归分析后发现,治疗前睾酮水平愈低,对椎体BMD的作用愈大(J.Clin
, http://www.100md.com
Endocrinol. Metab. 1999,84:1966-72)。在性腺功能减退的男性患者,睾酮治疗能明显的改善骨密度(图5),Finkelstein等在21例性腺功能低下患者睾酮治疗2年,皮质骨和小梁骨BMD可增加13%。
图4 血睾酮水平与睾酮治疗对腰椎2~4骨密度的作用
(请点击,可放大)
2.雌激素:
在男性骨质疏松的发病机理中也起重要作用。雌激素受体(ER-a)基因突变或芳香化酶基因突变的男性患者,血雌激素靶作用减弱或缺乏雌激素,伴有严重的低骨量。动物实验:ER-a基因敲击(ERaKO)的鼠,骨量下降20-25%(Endoe
, 百拇医药
Rev 199,20:359-71)而敲击B雌激素受体(ER-β)基因,则无骨的异常变化;男性无女性样明显的绝经期。男性雄激素的增龄变化与女性不同,前者呈渐进性衰退,而在妇女一旦绝经,雌激素就明显下降。雄激素自中青年起至90岁,总睾酮的水平并无明显改变,同时男性血雌二醇水平也几乎没有增龄变化,但生物有效性的睾酮水平则下降约70%,生物有效性雌二醇降低50%,而这种降低也是随年龄呈渐进性的变化。
图5 男性血总睾酮、雌二醇水平(上图A,B)和生物有效性
总睾酮、雌二醇(下图A,B)的增龄变化
(请点击,可放大)
EraOK鼠在去睾后骨量进一步下降。应用芳香化酶抑制剂的雄性鼠,骨量下降,芳香化酶基因敲击的鼠骨量也低下,患有芳香酶缺陷的男性,骨发育受障碍。
, 百拇医药
3.生长因子与男性骨质疏松:
生长因子在男性同样呈现增龄性下降,其胰岛素样生长因子(IGF-I)和其联结蛋白-3(IGFBP-3)与骨密度密切相关程度与女性有明显差别,在男性IGF-1对骨的作用近乎于性激素,应用生长因子治疗,明显优于女性。
4.营养素问题:
钙摄入不足,PTH水平增高,1.25(OH)2D3处低正常水平,都与女性一样,在骨质疏松的发病机理中起着作用,尤其对男性轴心骨的影响。钙摄入与髋部骨折在男性的相关性各家报告不一致。
5.体重与体力活动:
在男性肌肉力量对骨量起很大作用,可能是造成骨量与骨结构性别差异的原因之一。肌肉强度和体积与骨密度的关系密切;运动也与髋部骨折的降低明显相关,体重与骨密度的关系与女性类似,因此在男性骨质疏松中,随着增龄而出现的活动减少,肌力下降类似于长期的废用状态导致骨量丢失可能更是男性的特点。
, 百拇医药
四、临床
男性骨质疏松症发病年龄70岁以上,至于一些原因不明的特发性男性骨质疏松,则年龄跨度很大,从青年至高龄老人均可。除了与女性骨质疏松有相似的临床特点的,成骨功能的明显低落则更为突出,可能与生长因子的增龄改变有关。继发性骨质疏松在男性骨质疏松症中占重要地位,明显高于女性,在椎骨骨折的男性患者中,30-60%系其他疾病所致,如糖皮质激素性占男性继发性骨质疏松症16-18%;性腺功能低下症在青春发育期是影响骨量发育不良的重要原因,在成年后也是造成低骨量的原因。椎骨骨折的男性患者,存在性激素功能低下者达5-33%,髋部骨折也常见于这类男性老人。
酗酒与骨量呈负相关,骨丢失速率增快,成骨细胞可能是酒精的靶点,酗酒者成骨细胞及成骨能力明显降低,成骨细胞合成骨钙素和DNA合成能力下降,45分钟口服酒精50g,2小时后血清骨钙素降低30%,但亦有报告适量饮酒可增加骨密度。
吸烟者男性多于女性,椎骨骨折危险度可增加2.3倍,桡骨骨量丢失率明显高于非吸烟者1.4倍,机制尚不明确。在男性,尿路结石患者与骨量降低相关,男性高钙尿症为女性的2倍,机制不明。
, 百拇医药
五、诊断
诊断步骤类同女性骨质疏松症,对有轻微外伤骨折史或放射摄片已有明显骨丢失的证据,或存在可引起骨质疏松的疾病时均应进一步作骨密度检查。若骨密度(BMD)正常可作随访观察,如BMD低于青年峰值2.5标准差(SD),应进一步询问病史,体检和常规实验室检查
明确骨量丢失的原因应予相应治疗,若仍无法解释骨丢失的原因则应进一步测定血清25(OH)D3、睾酮、24小时尿钙和血清蛋白电泳,若仍不阐明病因时,即可能属特发性式原发性骨质疏松症。
根据骨密度诊断骨质疏松时可参照女性标准,尤其要重视与骨软化的鉴别诊断,在男性骨髋部骨折患者中,<4%至40%存在骨软化,大多数在20%左右,当然女性骨折患者骨软化者较男性更多,有些报告则男女差别不大。
六、治疗
, 百拇医药 骨质疏松症的防治药物,根据主要的作用机制,习惯分为抑制骨吸收和促进骨形成两类。骨吸收抑制药物主要有双膦酸盐、降钙素等。促进骨形成药物主要有甲状旁腺激素、氟化物、生长激素等。
钙剂与维生素D3。钙剂与维生素D3是骨质疏松预防的基础药物,但在骨质疏松的治疗中仅作为辅助药物使用。钙剂和维生素D3必须联合使用,钙剂只有在活性维生素D3的作用下方可被骨骼有效的利用。活性维生素D3的一个优点是还可增强肌力、提高神经肌肉活性。
双膦酸盐(BPs)对骨质有高亲和性,可抑制破骨细胞活性,抑制骨的重吸收,但口服生物利用度低,应空腹单独使用。双膦酸盐可以长期停留在骨骼中,不断发挥其生物效能。不仅能增加骨量,还可以降低骨质疏松性骨折的发生率,在骨质疏松症的防治中应用最为广泛。比如阿伦膦酸钠,可用于骨质疏松症的预防和治疗。
降钙素,目前应用的均为人工合成品,为骨吸收抑制剂。可通过抑制破骨细胞功能,降低骨的重吸收,从而改善骨质量,提高力学性能,促进骨折愈合,而且能明显缓解骨质疏松性疼痛。研究表明是骨质疏松性骨折的一种重要选择。因为是生物制剂,少数患者可出现不良反应。
, http://www.100md.com
甲状旁腺激素是刺激男性骨质代谢的强效激素,可刺激骨质合成,增加骨密度,改善骨骼的生物力学特性,是很有希望的骨形成促进剂,但有待更多的应用研究资料。
氟化物的治疗效果一直存在争议。近年的研究显示,只要剂量适当,氟剂能提高BMD和降低骨折率。
睾酮补充治疗(TST):
应用睾酮实施雄激素替代治疗在性腺功能减退症的男性对骨量有明确的正性作用,雄激素有利骨骼的阈值水平尚不清楚。在性激素正常的男性骨量低下患者,应用睾酮对骨是否有益尚不能确定。在青春发育期,正处峰值骨量发育时期,性激素起很大作用,如果此时患有器质性的性腺功能减退症,睾酮治疗可使骨骼获益,但是否能达到峰值量则不很明确。在老年男性随着增龄,雄激素水平下降,采用睾酮的雄激素替代治疗,可改善骨密度和骨的。由于雄激素可影响前列腺,因此前列腺肥大患者应慎用,怀疑或确诊前列腺癌者应禁用。
, http://www.100md.com
睾酮治疗能增加骨质密度,改善身体组成,降低脂肪量,增加肌肉量,增强力量和精力,改善精神和情绪症状。对肌肉力量、心理、性功能及心血管功能等方面也具有有利影响。适应于睾酮水平在12nnol/L以下、有睾酮缺乏的临床表现的患者。
雄激素替代治疗一般选用口服剂或注射剂型二种剂型的药物。由于对肝脏毒性和前列腺的影响应严格选择患者,口服剂睾酮优于注射剂型,血睾酮水平较平衡,不会出现因注射出现血睾酮超正常生理水平而抑制睾丸功能的缺点,但其生物利用度较低,有肝首过效应与肝毒性。
十一酸睾酮(胶丸/胶囊),溶于油酸,通过淋巴系统吸收,在体内的作用途径与天然睾酮一样[代谢产生双氢睾酮(DHT)、睾酮(T)和雌二醇(E2)],具有完全的雄激素活性。没有肝首过效应,口服剂型剂量易于调整,另外,经过临床有效性和安全性研究,对肝脏及前列腺无甚影响,是理想的雄激素替代治疗药物。
合理的饮食、适当的运动、良好的生活习惯(对男性尤为重要)、慎重用药等非药治疗方法,在男性骨质疏松的防治中同样有重要的地位。
思考问题:
男性骨质疏松症的流行病学特点。
雄激素在男性骨质疏松病理的地位。
雄激素替代治疗应注意什么?
责任编辑:王薇, http://www.100md.com
男性骨质疏松症患病率的评估目前一般仍参照1994年WHO 864号技术文件公布的骨质疏松定义和诊断标准,即按骨密度值低于青年人参考范围2.5SD来评估。
1.男性骨质疏松的患病率虽低于女性,但亦有相当严重程度。
美国男性骨质疏松的患病率:美国国家健康和营养调研(NHANES III)报告,采用DEXA测定股骨颈部位骨密度按WHO T-Score<-2.5标准进行评估,50岁以上的骨质疏松患病率男性为3%-6%,女性为13-18%;骨量低下男性为28-47%,女性为13-18%;骨量低下男性为28-47%,而女性为30-50%(JBMR,1997,12(11):1769-71)。Orwell进一步报告,根据检测部位和检测方法的不同,50岁以上男性骨质疏松的患病率,可有4-28%的差异(股骨颈部位9%,总髋部4%,L1-4椎体4%,跟骨5%,QCT椎体28%,前臂远端8%),若将QCT检测的结果则50岁以上男性骨质疏松的患病率在4-9%间(JBMR,2000,Suppl
, 百拇医药
1,s169),低于在美国明尼苏达州调研13%的报告(JBMR 1992,7:1005-1010),即美国两地报告50岁以上男性,骨质疏松的患病率为4-13%。
韩国男性骨质疏松患病率:应用DEXA技术,按WHO诊断标准,椎体和股骨颈部位分别为50-59岁组14.3%和1.5%,60-69岁组25.0%和12.5%,70-79岁组33.3%和27.3%(Osteoporos
Int 1997,7 Csuppl. S3:S88-90)。我国男性骨质疏松的患病率,北京地区报告60岁、70岁、80岁组分别为14.3%、20.9%和31.9%;上海地区报导20-49、50~、60~、70~、80~、90~岁组分别为2.8%、2.4%、4.1%、7.3%、9.7%和25.5%,总患病率为6.3%,50岁以上为6.1%,60岁以上为7.0%。

, 百拇医药
男性骨折率低于女性的可能原因:
(1) 骨量发育差异。在青春期男性骨量的积聚高于女性,总骨矿含量年青男性可达3100-3500克,而女性为2300-2700克;小梁骨宽度大于女性20%,皮质骨宽度亦明显大于女性,并延续终生。其次是骨髂体积如椎体横截面面积大于女性25%,具有更好的生物力学性能。
(2) 骨量丢失率的差异。增龄性的骨矿丢失,女性大于男性,尤其在长骨,皮质骨的空泡化更甚于男性,男性骨内膜面的丢失更多而外膜面的增生女性又小于男性。
(3) 跌倒机会少。
(4) 平均期望寿命男性短于女性,老年人口数量男性少于女性。
2.男性骨折的流行病学特征
总骨折发病率在青、中年期男性高于女性(Osteoporos,Int 1999,10:240-47),40-50岁期间女性骨盆、肱骨、前臂和股骨部位骨折更多见,总骨折发生率与男性相当,60岁以上老年人男性为29%,女性为56%(Osteoporos,Int.
, 百拇医药
1994,4(5):277-82),以后随着增龄女性骨折发病率快速增加,男性约晚5-10年自60岁后也出现类似变化(J.Epi
commun. Health 1990,44:241-245)。
图2 男女骨折不同部位患病率比较

(请点击,可放大)
髋部骨折:按人年发病率统计,50岁以上人群男性为6-11%,女性为17-22.7%(J. Clin Epidemiol,1988,41(10):985-94)。来自美国74.5万老年人群研究,65岁以上男性老人髋部骨折的发病率为4-5/1000,女性8-10/1000,(Am.J.
, 百拇医药
Public Health,1990,80:871-73)。欧、澳洲的报告男和女的比例大致为1:2-3;在南欧男女两性髋部骨折率都较低,发病率大致相同;在亚洲,则两性极低。横向研究显示,50岁后男性髋部骨折的增龄危险性在5-6年后可达女性相同水平,即80岁的老年男性相当于75岁女性髋部骨折发生率(BMJ,1997,315(7102):221-5)。一年后髋部骨折的死亡率男性为女性的1.5倍。
椎体骨折:由于诊断标准不统一,椎骨骨折患者也常不收院治疗,流调材料尚有限制,长期以来认为椎体骨折在男性少见,近年调研,大致为女性之半
(Bone 1992,13S1-S10)。欧州地区报告65岁后椎体骨折的患病率实际上男性高于女性(JBMR 1996,11:1010-1018),大多呈前压迫型(楔形),压扁型则明显少于女性。
其他部位骨折:尺桡骨、肱骨、骨盆、股骨干部位的骨折在男性多见于年青时,中年期仍稳定在原来水平,但在女性则随增龄而快速增加,仅在75岁后男性的肋骨骨折才有增龄性变化。值得重视的有前臂远端骨折和胫骨骨折的男性老人,常是增加髋部骨折危险的信号。
, http://www.100md.com
3.导致男性骨折危险因素的特点:
(1) 骨量:骨密度与骨折的危险度在女性不论回顾性研究或前瞻性研究明确相关,而在男性则研究资料较少,但有限资料提示情况与女性类似,但男性一旦有骨折史则再次骨折的危险性较女性更强烈,即使发生在中年,也会明显增加晚年骨折的危险性。
(2) 跌倒:除骨量因素外,跌倒是妇女导致骨折另一重要决定因素,但在男性危害性小于女性,但在非外伤性骨折的男性患者身体不稳性(摇晃)和握力减小较非骨折的男性明显(BMJ,1993,307:1111-1115)。跌倒的方式男女有差别可影响骨折的类型。
二、男性骨量增龄性变化特点
1.骨量变化:
椎体部位:男性骨量峰值晚于女性2-4年而高于女性,增龄相关的骨丢失晚于女性但丢失速率快于女性(图3)。(Am J Epidemiol,1998,147:871-879)。
, 百拇医药
图3 男女在椎体部骨密度(BMD)和骨矿含量(BMC)的增龄性变化

(请点击,可放大)
周围骨:骨质骨量自50岁以后开始丢失速度低于女性,但纵向研究显示,丢失速率可达5-10%/10年,而不如以前估计的1-3%/10年。
2.骨结构变化:
男女两性变化类似均表现有增龄性的骨皮质空泡化,骨小梁数量减少、变薄,但在椎体组织形态上仍显示性别差异,小梁骨的丢失数以及小梁的断裂男性少于女性,骨骼负荷性能有较好的保留。
三、病理生理
男性骨质疏松症有类似女性绝经后骨质疏松症的发病机理,包括性激素、营养、体力活动、生活方式等因素,在女性性激素因素是主要因素,在男性则涉及雄激素的因素,但其与骨的联系远不如雌激素那样明确。
, 百拇医药
1.雄激素问题:
(1) 对骨细胞的作用:骨质疏松症的发病机理简而言之可视作成骨和破骨细胞之间功能失衡。成骨和破骨细胞表面均雄激素的受体,在每个成骨细胞表面有1000-3000个联结部位,并存在5a-还原酶,转化睾酮为具有最大生物活性的5a-脱氢睾酮(5a-DHT)。骨组织细胞还存在芳香化酶活性,可转化肾上腺睾酮为雌二醇,而雌激素在骨代谢起着重要作用。
雄激素大多数情况下具有刺激成骨细胞增殖和分化,调节成骨细胞生长因子和细胞因子的产生(见后)。脱氢表雄酮(DHEA)一般认为是前激素,在各种组织中转化为肾上腺睾酮。DHEA可导致人成骨细胞C-fos
mRNA快速下降,睾酮、5a-DHT和DHEA都能明显增加这些细胞转化生长因子的活性。
(2) 雄激素对骨密度的作用。
, 百拇医药
雄性激素对骨骼的作用在青春发育期就明显地表现出来,骨骼粗壮,长骨的皮质骨厚度与直径明显大于女性,但在老化增龄过程中,雄激素对骨密度的作用仍不明确,有的观察血中总睾酮水平或生物活性睾酮的水平与男性各部位的BMD明显相关(BMJ,1990,300:1361-64;Bone
Miner,1993,20:133-40),有些报告则并不相关,仅在桡骨处有轻度相关。
血循环中DHEA及其硫酸酯(DHEAS)是肾上腺雄激素主要成份,DHEAS经酶介转化为DHEA。血清DHEA 20岁时达峰值,以每10年下降10%,80岁后加速降低,是衰老过程中激素类变化最大的一种,与男性骨密度的相关性不确定,而在女性则与骨密度相关。
(3) 外源性雄激素对骨密度和骨转换的作用:
对性腺功能正常的患者作用不肯定,对性腺功能低下的患者则有明显作用。观察外源性雄激素对骨密度的作用多见于对绝经期妇的研究,而对男性老人相对较少。在正常性腺功能的男性骨质疏松患者,肌注睾酮后6个月后尿脱氧吡啶啉下降19%,I型胶原N端肽下降39%,椎体BMD增加5%,对髋部骨密度无影响(Bone,1996,18:171-77)。睾酮对BMD的影响,似乎取决于体内睾酮的水平在Snyder的研究中,睾酮治疗对低正常睾酮水平的男性BMD无明显作用,但在线性回归分析后发现,治疗前睾酮水平愈低,对椎体BMD的作用愈大(J.Clin
, http://www.100md.com
Endocrinol. Metab. 1999,84:1966-72)。在性腺功能减退的男性患者,睾酮治疗能明显的改善骨密度(图5),Finkelstein等在21例性腺功能低下患者睾酮治疗2年,皮质骨和小梁骨BMD可增加13%。
图4 血睾酮水平与睾酮治疗对腰椎2~4骨密度的作用

(请点击,可放大)
2.雌激素:
在男性骨质疏松的发病机理中也起重要作用。雌激素受体(ER-a)基因突变或芳香化酶基因突变的男性患者,血雌激素靶作用减弱或缺乏雌激素,伴有严重的低骨量。动物实验:ER-a基因敲击(ERaKO)的鼠,骨量下降20-25%(Endoe
, 百拇医药
Rev 199,20:359-71)而敲击B雌激素受体(ER-β)基因,则无骨的异常变化;男性无女性样明显的绝经期。男性雄激素的增龄变化与女性不同,前者呈渐进性衰退,而在妇女一旦绝经,雌激素就明显下降。雄激素自中青年起至90岁,总睾酮的水平并无明显改变,同时男性血雌二醇水平也几乎没有增龄变化,但生物有效性的睾酮水平则下降约70%,生物有效性雌二醇降低50%,而这种降低也是随年龄呈渐进性的变化。
图5 男性血总睾酮、雌二醇水平(上图A,B)和生物有效性
总睾酮、雌二醇(下图A,B)的增龄变化

(请点击,可放大)
EraOK鼠在去睾后骨量进一步下降。应用芳香化酶抑制剂的雄性鼠,骨量下降,芳香化酶基因敲击的鼠骨量也低下,患有芳香酶缺陷的男性,骨发育受障碍。
, 百拇医药
3.生长因子与男性骨质疏松:
生长因子在男性同样呈现增龄性下降,其胰岛素样生长因子(IGF-I)和其联结蛋白-3(IGFBP-3)与骨密度密切相关程度与女性有明显差别,在男性IGF-1对骨的作用近乎于性激素,应用生长因子治疗,明显优于女性。
4.营养素问题:
钙摄入不足,PTH水平增高,1.25(OH)2D3处低正常水平,都与女性一样,在骨质疏松的发病机理中起着作用,尤其对男性轴心骨的影响。钙摄入与髋部骨折在男性的相关性各家报告不一致。
5.体重与体力活动:
在男性肌肉力量对骨量起很大作用,可能是造成骨量与骨结构性别差异的原因之一。肌肉强度和体积与骨密度的关系密切;运动也与髋部骨折的降低明显相关,体重与骨密度的关系与女性类似,因此在男性骨质疏松中,随着增龄而出现的活动减少,肌力下降类似于长期的废用状态导致骨量丢失可能更是男性的特点。
, 百拇医药
四、临床
男性骨质疏松症发病年龄70岁以上,至于一些原因不明的特发性男性骨质疏松,则年龄跨度很大,从青年至高龄老人均可。除了与女性骨质疏松有相似的临床特点的,成骨功能的明显低落则更为突出,可能与生长因子的增龄改变有关。继发性骨质疏松在男性骨质疏松症中占重要地位,明显高于女性,在椎骨骨折的男性患者中,30-60%系其他疾病所致,如糖皮质激素性占男性继发性骨质疏松症16-18%;性腺功能低下症在青春发育期是影响骨量发育不良的重要原因,在成年后也是造成低骨量的原因。椎骨骨折的男性患者,存在性激素功能低下者达5-33%,髋部骨折也常见于这类男性老人。
酗酒与骨量呈负相关,骨丢失速率增快,成骨细胞可能是酒精的靶点,酗酒者成骨细胞及成骨能力明显降低,成骨细胞合成骨钙素和DNA合成能力下降,45分钟口服酒精50g,2小时后血清骨钙素降低30%,但亦有报告适量饮酒可增加骨密度。
吸烟者男性多于女性,椎骨骨折危险度可增加2.3倍,桡骨骨量丢失率明显高于非吸烟者1.4倍,机制尚不明确。在男性,尿路结石患者与骨量降低相关,男性高钙尿症为女性的2倍,机制不明。
, 百拇医药
五、诊断
诊断步骤类同女性骨质疏松症,对有轻微外伤骨折史或放射摄片已有明显骨丢失的证据,或存在可引起骨质疏松的疾病时均应进一步作骨密度检查。若骨密度(BMD)正常可作随访观察,如BMD低于青年峰值2.5标准差(SD),应进一步询问病史,体检和常规实验室检查
明确骨量丢失的原因应予相应治疗,若仍无法解释骨丢失的原因则应进一步测定血清25(OH)D3、睾酮、24小时尿钙和血清蛋白电泳,若仍不阐明病因时,即可能属特发性式原发性骨质疏松症。
根据骨密度诊断骨质疏松时可参照女性标准,尤其要重视与骨软化的鉴别诊断,在男性骨髋部骨折患者中,<4%至40%存在骨软化,大多数在20%左右,当然女性骨折患者骨软化者较男性更多,有些报告则男女差别不大。
六、治疗
, 百拇医药 骨质疏松症的防治药物,根据主要的作用机制,习惯分为抑制骨吸收和促进骨形成两类。骨吸收抑制药物主要有双膦酸盐、降钙素等。促进骨形成药物主要有甲状旁腺激素、氟化物、生长激素等。
钙剂与维生素D3。钙剂与维生素D3是骨质疏松预防的基础药物,但在骨质疏松的治疗中仅作为辅助药物使用。钙剂和维生素D3必须联合使用,钙剂只有在活性维生素D3的作用下方可被骨骼有效的利用。活性维生素D3的一个优点是还可增强肌力、提高神经肌肉活性。
双膦酸盐(BPs)对骨质有高亲和性,可抑制破骨细胞活性,抑制骨的重吸收,但口服生物利用度低,应空腹单独使用。双膦酸盐可以长期停留在骨骼中,不断发挥其生物效能。不仅能增加骨量,还可以降低骨质疏松性骨折的发生率,在骨质疏松症的防治中应用最为广泛。比如阿伦膦酸钠,可用于骨质疏松症的预防和治疗。
降钙素,目前应用的均为人工合成品,为骨吸收抑制剂。可通过抑制破骨细胞功能,降低骨的重吸收,从而改善骨质量,提高力学性能,促进骨折愈合,而且能明显缓解骨质疏松性疼痛。研究表明是骨质疏松性骨折的一种重要选择。因为是生物制剂,少数患者可出现不良反应。
, http://www.100md.com
甲状旁腺激素是刺激男性骨质代谢的强效激素,可刺激骨质合成,增加骨密度,改善骨骼的生物力学特性,是很有希望的骨形成促进剂,但有待更多的应用研究资料。
氟化物的治疗效果一直存在争议。近年的研究显示,只要剂量适当,氟剂能提高BMD和降低骨折率。
睾酮补充治疗(TST):
应用睾酮实施雄激素替代治疗在性腺功能减退症的男性对骨量有明确的正性作用,雄激素有利骨骼的阈值水平尚不清楚。在性激素正常的男性骨量低下患者,应用睾酮对骨是否有益尚不能确定。在青春发育期,正处峰值骨量发育时期,性激素起很大作用,如果此时患有器质性的性腺功能减退症,睾酮治疗可使骨骼获益,但是否能达到峰值量则不很明确。在老年男性随着增龄,雄激素水平下降,采用睾酮的雄激素替代治疗,可改善骨密度和骨的。由于雄激素可影响前列腺,因此前列腺肥大患者应慎用,怀疑或确诊前列腺癌者应禁用。
, http://www.100md.com
睾酮治疗能增加骨质密度,改善身体组成,降低脂肪量,增加肌肉量,增强力量和精力,改善精神和情绪症状。对肌肉力量、心理、性功能及心血管功能等方面也具有有利影响。适应于睾酮水平在12nnol/L以下、有睾酮缺乏的临床表现的患者。
雄激素替代治疗一般选用口服剂或注射剂型二种剂型的药物。由于对肝脏毒性和前列腺的影响应严格选择患者,口服剂睾酮优于注射剂型,血睾酮水平较平衡,不会出现因注射出现血睾酮超正常生理水平而抑制睾丸功能的缺点,但其生物利用度较低,有肝首过效应与肝毒性。
十一酸睾酮(胶丸/胶囊),溶于油酸,通过淋巴系统吸收,在体内的作用途径与天然睾酮一样[代谢产生双氢睾酮(DHT)、睾酮(T)和雌二醇(E2)],具有完全的雄激素活性。没有肝首过效应,口服剂型剂量易于调整,另外,经过临床有效性和安全性研究,对肝脏及前列腺无甚影响,是理想的雄激素替代治疗药物。
合理的饮食、适当的运动、良好的生活习惯(对男性尤为重要)、慎重用药等非药治疗方法,在男性骨质疏松的防治中同样有重要的地位。
思考问题:
男性骨质疏松症的流行病学特点。
雄激素在男性骨质疏松病理的地位。
雄激素替代治疗应注意什么?
责任编辑:王薇, http://www.100md.com