灵芝多糖肽拮抗吗啡的免疫抑制作用的体外试验
灵芝多糖肽拮抗吗啡的免疫抑制作用的体外试验
陆正武 林志彬
(北京医科大学基础学院药理学系,北京,100083)
摘要 目的:研究灵芝多糖肽(GPP)对吗啡所致免疫抑制的拮抗效应。方法:采用中性红法检测小鼠腹腔巨噬细胞吞噬功能;采用[3H]TdR参入法测定淋巴细胞增殖反应;分别采用胸腺细胞增殖法和依赖IL-2和HT-2细胞株测定IL-1和IL-2生成。结果:体外GPP50-800μg·ml-1可以不同程度地翻转高浓度吗啡所致的巨噬细胞吞噬功能降低,IL-1/IL-2产生减少及淋巴细胞增殖功能减退,使之恢复正常。结论:提示GPP直接地使遭受抑制的免疫细胞的功能得以恢复,产生功能性拮抗作用。
关键词 灵芝多糖肽;吗啡;巨噬细胞吞噬;淋巴细胞增殖;白细胞介素
, 百拇医药
灵芝多糖系灵芝的主要有效成分之一,它能促进正常小鼠的免疫功能,对应激和免疫抑制药及抗肿瘤药所致的小鼠免疫功能抑制具有恢复作用,还能恢复老年小鼠降低的免疫反应,并增强老年小鼠脾细胞内DNA多聚酶α的活性[1-3]。新近研究发现,灵芝多糖肽(ganoderma lucidum polysaccharide peptide, GPP)可抑制小鼠实验性肿瘤的生长,并明显延长荷瘤小鼠的生存期[4]。
本研究通过多项体外免疫学方法,探讨GPP对高浓度吗啡(morphine, Mor)所致免疫抑制的拮抗作用。
1 材料和方法
1.1 材料
1.1.1 灵芝多糖肽(GPP) 提取自山东泰安产灵芝(ganoderma lucidum, Leyss. ex Fr. Karst),由本校药学院李荣芷、何云庆教授提供;盐酸吗啡(Mor):青海制药厂出品,批号870301,易溶于水,用不完全RPMI-1640营养液配成5mg·ml-1,微孔滤器过滤除菌,4℃保存,临用前以完全RPMI-1640液稀释至所需浓度。
, http://www.100md.com
1.1.2 试剂 刀豆蛋白A(concanavalinA,ConA),脂多糖(lipopolysaccharide,LPS),Sigma公司。RPMI-1640培养基,购于美国JRScientificINC,应用时补以灭活小牛血清10%,谷氨酰胺2mmol·L-1,HEPES10mmol·L-1,青霉素100IU·L-1,链霉素100μg·ml-1,2-巯基乙醇50μmol·L-1以及丙酮酸钠1mmol·L-1。[3H]TdR,中科院上海原子能研究所,比活度740GBq·mmol-1。RPMI-1640溶解剂:无水乙醇与100mmol·L-1醋酸以1:1(vol)混匀即成。
1.1.3 动物 BALB/c(H-2d)及C57BL/6J(H-2b)近交系小鼠,2-3月龄,体重17-25g,♀♂兼用,购自北京医科大学实验动物科学部。
, http://www.100md.com
1.1.4细胞株 HT-2细胞为检测IL-2的IL-2依赖株,由本校免疫学系提供。
1.2 方法
1.2.1 巨噬细胞(MΦ)制备 小鼠ip经高压灭菌的4%硫代乙醇酸钠0.5ml。4d后,以含5%NCS的Hank's液收集腹腔渗出细胞,洗2次。用完全1640营养液将细胞悬浮,调整细胞浓度至4×106·ml-1。
1.2.2 MΦ吞噬中性红 96孔培养板加入100μl上述制备的MΦ悬液2×106·ml-1,置37℃、5%CO2孵箱。4h后甩去培养基,每孔加入100μl0.072%中性红。30min后,弃去中性红,用PBS洗3次。每孔再加200μl的RPMI-1640溶解剂,静置过夜。用酶标仪测定540nm处各孔的吸收率[5]。
, 百拇医药
1.2.3 IL-1的诱生与检测 于24孔培养板中加入4×106·ml-1的腹腔渗出细胞悬液2ml,置37℃、5%CO2孵箱培养2-4h,以PBS洗出未贴壁细胞。再向各孔加入含LPS10μg·ml-1的培养液2ml,继续温孵24h。离心(2000rpm,5min),收集上清,过滤,即为上清中IL-1的待测样品。
用胸腺细胞增殖法[6]测定IL-1活性:无菌取出2-3月龄C57BL/6J小鼠胸腺,置含有Hank's液的平皿中,用两块厚载玻片轻轻捻碎,双层尼龙网过滤制成单个细胞悬液。Hank's液洗2次(1500rpm,5min)。以完全RPMI-1640营养液制备ConA与胸腺细胞的混合溶液,其中ConA浓度为2μg·ml-1,胸腺细胞浓度为1.5×107·ml-1。于96孔板中,每孔加上述混合溶液100μl及不同稀释度的待测样品100μl。置5%CO2培养箱中培养3d,终止前6h每孔加[3H]TdR20μl(11.1KBq)。以下步骤同淋巴细胞增殖。以在最大反应前某一稀释度下dpm的参入高低间接反映IL-1的生物活性强弱。
, 百拇医药
1.2.4 淋巴细胞增殖 无菌取出小鼠脾脏置盛有Hank's的平皿中,以两块厚载玻片轻轻捻碎,用吸管充分吹打,经两层尼龙布过滤,得到单个细胞悬液。细胞用Hank's液洗2遍(每次离心5min, 1500rpm,4℃)后,镜下计数2次,取平均值。然后用完全RPMI-1640培养液调整细胞浓度至4×106·ml-1。96孔培养板每孔加100μl该细胞悬液;另加ConA(终浓度为2μg·ml-1)和RPMI-1640培养液,使反应终体积为200μl,并设置3复孔。在37℃含5%CO2的培养箱中培养72h。终止培养前6h,每孔加入[3H]TdR20μl(11.1KBq)。然后用多头细胞收集器将细胞收集到49型玻璃纤维滤膜上,蒸馏水洗10遍,烤干后放入含有5ml闪烁液的闪烁瓶中进行β计数,放射性强度经标准[3H]正16烷校正后用dpm表示。
1.2.5 IL-2的诱生及活性检测 收集脾细胞经ConA活化24h的培养上清,滤器过滤。取传代培养的IL-2依赖株HT-2作为检测细胞,将细胞浓度调整至1.0×105·ml-1,取0.1ml接种于96孔板中,再加入0.1mlIL-2样品(经1:10稀释),在CO2培养箱中培养24h,取某一稀释浓度时的dpm参入值高低间接反映样品中IL-2的生物活性。
, http://www.100md.com
2 结果
2.1 对MΦ吞噬中性红的影响
0.063-0.5mmol·L-1的Mor与贴壁MΦ作用20h后,使MΦ吞噬中性红的能力明显降低,作用呈浓度依赖性,在0.5mmol·L-1时抑制率可达53.1%(图1)。而GPP则明显促进MΦ的吞噬功能,随剂量增加作用逐渐加强。当两种药物同时加入该体系中,有相互拮抗作用,GPP50-800μg·ml-1可以不同程度地逆转Mor和PMΦ吞噬能力的抑制效应,使之恢复正常。
图1 GPP对Mor降低小鼠腹腔巨噬细胞吞噬中性红的影响。
n=4,*P<0.05,#P<0.01,△P<0.001,与对照组比较
, 百拇医药
2.2 对MΦ诱生IL-1的影响
由图2可见,高浓度Mor体外明显抑制10μg·ml-1LPS诱导PMΦ产生IL-1。如GPP与Mor体外共孵20h,洗去药物,再用LPS刺激,则50-800μg·ml-1GPP可拮抗Mor对IL-1产生的抑制作用,使之恢复正常。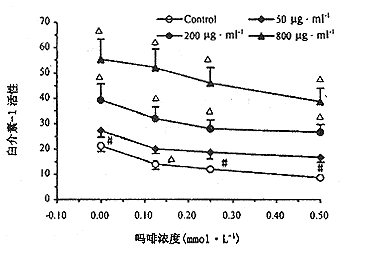
图2 GPP对Mor抑制小鼠腹腔巨噬细胞诱生IL-1的影响。
n=4,*P<0.01,#P<0.001,与对照组比较,IL-1上清稀释度为1:10
2.3 对ConA诱导的淋巴细胞增殖的影响
, 百拇医药
与既往研究[7]一致,高浓度Mor在体外可抑制淋巴细胞增殖反应,且作用随剂量增加而加强。体外GPP50-800μg·ml-1可以逆转Mor所致脾细胞增殖的抑制效应,使之恢复正常(图3)。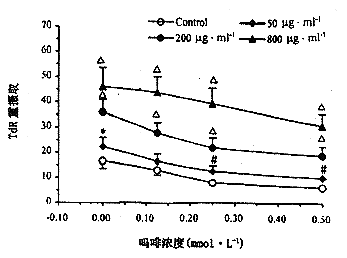
图3 GPP对Mor降低小鼠脾脏ConA敏感细胞增殖反应
的影响。n=4,*P<0.05,#P<0.01,△P<0.001,与对照组比较
2.4 对IL-2产生的影响
由图4可见,高浓度Mor剂量依赖性地抑制脾细胞IL-2的产生及其活性,在0.5mmol·L-1时抑制率可达62.3%;而GPP则明显促进脾细胞在ConA诱导下产生IL-2及其活性,并不同程度地逆转Mor所致IL-2分泌的抑制作用。
, 百拇医药
图4 GPP对Mor降低小鼠脾脏ConA敏感细胞产生IL-2
的影响。n=4,*P<0.05,#P<0.01,△P<0.001,对照组比较,IL-2上清稀释度为1:10
3 讨论
本文初步探讨了GPP对高浓度吗啡体外所致免疫抑制作用的拮抗效应。结果表明,在体外0.063-0.5mmol·L-1Mor以剂量依赖方式,抑制MΦ吞噬功能、IL-1诱生、淋巴细胞增殖以及IL-2的产生,这与作者以前的工作是一致的[7]。而GPP则对上述各免疫实验指标具有明显促进作用,且随剂量增加,作用得到加强。当两种药物同时加入体外培养体系,有相互拮抗作用,GPP50-800mmol·L-1可以不同程度地逆转高浓度Mor所致的免疫抑制效应,使之恢复正常。提示GPP可以在免疫细胞水平,直接使遭受抑制的免疫功能得以恢复,产生功能性拮抗作用。
, 百拇医药
本研究首次为应用灵芝制剂控制吗啡所致的免疫功能损伤提供了动物实验结果,具有重大意义和实用价值。因为应用免疫调节剂阻断或逆转麻醉性镇痛药所致机体非特异性和特异性的免疫功能低下,是减轻吸毒对成瘾患者伤害的一条新途径。我们的结果为临床开展戒毒免疫治疗提供了直接的实验依据。
4 参考文献
1 Lei LS, Lin ZB. Effect of ganoderma polysaccharides on T cell subpopulation and production of interleukin 2 in mixed lym- phocyte response. Acta Pharmacol Sin, 1992,27(5):331-335.
2 雷林生,林志彬,陈琪,等.灵芝多糖拮抗环孢素A,氢化可的松及抗肿瘤药的免疫抑制作用.中国药理学与毒理学杂志,1993,7:183-185.
, 百拇医药
3 雷林生,林志彬.灵芝多糖对老年小鼠脾细胞DNA多聚酶α活性及免疫功能的影响.药学学报,1993,28:577-582.
4 Ma L, Lin ZB. Antitumor effects of ganoderma lucidum polysaccharide peptides. Acta Pharmacol Sin,1995,16(1):78.
5 陆正武,林志彬.吗啡依赖性小鼠免疫功能的变化.中国药物依赖性通报,1994,3:4-8.
6 Symons JA, Dickens EM, Digiovine F, et al. Measurement of interleukin-1 activity. In: Clemens MJ, Morris AG, Gearing AJH, eds. Lymphokines and interferons: a pratical approach. Oxford: IRL Press, 1987.269-289.
, 百拇医药
7 Lu ZW,Lin ZB. Inhibition of mouse lymphocyte proliferation in vitro with high doses of morphine. J Beijing Med Univ, 1994, 26(1):61-68.
ANTAGONISTIC EFFECT OF GANODERMA POLYSACCHARIDE PEPTIDE AGAINST IMMUNOSUPPRESSION OF MORPHINE IN VITRO
Lu Zhengwu, Lin Zhibin
(Department of Pharmacology,School of Basic Sciences,Beijing Medical University,Beijing,100083)
, http://www.100md.com
ABSTRACT Objective:To investigate the antagonistic effects of ganoderma polysaccharide peptide (GPP) against immunosuppression of morphine.Method:Phagocytosis of mouse peritoneal macrophages was determined by neutral red method;lymphocyte proliferation induced by Con A was measured by [3H]TdR incorporation;IL- 1/IL-2 production was assayed by thymocyte proliferation and IL-2 dependent HT-2 cell line respectively.Result:GPP 50-800 μg· ml-1 differently blocked suppressive effects of high doses of morphine on macrophage phagocytosis,IL- 1/IL- 2 activity,and splenocyte mitogenity to Con A.Conclusion:GPP may directly activate immune cells to improve immune functions depressed by in vitro treatment of morphine.
KEY WORDS ganoderma lucidum polysaccharide peptide;morphine; macrophage phagocytosis;lymphocyte proliferation; IL-1; IL-2, http://www.100md.com
陆正武 林志彬
(北京医科大学基础学院药理学系,北京,100083)
摘要 目的:研究灵芝多糖肽(GPP)对吗啡所致免疫抑制的拮抗效应。方法:采用中性红法检测小鼠腹腔巨噬细胞吞噬功能;采用[3H]TdR参入法测定淋巴细胞增殖反应;分别采用胸腺细胞增殖法和依赖IL-2和HT-2细胞株测定IL-1和IL-2生成。结果:体外GPP50-800μg·ml-1可以不同程度地翻转高浓度吗啡所致的巨噬细胞吞噬功能降低,IL-1/IL-2产生减少及淋巴细胞增殖功能减退,使之恢复正常。结论:提示GPP直接地使遭受抑制的免疫细胞的功能得以恢复,产生功能性拮抗作用。
关键词 灵芝多糖肽;吗啡;巨噬细胞吞噬;淋巴细胞增殖;白细胞介素
, 百拇医药
灵芝多糖系灵芝的主要有效成分之一,它能促进正常小鼠的免疫功能,对应激和免疫抑制药及抗肿瘤药所致的小鼠免疫功能抑制具有恢复作用,还能恢复老年小鼠降低的免疫反应,并增强老年小鼠脾细胞内DNA多聚酶α的活性[1-3]。新近研究发现,灵芝多糖肽(ganoderma lucidum polysaccharide peptide, GPP)可抑制小鼠实验性肿瘤的生长,并明显延长荷瘤小鼠的生存期[4]。
本研究通过多项体外免疫学方法,探讨GPP对高浓度吗啡(morphine, Mor)所致免疫抑制的拮抗作用。
1 材料和方法
1.1 材料
1.1.1 灵芝多糖肽(GPP) 提取自山东泰安产灵芝(ganoderma lucidum, Leyss. ex Fr. Karst),由本校药学院李荣芷、何云庆教授提供;盐酸吗啡(Mor):青海制药厂出品,批号870301,易溶于水,用不完全RPMI-1640营养液配成5mg·ml-1,微孔滤器过滤除菌,4℃保存,临用前以完全RPMI-1640液稀释至所需浓度。
, http://www.100md.com
1.1.2 试剂 刀豆蛋白A(concanavalinA,ConA),脂多糖(lipopolysaccharide,LPS),Sigma公司。RPMI-1640培养基,购于美国JRScientificINC,应用时补以灭活小牛血清10%,谷氨酰胺2mmol·L-1,HEPES10mmol·L-1,青霉素100IU·L-1,链霉素100μg·ml-1,2-巯基乙醇50μmol·L-1以及丙酮酸钠1mmol·L-1。[3H]TdR,中科院上海原子能研究所,比活度740GBq·mmol-1。RPMI-1640溶解剂:无水乙醇与100mmol·L-1醋酸以1:1(vol)混匀即成。
1.1.3 动物 BALB/c(H-2d)及C57BL/6J(H-2b)近交系小鼠,2-3月龄,体重17-25g,♀♂兼用,购自北京医科大学实验动物科学部。
, http://www.100md.com
1.1.4细胞株 HT-2细胞为检测IL-2的IL-2依赖株,由本校免疫学系提供。
1.2 方法
1.2.1 巨噬细胞(MΦ)制备 小鼠ip经高压灭菌的4%硫代乙醇酸钠0.5ml。4d后,以含5%NCS的Hank's液收集腹腔渗出细胞,洗2次。用完全1640营养液将细胞悬浮,调整细胞浓度至4×106·ml-1。
1.2.2 MΦ吞噬中性红 96孔培养板加入100μl上述制备的MΦ悬液2×106·ml-1,置37℃、5%CO2孵箱。4h后甩去培养基,每孔加入100μl0.072%中性红。30min后,弃去中性红,用PBS洗3次。每孔再加200μl的RPMI-1640溶解剂,静置过夜。用酶标仪测定540nm处各孔的吸收率[5]。
, 百拇医药
1.2.3 IL-1的诱生与检测 于24孔培养板中加入4×106·ml-1的腹腔渗出细胞悬液2ml,置37℃、5%CO2孵箱培养2-4h,以PBS洗出未贴壁细胞。再向各孔加入含LPS10μg·ml-1的培养液2ml,继续温孵24h。离心(2000rpm,5min),收集上清,过滤,即为上清中IL-1的待测样品。
用胸腺细胞增殖法[6]测定IL-1活性:无菌取出2-3月龄C57BL/6J小鼠胸腺,置含有Hank's液的平皿中,用两块厚载玻片轻轻捻碎,双层尼龙网过滤制成单个细胞悬液。Hank's液洗2次(1500rpm,5min)。以完全RPMI-1640营养液制备ConA与胸腺细胞的混合溶液,其中ConA浓度为2μg·ml-1,胸腺细胞浓度为1.5×107·ml-1。于96孔板中,每孔加上述混合溶液100μl及不同稀释度的待测样品100μl。置5%CO2培养箱中培养3d,终止前6h每孔加[3H]TdR20μl(11.1KBq)。以下步骤同淋巴细胞增殖。以在最大反应前某一稀释度下dpm的参入高低间接反映IL-1的生物活性强弱。
, 百拇医药
1.2.4 淋巴细胞增殖 无菌取出小鼠脾脏置盛有Hank's的平皿中,以两块厚载玻片轻轻捻碎,用吸管充分吹打,经两层尼龙布过滤,得到单个细胞悬液。细胞用Hank's液洗2遍(每次离心5min, 1500rpm,4℃)后,镜下计数2次,取平均值。然后用完全RPMI-1640培养液调整细胞浓度至4×106·ml-1。96孔培养板每孔加100μl该细胞悬液;另加ConA(终浓度为2μg·ml-1)和RPMI-1640培养液,使反应终体积为200μl,并设置3复孔。在37℃含5%CO2的培养箱中培养72h。终止培养前6h,每孔加入[3H]TdR20μl(11.1KBq)。然后用多头细胞收集器将细胞收集到49型玻璃纤维滤膜上,蒸馏水洗10遍,烤干后放入含有5ml闪烁液的闪烁瓶中进行β计数,放射性强度经标准[3H]正16烷校正后用dpm表示。
1.2.5 IL-2的诱生及活性检测 收集脾细胞经ConA活化24h的培养上清,滤器过滤。取传代培养的IL-2依赖株HT-2作为检测细胞,将细胞浓度调整至1.0×105·ml-1,取0.1ml接种于96孔板中,再加入0.1mlIL-2样品(经1:10稀释),在CO2培养箱中培养24h,取某一稀释浓度时的dpm参入值高低间接反映样品中IL-2的生物活性。
, http://www.100md.com
2 结果
2.1 对MΦ吞噬中性红的影响
0.063-0.5mmol·L-1的Mor与贴壁MΦ作用20h后,使MΦ吞噬中性红的能力明显降低,作用呈浓度依赖性,在0.5mmol·L-1时抑制率可达53.1%(图1)。而GPP则明显促进MΦ的吞噬功能,随剂量增加作用逐渐加强。当两种药物同时加入该体系中,有相互拮抗作用,GPP50-800μg·ml-1可以不同程度地逆转Mor和PMΦ吞噬能力的抑制效应,使之恢复正常。

图1 GPP对Mor降低小鼠腹腔巨噬细胞吞噬中性红的影响。
n=4,*P<0.05,#P<0.01,△P<0.001,与对照组比较
, 百拇医药
2.2 对MΦ诱生IL-1的影响
由图2可见,高浓度Mor体外明显抑制10μg·ml-1LPS诱导PMΦ产生IL-1。如GPP与Mor体外共孵20h,洗去药物,再用LPS刺激,则50-800μg·ml-1GPP可拮抗Mor对IL-1产生的抑制作用,使之恢复正常。

图2 GPP对Mor抑制小鼠腹腔巨噬细胞诱生IL-1的影响。
n=4,*P<0.01,#P<0.001,与对照组比较,IL-1上清稀释度为1:10
2.3 对ConA诱导的淋巴细胞增殖的影响
, 百拇医药
与既往研究[7]一致,高浓度Mor在体外可抑制淋巴细胞增殖反应,且作用随剂量增加而加强。体外GPP50-800μg·ml-1可以逆转Mor所致脾细胞增殖的抑制效应,使之恢复正常(图3)。

图3 GPP对Mor降低小鼠脾脏ConA敏感细胞增殖反应
的影响。n=4,*P<0.05,#P<0.01,△P<0.001,与对照组比较
2.4 对IL-2产生的影响
由图4可见,高浓度Mor剂量依赖性地抑制脾细胞IL-2的产生及其活性,在0.5mmol·L-1时抑制率可达62.3%;而GPP则明显促进脾细胞在ConA诱导下产生IL-2及其活性,并不同程度地逆转Mor所致IL-2分泌的抑制作用。

, 百拇医药
图4 GPP对Mor降低小鼠脾脏ConA敏感细胞产生IL-2
的影响。n=4,*P<0.05,#P<0.01,△P<0.001,对照组比较,IL-2上清稀释度为1:10
3 讨论
本文初步探讨了GPP对高浓度吗啡体外所致免疫抑制作用的拮抗效应。结果表明,在体外0.063-0.5mmol·L-1Mor以剂量依赖方式,抑制MΦ吞噬功能、IL-1诱生、淋巴细胞增殖以及IL-2的产生,这与作者以前的工作是一致的[7]。而GPP则对上述各免疫实验指标具有明显促进作用,且随剂量增加,作用得到加强。当两种药物同时加入体外培养体系,有相互拮抗作用,GPP50-800mmol·L-1可以不同程度地逆转高浓度Mor所致的免疫抑制效应,使之恢复正常。提示GPP可以在免疫细胞水平,直接使遭受抑制的免疫功能得以恢复,产生功能性拮抗作用。
, 百拇医药
本研究首次为应用灵芝制剂控制吗啡所致的免疫功能损伤提供了动物实验结果,具有重大意义和实用价值。因为应用免疫调节剂阻断或逆转麻醉性镇痛药所致机体非特异性和特异性的免疫功能低下,是减轻吸毒对成瘾患者伤害的一条新途径。我们的结果为临床开展戒毒免疫治疗提供了直接的实验依据。
4 参考文献
1 Lei LS, Lin ZB. Effect of ganoderma polysaccharides on T cell subpopulation and production of interleukin 2 in mixed lym- phocyte response. Acta Pharmacol Sin, 1992,27(5):331-335.
2 雷林生,林志彬,陈琪,等.灵芝多糖拮抗环孢素A,氢化可的松及抗肿瘤药的免疫抑制作用.中国药理学与毒理学杂志,1993,7:183-185.
, 百拇医药
3 雷林生,林志彬.灵芝多糖对老年小鼠脾细胞DNA多聚酶α活性及免疫功能的影响.药学学报,1993,28:577-582.
4 Ma L, Lin ZB. Antitumor effects of ganoderma lucidum polysaccharide peptides. Acta Pharmacol Sin,1995,16(1):78.
5 陆正武,林志彬.吗啡依赖性小鼠免疫功能的变化.中国药物依赖性通报,1994,3:4-8.
6 Symons JA, Dickens EM, Digiovine F, et al. Measurement of interleukin-1 activity. In: Clemens MJ, Morris AG, Gearing AJH, eds. Lymphokines and interferons: a pratical approach. Oxford: IRL Press, 1987.269-289.
, 百拇医药
7 Lu ZW,Lin ZB. Inhibition of mouse lymphocyte proliferation in vitro with high doses of morphine. J Beijing Med Univ, 1994, 26(1):61-68.
ANTAGONISTIC EFFECT OF GANODERMA POLYSACCHARIDE PEPTIDE AGAINST IMMUNOSUPPRESSION OF MORPHINE IN VITRO
Lu Zhengwu, Lin Zhibin
(Department of Pharmacology,School of Basic Sciences,Beijing Medical University,Beijing,100083)
, http://www.100md.com
ABSTRACT Objective:To investigate the antagonistic effects of ganoderma polysaccharide peptide (GPP) against immunosuppression of morphine.Method:Phagocytosis of mouse peritoneal macrophages was determined by neutral red method;lymphocyte proliferation induced by Con A was measured by [3H]TdR incorporation;IL- 1/IL-2 production was assayed by thymocyte proliferation and IL-2 dependent HT-2 cell line respectively.Result:GPP 50-800 μg· ml-1 differently blocked suppressive effects of high doses of morphine on macrophage phagocytosis,IL- 1/IL- 2 activity,and splenocyte mitogenity to Con A.Conclusion:GPP may directly activate immune cells to improve immune functions depressed by in vitro treatment of morphine.
KEY WORDS ganoderma lucidum polysaccharide peptide;morphine; macrophage phagocytosis;lymphocyte proliferation; IL-1; IL-2, http://www.100md.com