http://www.100md.com
中国医学论坛报
病例摘要
患者,男,58岁。因咳嗽、咳痰3个月,伴发热、气短2周于2004年4月29日入院。患者于入院前3个月出现反复咳嗽,咳少量白粘痰,晨起明显;1个月前开始出现鼻塞、头痛、咽痛、全身乏力和多汗,自服双黄连、复方盐酸苯丙胺醇(康泰克)等药物,症状可缓解,但停药后上述症状再次出现,并逐渐加重,伴有活动耐量下降。入院前2周无明显诱因出现发热,活动后气短,呼气困难明显,不能上两层楼。4月12日外院胸片示“双下肺少量斑片影”,予头孢呋辛0.3 g每日2次和阿莫西林1.0 g每日3次治疗,患者咳嗽气短无明显缓解,遂于4月26日来我院门诊就诊,查体发现其右下肺有湿罗音;血WBC 7.4×109/LN 67.2%,血沉(ESR)47 mm/1h,结核菌素纯蛋白衍生物(PPD)(-)。X线胸片示“双下肺斑片影”(图1);胸部CT示“双肺炎性改变,考虑结核与真菌感染可能性大”。予头孢曲松2 g/d治疗,用药次日出现畏寒、发热,体温最高达38.5℃,自服对乙酰氨基酚(百服宁)体温可降至正常,但咳嗽、气短症状进行性加重。近1个月体重下降约5 kg。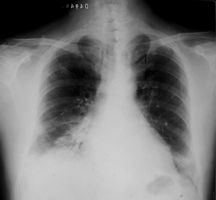
图1.患者胸片示双下肺斑片影(4月26日)
既往史 30年前患右耳中耳炎,未予诊治,右耳听力轻度下降。20年前患鼻息肉,反复多次行息肉切除术,最后一次手术在2001年,术后未再复发。1999年曾有一次服用阿司匹林后发作呼吸困难,“抢救”后缓解,其后未再服用类似药物。10年前发现“心律不齐”,未诊治。
个人史 从事司机工作30余年,接触汽油较多,已退休。否认结核接触史。吸烟10~20支/日,共30年。
体格检查 T 36.5℃,P 150次/分,R 23次/分,BP 102/62 mmHg,胸廓桶状,双肺叩诊过清音,双肺呼吸音呼气延长,双下肺可闻及高调湿罗音。心界向左扩大,心率150次/分,心律绝对不齐,第一心音强弱不等,有脉搏短绌。
实验室检查 WBC 6.6×109/LN 71% Hb 155 g/LPLT 282×109/L,尿常规正常。丙氨酸转氨酶(ALT) 66 U/L,白蛋白(ALB) 3 g/dk,ESR 70 mm/1hCRP 4.7 mg/dk。免疫及蛋白电泳均正常。肺炎衣原体、支原体抗体及军团菌抗体-,TORCH-,EB病毒-,痰普通细菌培养阴性,3次痰找TB -,TB-Ab-,PPD-,3次痰找真菌-。血CA系列、肺癌筛查各指标均在正常范围,5次痰找瘤细胞-。自身免疫指标包括抗核抗体(ANA)、dsDNA、抗可提取核抗原(ENA)、类风湿因子(RF)、抗心磷脂抗体(ACL)及抗中性粒细胞胞质抗体(ANCA)均为-,补体正常。动脉血气分析鼻导管吸氧3 L/min:pH 7.470,pO2 77.5 mmHg,pCO2 32.9 mmHg。入院后予莫西沙星和阿奇霉素联合抗感染治疗,同时予地高辛0.125 mg/d控制心室率。但病人体温仍持续在38.0℃~39.2℃,仍有咳嗽、咳白痰,呼吸困难进行性加重,活动明显受限。住院10天后复查血气鼻导管吸氧7 L/min:pH 7.477,pO2 59.8 mmHg,pCO2 33.3 mmHg,复查胸部CT:双肺斑片、结节、条索影较前明显进展,部分实变(见图2)。
图2. CT示双下肺斑片、结节影明显增多(5月9日)
入院两周后行纤维支气管镜检查,镜下未见异常,行右下叶外后基底段肺活检(TBLB),成功取出灰粉组织3粒,病理诊断为:肺泡间隔轻度增宽,少量慢性炎细胞浸润,小气道内可见较多疏松纤维肉芽沿肺泡腔延伸,符合机化性肺炎(图3)。5月13日加用泼尼松1 mg/kg/d,次日患者体温降至正常,呼吸困难逐渐好转;5月24日血气分析鼻导管吸氧3 L/min:pH 7.442,pO2 86.7 mmHg,pCO2 43.1 mmHg;复查胸部CT示:双肺斑片影、结节影吸收 ;复查血沉降至24 mm/1h。6月2日肺功能:最大肺活量(FVC)占预计值百分比为42.9%,1秒钟用力呼气量(FEV1)42.9%,FEV1/FVC 90.98%,肺一氧化碳弥散量(Dkco) 69.4%。
图3. 病理肺组织结构完整,可见疏松纤维组织呈肉芽状深入肺泡管和肺泡腔(HE×400)
病例讨论
者为中老年男性,慢性病程,以“咳嗽、咳痰、气短”起病,入院前两周出现发热,体温最高达39.2℃。开始病程进展比较慢,仅表现为咳嗽和咳白痰,呼吸困难不重,不发热。但是出现发热后,病程进展加快,呼吸困难呈进行性加重,并出现I型呼吸衰竭,活动能力明显受限。如果综合呼吸道症状(咳嗽、咳痰、气短)以及发热,查体双下肺湿罗音,X线胸片和CT显示双下肺的斑片浸润影,很容易使人想到“社区获得性肺炎(CAP)”的诊断。
但该患者血白细胞计数以及细胞分类正常,门诊头孢曲松经验性治疗无效,所以化脓性肺炎,如由肺炎链球菌、流感嗜血杆菌引起的CAP可能性不大。CAP也可以由非典型性致病菌(如肺炎支原体、肺炎衣原体、军团菌等)引起,住院后给予患者莫西沙星和阿奇霉素等经验性抗感染治疗,但病情不但没有好转,反而进行性加重。
因患者病程相对较长,咳嗽、咳白痰、发热,血沉增快(最快70 mm/1h),有没有可能是特殊细菌感染呢?例如肺结核或者肺部真菌感染。但病人否认肺结核病史,以及肺结核接触史,住院前及住院后两次PPD均阴性,两次结核抗体阴性,多次痰涂片抗酸染色阴性,因此诊断肺结核的证据不足。如果是肺部真菌感染,最常见的是肺曲霉菌感染,但是多见于免疫功能低下的患者,如肿瘤化疗粒细胞缺乏、骨髓移植,以及长期接受糖皮质激素和免疫抑制剂治疗的患者等。该患者免疫功能正常,粒细胞正常,多次痰真菌培养阴性,因此肺部真菌病仍不能诊断。
患者咳嗽、咳大量白痰,病情在短期内快速进展,出现呼吸衰竭,肺部病变进行性加重,有没有可能是“肺泡癌”?但是5次痰涂片均未找到瘤细胞,没有诊断肺癌所必需的病理证据。
诊断的转机来自纤维支气管镜检查和TBLB。因该病人存在I型呼吸衰竭,行纤支镜检查要冒着非常大的风险,但是TBLB的病理结果具有很大的诊断价值,病理结果符合机化性肺炎(COP)。患者对糖皮质激素的反应是非常满意的,用药后体温正常,血沉恢复正常,呼吸困难逐渐好转,X线胸片示肺部阴影逐渐吸收,动脉血气分析提示低氧血症得到纠正。
隐源性机化性肺炎(COP)长久以来未被临床医师认识,其概念模糊不清,以前曾被称为“闭塞性细支气管炎”或“增生性细支气管炎”等。1969年Liebow和Carrington总结了几例“机化性肺炎”的病例,把它称为“闭塞性细支气管炎和间质性肺炎”。Epker等于1985年首次提出闭塞性细支气管炎伴机化性肺炎BOOP的概念,但Epker等同时指出部分病人在病理上只有“单纯”的细支气管炎而没有机化性肺炎。COP通常指特发性BOOP,2002年美国和欧洲呼吸病学会建议,把COP作为一个亚类,归入特发性间质性肺炎(IIP)。
COP是一个组织病理学的描述,其病理特点是病变主要为肺泡管和肺泡腔内充填着由增生的成纤维细胞和肌成纤维细胞组成的疏松结缔组织,而细支气管管腔有不同程度的受累。但肺组织结构通常保持完整,病变区肺泡间质轻度增宽,肺间质有轻度慢性炎细胞浸润,肺泡Ⅱ型上皮细胞可有增生,几乎不可能发生“蜂窝肺”。
机化性肺炎(OP)可以见于多种疾病,例如可继发于感染(细菌、分支杆菌、隐球菌、奴卡菌、病毒)、结缔组织病(系统性红斑狼疮、白塞病、类风湿性关节炎、多发性肌炎和皮肌炎、系统性硬化、混合结缔组织病、干燥综合征等)、过敏性肺泡炎、药物、放射线、误吸等。只有一部分病因不明的称为特发性机化性肺炎,或称为COP。
发生COP患者多为60~70岁,但也有儿童发病的报道。通常为亚急性起病,症状有咳嗽和呼吸困难(通常持续几个星期)。咳嗽通常是干咳,无痰,也可以有发热、疲倦、厌食和体重下降。在某些情况下,COP可以表现为急性呼吸窘迫综合征(ARDS)和呼吸衰竭。最主要的体征是有“爆裂音”和呼吸频率增快,可有白细胞和粒细胞升高,也可以有ESR和CRP升高。
COP最常见的影像学表现是双肺多发斑片状浸润影,病变可以表现为“磨玻璃样”,肺容量正常。阴影也可呈“游走性”,在几周内,病变可以在不同部位变化。这些斑片状浸润影多分布在外周,类似“嗜酸粒细胞性肺炎”。有时,病变表现为多部位的实变,多为双侧,单侧少见。影像学上表现为弥漫性间质性浸润的病人不超过20%,往往继发于结缔组织病,一旦出现间质性肺浸润,预示预后不良。有些病人表现为局灶性肺实变。胸腔积液不超过25%。
COP患者的支气管肺泡灌洗液BALF提示淋巴细胞总数和比例提高,中性粒细胞和嗜酸粒细胞也增加。COP患者的肺功能通常为轻至中度的限制性通气功能障碍和弥散功能障碍。少数病人可有气道阻塞(FEV1/FVC<70%),多见于吸烟患者。可有轻度静息和(或)劳力后低氧血症。
诊断COP需要结合临床和影像学检查,但是确诊还是依靠组织病理学证据。经支气管镜肺活检TBLB的组织如果足够大(包括肺泡、肺泡管、肺间质)可以确定诊断。但是如果TBLB取不到足够大的组织,则常常需要开胸肺活检取得病理标本。
根据影像学,COP有肺实变者需与肺泡癌、淋巴瘤、血管炎特别是Wegener's肉芽肿、结节病和感染(特别是结核或不典型分支杆菌感染)相鉴别。当实变在胸膜下时,应与慢性嗜酸粒细胞肺炎相鉴别。如为多发性大结节,鉴别诊断时应考虑是否存在转移性肿瘤、淋巴瘤和早期肺脓肿的可能。实变在支气管周围和胸膜下分布时应考虑到COP的可能,如同时存在磨玻璃样影和囊肿,还需与淋巴细胞性间质性肺炎LIP或脱屑性间质性肺炎DIP相鉴别。大多数COP病人经皮质激素治疗后影像学可获明显改善。
COP是一种糖皮质激素治疗有效的疾病。激素治疗后,临床症状的改善往往是迅速而显著的,通常在几天或几周内出现症状的改善,病人的预后往往非常满意,有超过2/3的病人肺部病变能够完全吸收。激素的用量为泼尼松0.75 mg/kg/d,2~4周后,激素逐渐减量。在病情快速进展的COP患者,可能需要短期大剂量糖皮质激素冲击治疗,激素的总疗程为6~12个月,如果疗程少于3个月,约1/3的患者可出现复发。约10%~15%的COP患者对糖皮质激素没有反应,而免疫抑制剂,如环磷酰胺、硫唑嘌呤等的疗效至今还不明确。即使不治疗,少部分病人经过几个月后也可自行康复。
患者,男,58岁。因咳嗽、咳痰3个月,伴发热、气短2周于2004年4月29日入院。患者于入院前3个月出现反复咳嗽,咳少量白粘痰,晨起明显;1个月前开始出现鼻塞、头痛、咽痛、全身乏力和多汗,自服双黄连、复方盐酸苯丙胺醇(康泰克)等药物,症状可缓解,但停药后上述症状再次出现,并逐渐加重,伴有活动耐量下降。入院前2周无明显诱因出现发热,活动后气短,呼气困难明显,不能上两层楼。4月12日外院胸片示“双下肺少量斑片影”,予头孢呋辛0.3 g每日2次和阿莫西林1.0 g每日3次治疗,患者咳嗽气短无明显缓解,遂于4月26日来我院门诊就诊,查体发现其右下肺有湿罗音;血WBC 7.4×109/LN 67.2%,血沉(ESR)47 mm/1h,结核菌素纯蛋白衍生物(PPD)(-)。X线胸片示“双下肺斑片影”(图1);胸部CT示“双肺炎性改变,考虑结核与真菌感染可能性大”。予头孢曲松2 g/d治疗,用药次日出现畏寒、发热,体温最高达38.5℃,自服对乙酰氨基酚(百服宁)体温可降至正常,但咳嗽、气短症状进行性加重。近1个月体重下降约5 kg。

图1.患者胸片示双下肺斑片影(4月26日)
既往史 30年前患右耳中耳炎,未予诊治,右耳听力轻度下降。20年前患鼻息肉,反复多次行息肉切除术,最后一次手术在2001年,术后未再复发。1999年曾有一次服用阿司匹林后发作呼吸困难,“抢救”后缓解,其后未再服用类似药物。10年前发现“心律不齐”,未诊治。
个人史 从事司机工作30余年,接触汽油较多,已退休。否认结核接触史。吸烟10~20支/日,共30年。
体格检查 T 36.5℃,P 150次/分,R 23次/分,BP 102/62 mmHg,胸廓桶状,双肺叩诊过清音,双肺呼吸音呼气延长,双下肺可闻及高调湿罗音。心界向左扩大,心率150次/分,心律绝对不齐,第一心音强弱不等,有脉搏短绌。
实验室检查 WBC 6.6×109/LN 71% Hb 155 g/LPLT 282×109/L,尿常规正常。丙氨酸转氨酶(ALT) 66 U/L,白蛋白(ALB) 3 g/dk,ESR 70 mm/1hCRP 4.7 mg/dk。免疫及蛋白电泳均正常。肺炎衣原体、支原体抗体及军团菌抗体-,TORCH-,EB病毒-,痰普通细菌培养阴性,3次痰找TB -,TB-Ab-,PPD-,3次痰找真菌-。血CA系列、肺癌筛查各指标均在正常范围,5次痰找瘤细胞-。自身免疫指标包括抗核抗体(ANA)、dsDNA、抗可提取核抗原(ENA)、类风湿因子(RF)、抗心磷脂抗体(ACL)及抗中性粒细胞胞质抗体(ANCA)均为-,补体正常。动脉血气分析鼻导管吸氧3 L/min:pH 7.470,pO2 77.5 mmHg,pCO2 32.9 mmHg。入院后予莫西沙星和阿奇霉素联合抗感染治疗,同时予地高辛0.125 mg/d控制心室率。但病人体温仍持续在38.0℃~39.2℃,仍有咳嗽、咳白痰,呼吸困难进行性加重,活动明显受限。住院10天后复查血气鼻导管吸氧7 L/min:pH 7.477,pO2 59.8 mmHg,pCO2 33.3 mmHg,复查胸部CT:双肺斑片、结节、条索影较前明显进展,部分实变(见图2)。

图2. CT示双下肺斑片、结节影明显增多(5月9日)
入院两周后行纤维支气管镜检查,镜下未见异常,行右下叶外后基底段肺活检(TBLB),成功取出灰粉组织3粒,病理诊断为:肺泡间隔轻度增宽,少量慢性炎细胞浸润,小气道内可见较多疏松纤维肉芽沿肺泡腔延伸,符合机化性肺炎(图3)。5月13日加用泼尼松1 mg/kg/d,次日患者体温降至正常,呼吸困难逐渐好转;5月24日血气分析鼻导管吸氧3 L/min:pH 7.442,pO2 86.7 mmHg,pCO2 43.1 mmHg;复查胸部CT示:双肺斑片影、结节影吸收 ;复查血沉降至24 mm/1h。6月2日肺功能:最大肺活量(FVC)占预计值百分比为42.9%,1秒钟用力呼气量(FEV1)42.9%,FEV1/FVC 90.98%,肺一氧化碳弥散量(Dkco) 69.4%。

图3. 病理肺组织结构完整,可见疏松纤维组织呈肉芽状深入肺泡管和肺泡腔(HE×400)
病例讨论
者为中老年男性,慢性病程,以“咳嗽、咳痰、气短”起病,入院前两周出现发热,体温最高达39.2℃。开始病程进展比较慢,仅表现为咳嗽和咳白痰,呼吸困难不重,不发热。但是出现发热后,病程进展加快,呼吸困难呈进行性加重,并出现I型呼吸衰竭,活动能力明显受限。如果综合呼吸道症状(咳嗽、咳痰、气短)以及发热,查体双下肺湿罗音,X线胸片和CT显示双下肺的斑片浸润影,很容易使人想到“社区获得性肺炎(CAP)”的诊断。
但该患者血白细胞计数以及细胞分类正常,门诊头孢曲松经验性治疗无效,所以化脓性肺炎,如由肺炎链球菌、流感嗜血杆菌引起的CAP可能性不大。CAP也可以由非典型性致病菌(如肺炎支原体、肺炎衣原体、军团菌等)引起,住院后给予患者莫西沙星和阿奇霉素等经验性抗感染治疗,但病情不但没有好转,反而进行性加重。
因患者病程相对较长,咳嗽、咳白痰、发热,血沉增快(最快70 mm/1h),有没有可能是特殊细菌感染呢?例如肺结核或者肺部真菌感染。但病人否认肺结核病史,以及肺结核接触史,住院前及住院后两次PPD均阴性,两次结核抗体阴性,多次痰涂片抗酸染色阴性,因此诊断肺结核的证据不足。如果是肺部真菌感染,最常见的是肺曲霉菌感染,但是多见于免疫功能低下的患者,如肿瘤化疗粒细胞缺乏、骨髓移植,以及长期接受糖皮质激素和免疫抑制剂治疗的患者等。该患者免疫功能正常,粒细胞正常,多次痰真菌培养阴性,因此肺部真菌病仍不能诊断。
患者咳嗽、咳大量白痰,病情在短期内快速进展,出现呼吸衰竭,肺部病变进行性加重,有没有可能是“肺泡癌”?但是5次痰涂片均未找到瘤细胞,没有诊断肺癌所必需的病理证据。
诊断的转机来自纤维支气管镜检查和TBLB。因该病人存在I型呼吸衰竭,行纤支镜检查要冒着非常大的风险,但是TBLB的病理结果具有很大的诊断价值,病理结果符合机化性肺炎(COP)。患者对糖皮质激素的反应是非常满意的,用药后体温正常,血沉恢复正常,呼吸困难逐渐好转,X线胸片示肺部阴影逐渐吸收,动脉血气分析提示低氧血症得到纠正。
隐源性机化性肺炎(COP)长久以来未被临床医师认识,其概念模糊不清,以前曾被称为“闭塞性细支气管炎”或“增生性细支气管炎”等。1969年Liebow和Carrington总结了几例“机化性肺炎”的病例,把它称为“闭塞性细支气管炎和间质性肺炎”。Epker等于1985年首次提出闭塞性细支气管炎伴机化性肺炎BOOP的概念,但Epker等同时指出部分病人在病理上只有“单纯”的细支气管炎而没有机化性肺炎。COP通常指特发性BOOP,2002年美国和欧洲呼吸病学会建议,把COP作为一个亚类,归入特发性间质性肺炎(IIP)。
COP是一个组织病理学的描述,其病理特点是病变主要为肺泡管和肺泡腔内充填着由增生的成纤维细胞和肌成纤维细胞组成的疏松结缔组织,而细支气管管腔有不同程度的受累。但肺组织结构通常保持完整,病变区肺泡间质轻度增宽,肺间质有轻度慢性炎细胞浸润,肺泡Ⅱ型上皮细胞可有增生,几乎不可能发生“蜂窝肺”。
机化性肺炎(OP)可以见于多种疾病,例如可继发于感染(细菌、分支杆菌、隐球菌、奴卡菌、病毒)、结缔组织病(系统性红斑狼疮、白塞病、类风湿性关节炎、多发性肌炎和皮肌炎、系统性硬化、混合结缔组织病、干燥综合征等)、过敏性肺泡炎、药物、放射线、误吸等。只有一部分病因不明的称为特发性机化性肺炎,或称为COP。
发生COP患者多为60~70岁,但也有儿童发病的报道。通常为亚急性起病,症状有咳嗽和呼吸困难(通常持续几个星期)。咳嗽通常是干咳,无痰,也可以有发热、疲倦、厌食和体重下降。在某些情况下,COP可以表现为急性呼吸窘迫综合征(ARDS)和呼吸衰竭。最主要的体征是有“爆裂音”和呼吸频率增快,可有白细胞和粒细胞升高,也可以有ESR和CRP升高。
COP最常见的影像学表现是双肺多发斑片状浸润影,病变可以表现为“磨玻璃样”,肺容量正常。阴影也可呈“游走性”,在几周内,病变可以在不同部位变化。这些斑片状浸润影多分布在外周,类似“嗜酸粒细胞性肺炎”。有时,病变表现为多部位的实变,多为双侧,单侧少见。影像学上表现为弥漫性间质性浸润的病人不超过20%,往往继发于结缔组织病,一旦出现间质性肺浸润,预示预后不良。有些病人表现为局灶性肺实变。胸腔积液不超过25%。
COP患者的支气管肺泡灌洗液BALF提示淋巴细胞总数和比例提高,中性粒细胞和嗜酸粒细胞也增加。COP患者的肺功能通常为轻至中度的限制性通气功能障碍和弥散功能障碍。少数病人可有气道阻塞(FEV1/FVC<70%),多见于吸烟患者。可有轻度静息和(或)劳力后低氧血症。
诊断COP需要结合临床和影像学检查,但是确诊还是依靠组织病理学证据。经支气管镜肺活检TBLB的组织如果足够大(包括肺泡、肺泡管、肺间质)可以确定诊断。但是如果TBLB取不到足够大的组织,则常常需要开胸肺活检取得病理标本。
根据影像学,COP有肺实变者需与肺泡癌、淋巴瘤、血管炎特别是Wegener's肉芽肿、结节病和感染(特别是结核或不典型分支杆菌感染)相鉴别。当实变在胸膜下时,应与慢性嗜酸粒细胞肺炎相鉴别。如为多发性大结节,鉴别诊断时应考虑是否存在转移性肿瘤、淋巴瘤和早期肺脓肿的可能。实变在支气管周围和胸膜下分布时应考虑到COP的可能,如同时存在磨玻璃样影和囊肿,还需与淋巴细胞性间质性肺炎LIP或脱屑性间质性肺炎DIP相鉴别。大多数COP病人经皮质激素治疗后影像学可获明显改善。
COP是一种糖皮质激素治疗有效的疾病。激素治疗后,临床症状的改善往往是迅速而显著的,通常在几天或几周内出现症状的改善,病人的预后往往非常满意,有超过2/3的病人肺部病变能够完全吸收。激素的用量为泼尼松0.75 mg/kg/d,2~4周后,激素逐渐减量。在病情快速进展的COP患者,可能需要短期大剂量糖皮质激素冲击治疗,激素的总疗程为6~12个月,如果疗程少于3个月,约1/3的患者可出现复发。约10%~15%的COP患者对糖皮质激素没有反应,而免疫抑制剂,如环磷酰胺、硫唑嘌呤等的疗效至今还不明确。即使不治疗,少部分病人经过几个月后也可自行康复。