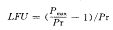 |
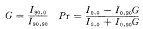 |
关键词:星形胶质细胞;少突胶质细胞;酒精;膜脂质流动性
摘要: 为探讨酒精所致的神经元分化成熟迟滞和髓鞘形成受阻机制,本文以DPH荧光探针研究了酒精对与神经元和髓鞘发育相关的星形胶质细胞、少突胶质细胞膜脂质流动性的影响。结果表明5mmol/L酒精可导致星形胶质细胞、少突胶质细胞DPH荧光探针的荧光偏振度(Pr)降低,膜脂质流动度(LFU)增高,呈明显的剂量-反应关系,并发现酒精对星形胶质细胞作用强于少突胶质细胞。上述结果揭示酒精能改变两种胶质细胞的膜脂质流动性。它可能在酒精所致的神经元和髓鞘功能发育异常中起重要作用。
中图分类号: O623.411 Q593.4
Effects of alcoholon membrane lipid fluidity of astrocytes
and oligodendrocytes
Qu Weidong, Zhang Benzhong, Wu Desheng, Xiao Bangliang,et al.
Department of Nutrition and Food Hygiene, College of Public Health
West China University of Medical Science, Chengdu 610041,China
To explore the mechanism of neuron development retardation andmyelination abnormality caused by alcohol,the membrane lipid fluidity of astrocytes andoligodendrocytes which is related to neuron and myelin development were measured by usingDPH fluorescence probe. The results showed that 5mmol/L alcohol could lead to decrease thepolarization of fluorescence (Pr) and increase the lipid fluidity unit of membrane in bothcells. The alteration was in obvious dose-response relationship. The effect of alcohol onastrocytes was strongger than that of oligodendrocytes. It indicated that alcohol couldchange lipid fluidity of cell membrane. Alcohol probably plays major role in thedysfunction of astrocytes and oligodendrocytes.
Key words: alcohol, lipid fluidity of membrane, astrocytes,oligodendrocytes
对胎儿酒精综合征的研究证实酒精可影响神经元膜脂质和突触体膜脂质流动性,导致膜脂与膜蛋白相互关系发生紊乱[1] 。由于不同神经毒物对细胞损害有差异,对同一种神经毒物的敏感性也因细胞类型不同而异。以往研究显示酒精能影响神经元的分化成熟和髓鞘形成,但它们是否是酒精影响了与之相关的星形胶质细胞和少突胶质细胞膜脂质流动性尚不清楚。因此,本研究应用DPH荧光探针探讨酒精对星形胶质细胞、少突胶质细胞膜脂质流动性的影响,为阐明酒精对星形胶质细胞和少突胶质细胞的损伤机制和酒精致脑发育异常的可能机制提供实验依据。
1 材料和方法
1.1 材料
1.1.1 试剂 酒精,色谱纯,上海化学试剂厂。培养基:DMEM-F12 ,BoeingerMannheim公司。荧光探针DPH(1.6-Dipherryl-1,3,5-hexatrifiene,瑞士Fluka公司产品),胰酶(1∶250Difico公司产品)Hanks液,PBS 液按标准配制(pH7.2,0.01 mol/L)。
1.1.2 仪器 荧光分光光度计(岛津RF600型,日本),倒置显微镜,血球计数器,二氧化碳培养箱。
1.1.3 实验动物 健康成年SD大鼠,雌鼠体重200~230g,雄鼠体重250~280g。每日18∶00时按1∶1合笼次日8∶00时经镜检有活动精子者为受孕的第0天,于孕19天处死。
1.2 方法
1.2.1 实验分组 本研究设对照组和实验组,对照组仅含DMEM-F12 培养液。3个实验组,分别施予终浓度为2、5和20mmol/L的酒精。
1.2.2 DPH荧光探针制备 取0.464mgDPH,加入1ml四氢呋喃使之溶解。DPH浓度为2 mmol/L,在棕色瓶中避光保存于4℃冰箱待用。使用前用磷酸盐缓冲液(PBS)稀释至1/1000,使DPH应用液浓度为2μmol/L。强力振摇5~10min后待用。
1.2.3 细胞分离培养 于孕19天处死大鼠,分离全脑,剥离脑膜,按Booher法略加修正培养分离星形胶质细胞、少突胶质细胞,待细胞数至5×106 个/ml,更换培养基,施予设计浓度的酒精,连续培养48h。
1.2.4 细胞标记及处理 染毒培养结束后弃上清培养液,以PBS液(pH7.2,0.01mol/L)清洗培养瓶2~3次,以胰酶(0.25%,W/V)于室温条件消化细胞,呈球形后离心(1000r/min,5min),弃上清液再加PBS液洗涤,调整细胞密度至2×106 个/ml,加入与培养后收获细胞悬液等体积的DPH探针,37℃孵育30min,再经离心,使细胞再悬浮于原孵育体积的PBS液中[2] ,以岛津RF-600型荧光分光光度计测定荧光偏振度(Pr)。激发波长为362nm,发射波长为432nm,狭缝宽度为5nm。
1.2.5 观察指标 1)荧光偏振度(Pr);2)细胞膜脂质流动度(LFU)。依据下列公式计算Pr及LFU[3] 。其中G为校正因子
式中:I0,0 为起偏器和检偏器相互平行时测出的荧光强度;
I0,90 为起偏器和检偏器相互垂直时测出的荧光强度;
I90,0 为起偏器为垂直方向检偏器为水平方向时测出的荧光强度;
I0,90 为起偏器为水平方向检偏器为垂直方向测出的荧光强度;
细胞膜的流动度(LFU)根据Einsteins硬粒子溶液粘度公式计算:
Pr——为荧光偏振度的测定值;
Pmax——荧光偏振度的理论极限值(Pmax=0.5);
LFU——细胞膜流动度,该指标可直观定量地描述膜的流动性。
2 结果
2.1 细胞膜脂质激发光谱和发射光谱
酒精对星形胶质细胞、少突胶质细胞膜脂质的DPH激发光谱和发射光谱与对照组相同,激发峰值和发射峰值分别在362nm和432nm处。
2.2 细胞膜脂质荧光偏振度和流动度
从附表可见,不同剂量酒精染毒时,可导致星形胶质细胞、少突胶质细胞膜脂质中DPH探针的荧光偏振度下降。中、高剂量组显著低于对照组(P<0.05),且剂量与荧光偏振度呈显著负相关(r=-0.946和-0.832,P<0.05)。各剂量组两种细胞膜脂质流动度均随着染毒剂量的增加而增高,呈显著正相关(r值分别为0.948和0.899,P<0.05),中、高剂量组显著高于相应对照组(P<0.05)。20mmol/L时星形胶质细胞膜脂质荧光偏振度值、膜流动度改变均显著高于少突胶质细胞。
附表 酒精对星形胶质细胞和少突胶质细胞膜脂质流动性的影响
| 酒精浓度 (mmol/L) | 星形胶质细胞 | 少突胶质细胞 | ||
| 荧光偏振度(Pr) | 流动度(LFU) | 荧光偏振度(Pr) | 流动度(LFU) | |
| 0 | 0.275±0.0040 | 2.952±0.139 | 0.276±0.0040 | 2.951±0.140 |
| 2 | 0.268±0.0021 | 3.23±0.083 | 0.269±0.0017 | 3.174±0.0064 |
| 5 | 0.237±0.0034(1) | 4.70±0.199(1) | 0.240±0.0031(1) | 4.517±0.173(1) |
| 20 | 0.206±0.0037(1,2) | 6.09±0.284(1,2) | 0.232±0.0034(1) | 4.968±0.206(1) |
| r | -0.946(3) | 0.943(3) | -0.832(3) | 0.849(3) |
注:(1) 与对照组比较P<0.05 (2)与同剂量少突胶质细胞组比较P<0.05 (3)与酒精浓度的相关性P<0.05
3 讨论
本实验观察发现,酒精对两种细胞膜中DPH激发光谱和发射光谱无影响。说明引入酒精未改变细胞膜中DPH分子周围极性所导致DPH荧光发射光谱的改变。但是酒精对星形胶质细胞和少突胶质细胞膜脂质的荧光偏振度、流动度却有明显影响。随酒精剂量递增,荧光偏振度显著下降,呈显著负相关关系;流动度(LFU)显著升高,呈显著正相关关系。由于荧光探针可结合在脂质双分子层疏水烃链区,当烃链排列紊乱或流动性增大时,DPH的Pr值降低,导致了膜脂流动性改变。因此,细胞膜脂质流动性改变反映脂肪酸烃链部分的排列和运动的情况。
酒精对膜脂质流动性的改变可能是酒精属亲脂性溶剂,有较高的脂/水分配系数,通过影响膜脂合成或降解过程引起膜组分,特别是膜脂质和磷脂的改变,而影响两种细胞膜脂质的流动性[4] 。另一方面进入膜脂中的酒精诱导膜有序结构紊乱或膜蛋白和膜脂相互作用,引起膜结合蛋白空间构象改变和脂质双分子层的改变,从而导致两种细胞膜脂质流动性增加。
研究中同时观察了酒精对两种细胞膜脂质流动性的影响。酒精在低剂量时对两种细胞膜脂质流动性的影响无显著性差异(P>0.05)。高剂量(20mmol/L)时,星形胶质细胞的Pr值显著低于少突胶质细胞,而其LFU值显著高于少突胶质细胞,表明酒精对星形胶质细胞膜结构功能的影响大于少突胶质细胞。
由于细胞膜脂质的流动性与物质转运、信息传递、能量转换和细胞分化有关,从而不难理解酒精所导致星形和少突胶质细胞膜脂质流动性的严重改变,必然将影响这些结构功能及细胞的正常生长和发育;进而可引起相关细胞的结构和功能发育分化异常。进一步的机制还有待探讨。
本课题承蒙四川省计生委资助
作者简介: 屈卫东,博士,现在上海医科大学做博士后
参考文献
1 Chin JH, Goldstein DB. Drug tolerance in biomembranes:A spin-labelstudy of the effect of ethanol. Science, 1976,196:684—685
2 林克椿.用荧光试剂DPH研究腹水癌细胞膜脂流动性.生物化学与生物物理学进展,1989,6:32—35
3 Shinitzkey M, Barenholz Y. Fluidity parameters of lipid regions determined byfluorescene polarization. Biochem Biophy Acta.1978,515:367—372
4 Pardee AB. G1 events and regulation of cell proliferation.Science,1989,246:603—608
(1998-10-20收稿) , 百拇医药