关键词:脑缺血;再灌注;血管内膜
【摘要】 目的 探讨脑缺血再灌注后脑微血管结构损害的特征及发生机制。 方法 应用光镜、透射电镜、免疫组织化学等技术,观察易卒中型肾血管性高血压大鼠局部脑缺血2 h再灌注6 h至7 d时脑微血管结构、基底膜Ⅳ型胶原抗原和层连蛋白抗原变化。 结果 局部脑缺血再灌注病灶区脑水肿及并发出血以再灌注12h至3 d最为严重,脑微血管基底膜 大片溶解、缺损。再灌注12 h后脑微血管基底膜主要成分Ⅳ型胶原抗原、层连蛋白抗原减少,其阳性单位(PU值)分别为20.17±2.91和15.96±4.81,与对照组比较差异有显著性(均 为P<0.05);再灌注7 d分别为5.12±2.70和5.26±2.17,与对照组比较差异有极显著性(均为P<0.01)。 结论 脑缺血再灌注后脑微血管基底膜破坏是导致再灌注后脑水肿、出血的主要病理基础,脑微血管基底膜成分的减少是基底膜破坏的根本原因。
Changes in thestructure and components of the brain microvascular basement memb rane in reperfusionareas after focal cerebral ischemia in renovascular hyperten sive stroke-prone rats
LI Ling HUANG Ruxun ZHANG Xiaoyan, et al.
(Depa rtment of Neurology, First Affiliated Hospital, Sun Yat-sen University of Medic alSciences, Guangzhou 510080,China)
【Abstract】 Objective Toapproach the structural changes of brain microvascula ture and the possible mechanism ofmicrovascular lesion after focal cerebral isc hemia and reperfusion. Methods Reperfusionin renovascular hyperte nsive stroke-prone rats (RHRSP) model were performed. Usingimmunohistochemical staining, opti cal microscopy and transmission electron microscopy,changes of type Ⅳ collagen and laminin antigens, the main components of themicrovascular basement membran e, and the changes of miocrovascular structure wereobserved in ischemic focus a nd perifocal areas 2 hours after focal cerebral ischemia atvarious time points. Results The brain edema and hemorrhage were most severe between12 hours and 3 days after reperfusion. Ultrastructural changes showed that the basementmembra ne damages included degradation, defection and exfoliation. Twelve hours afterreper fusion, the main components of the basement membrane such as type Ⅳ collagen an dlaminin being 20.17±2.91 positive unit and 15.96±4.81 positive unit resp ecti vely,significantly decreased compared with that of the control group (P<0 .05). Seven d aysafter reperfusion the positive unit of type Ⅳ collagen and laminin were 5. 12±2.70 and5.26±2.17, respectively (P<0.01 ). Conclusions The mechanism of main pathologicchanges such as brain edema and hemorrhage afte r cerebral ischemia with reperfusion wereresulted from the basement membrane da mages of brain microvasculature, and the decreasesin the components of basement membrane contributed to the basement membrane lesion and theloss of microvascu lar integrity.
【Key words】 Cerebral ischemia; Reperfusion; Tunicaintima
脑微血管基底膜在维护脑微血管完整性方面起重要作用,但有关脑缺血再灌注脑微血管基底膜及其成分改变的研究甚少,尤其长时间的动态观察尚未见报道。我们于1997年9月至1998年12月观察了易卒中型肾血管性高血压(renovascularhypertensive stroke-prone, RHRSP)大鼠局部脑缺血2 h再灌注6 h至7 d时病灶区脑微血管结构及构成成分的改变,以期探讨脑缺血再灌注病灶区脑微血管损害特征及机制。
材料与方法
一、RHRSP大鼠模型的制备及血压观测
雄性Spraque-Dawley大白鼠(SDR)90只,体重90~120 g,鼠龄2~3个月。80只SDR行双肾双夹肾动脉狭窄术〔1〕 制成RHRSP大鼠模型,术后1周开始用尾筒法通过MRB-ⅢA型大鼠心率血压仪每周测量血压1次,最后一次测量在断颅取脑前。10只SDR作假手术组,血压观测方法同上。
二、可再灌注大脑中动脉闭塞(MCAO)模型的制备
1.RHRSP大鼠模型的选择:(1)双肾动脉狭窄术后高血压持续8~10周以上;(2)血压达180mm Hg(1 mm Hg=0.133 kPa)或以上;(3)从未出现脑卒中的症状和体征;(4)体重在350~450g,平均(408±10) g。除去模型制备过程中发生脑卒中及死亡的23只大鼠外,余57只用于制备MCAO模型。
2.MCAO模型制备:将RHRSP大鼠分为对照组和实验组。实验组应用改良的Longa等〔2〕 的方法,行大鼠左侧MCAO,再灌注时将尼龙线从颈外动脉残端抽出,即恢复颈内动脉和大脑中动脉血流。对照组仅行大鼠左侧颈总动脉及颈内、外动脉分离,未行MCAO。实验组分为缺血2h再灌注6 h、12 h、24 h、3 d、7 d组。麻醉意外死亡2只及再灌注后12 h~3d死亡7只均除去,每组大鼠各8只。
3.生理指标测量:MCAO术前30 min测体重,术前30 min和术后30 min各测血压、直肠温度、血气(pH、PO2 、PCO2 )1次。取股动脉血0.4ml行血气分析。为使大鼠直肠温度在术中保持37℃,用100 W灯照射。
三、病理检查
全部大鼠均行4%多聚甲醛、0.1 mol/L PBS(pH 7.4)经升主动脉灌注固定后取脑,进一步固定后脱水、包埋、切片,光镜和电镜观察。
四、免疫组织化学观察
石蜡切片经脱蜡、水化,3% H2 O2 抑制内源性过氧化物酶,1%牛血清白蛋白封闭后,滴加适当稀释的第一抗体(Ⅳ型胶原1∶50,层连蛋白1∶80,丹麦DAKO公司产品),4℃过夜。滴加适当稀释的生物素标记第二抗体,37℃温育30min。滴加适当稀释的过氧化酶-链霉素卵白素,37℃温育30 min。3,3-二氨基联苯胺显色液显色。以上各步均经PBS冲洗3次。苏木素复染、封片。设空白对照和血清替代对照。
五、免疫组织化学染色强度结果分析
采用显微镜-计算机彩色图像处理系统(Kontron IBAS 2.5全自动图像分析仪,德国产),显微镜下(10×20)选MCAO侧大脑半球病灶区5个视野,观测Ⅳ型胶原及层连蛋白阳性反应产物灰度级(Ga)和面积(n)、测试区域的灰度级(GA)和背景面积(m)。测试仪器的最大灰度分级(Gmax)为256。应用申洪〔3〕 推导的免疫组织化学原位杂交定量计算公式,得出阳性单位(PU)值。
六、统计学处理
采用SPSS统计软件包对数据进行统计分析。所有计量资料用
结 果
一、血压改变
RHRSP术后7 d大鼠血压开始明显上升,平均为(128.32±8.92)mm Hg,术后3周为158.78mm Hg,并逐渐稳定缓慢上升,10周为(195.98±12.23)mm Hg,12周为(210.75±21.75)mmHg。RHRSP组自术后第7天始至12周内血压值与假手术组血压值比较,差异有显著性(P<0.05)。
二、MCAO前后生理指标观测
结果见表1。各指标MCAO前、后比较差异无显著性。
表1 MCAO前、后大鼠生理指标比较(
| 组别 | 大鼠数 (只) | 体重 (g) | 血压 (mmHg) | 温度 (℃) | 血气分析 | ||
| pH | PCO2 (mmHg) | PO2 (mmHg) | |||||
| MCAO前 | 57 | 389.42±4.90 | 217.28±4.45 | 37.59±0.03 | 7.40±0.03 | 38.70±3.60 | 96.50±4.60 |
| MCAO后 | 48 | 385.17±5.08 | 219.90±2.88 | 37.00±0.19 | 7.39±0.03 | 39.20±2.90 | 93.80±3.60 |
1.HE染色:局部脑缺血再灌注MCAO区依再灌注时间的病理改变:(1)6h:脑微血管外细胞外间隙轻度水肿,主要局限在基底节区,未见出血;(2)12 h:脑微血管外细胞外间隙水肿,细胞外间隙增宽,神经元、胶质细胞肿胀,分布在基底节、皮质;(3)24h:脑微血管外细胞外间隙水肿最严重,可见血管周围有红细胞漏出,有点片状出血灶,基底节、皮质均被累及;(4)3 d:脑微血管外细胞外间隙水肿有所减轻,细胞外基质溶解,可见小血管周围灶
性出血(图1);(5)7d:细胞外基质溶解,组织结构欠清,可见细胞变性、坏死。

图1 RHRSP局部脑缺血再灌注3d,病灶及边缘区见出血灶 HE染色 ×100
2.电镜观察:主要观察脑微血管内皮细胞、紧密连接、基底膜、管周星形胶质细胞足突。对照组大鼠未见水肿及结构破坏。实验组大鼠:(1)6h组:脑微血管内皮细胞稍水肿,吞饮小泡增加,紧密连接、基底膜结构尚完整,管周星形胶质细胞足突轻度水肿;(2)12h组:脑微血管内皮细胞吞饮小泡增加,胞浆轻度水肿,基底膜节段性结构不清、模糊,管外水肿明显(图2);(3)24h组:脑微血管内皮细胞明显水肿,胞浆稀疏,管腔狭窄,基底膜部分溶解、缺损;(4)3d组:脑微血管基底膜溶解、脱落,呈节段性缺损,微血管外细胞外间质溶解,仅少数内皮细胞紧密连接开放;(5)7d组:脑微血管基底膜溶解、缺损,部分微血管壁结构不清、模糊,少数内皮细胞紧密连接开放、结构模糊、不完整,管外细胞外间质大量溶解。

图2 RHRSP局部脑缺血再灌注12h,病灶区脑微血管基底膜溶解、缺损电镜 ×6610
四、免疫组织化学结果
正常脑微血管基底膜Ⅳ型胶原抗原、层连蛋白抗原反应呈现清晰的棕黄色圆条状、小树枝状、圆圈状。缺血再灌注12h后,病灶区脑微血管基底膜Ⅳ型胶原抗原、层连蛋白抗原减少,与对照组比较差异有显著性,见表2。随再灌注时间延长,基底膜Ⅳ型胶原抗原、层连蛋白抗原减少,至再灌注7d病灶区脑微血管基底膜Ⅳ型胶原抗原、层连蛋白抗原近于消失,见图3、4。
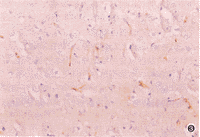
图3 RHRSP局部脑缺血再灌注24h,病灶区Ⅳ型胶原抗原明显减少 ABC法 ×200

图4 RHRSP局部脑缺血再灌注24h,病灶区层连蛋白抗原明显减少 ABC法 ×200
表2 局部脑缺血再灌注病灶区脑微血管
基底膜Ⅳ型胶原抗原、层连蛋白抗原变化(
| 组别 | 大鼠数 (只) | Ⅳ型胶原 | 层连蛋白 |
| 对照组 | 8 | 22.24±3.84 | 18.03±4.09 |
| 实验组 | |||
| 6h组 | 8 | 20.17±2.91 | 15.96±4.81 |
| 12h组 | 8 | 16.82±3.56 | 12.68±3.73 |
| 24h组 | 8 | 11.50±4.68 | 11.61±3.05 |
| 3d组 | 8 | 9.67±3.94 | 8.53±3.65 |
| 7d组 | 8 | 5.12±2.70 | 5.26±2.17 |
讨 论
本实验选用RHRSP、以改良的Longa等的方法制备局部脑缺血再灌注模型,病理检查均见梗死灶,成功率达100%〔2〕 。在高血压持续一定时间并伴有脑血管病变的大鼠上复制脑缺血大鼠模型比用正常大鼠更接近临床实际发病情况。高血压大鼠由于其侧支循环明显较正常鼠差,局部脑缺血后其病灶稳定,变异度小,有利于脑缺血及再灌注病理生理机制的研究及治疗脑卒中药物的疗效评价〔4〕 。
Yang和Betz〔5〕 观察了局部脑缺血再灌注大鼠模型,发现缺血再灌注后,血脑屏障损伤,伊凡斯蓝(Evens Blue,EB)漏入脑组织,认为可能是再灌注后脑微血管内皮细胞紧密连接开放所致。然而,也有研究认为再灌注后的脑微血管损害不完全是紧密连接开放所致。唐外星等〔6〕 观察了全脑不完全性缺血30min、再灌注60min至6h脑微血管结构的变化,发现再灌注60min毛细血管内皮细胞吞饮小泡增加,再灌注3h细胞水肿明显加重,基底膜严重破坏。但局部脑缺血再灌注病灶区脑微血管超微结构的损害,尤其是再灌注24h乃至7d以后病灶区脑微血管变化如何?尚不清楚。本实验结果表明,再灌注早期病灶区微血管损害是以基底膜的损害为主,损害特征为基底膜溶解、脱落、节段性缺损。同时,脑水肿加重,管周片状出血,细胞外间质溶解,以再灌注12h至3d脑水肿、出血最为严重。因而,我们认为再灌注后的脑水肿是以脑微血管损害为主的血管源性水肿,伴片状出血,其机制是微血管结构的完整性受损,其中微血管基底膜和细胞外间质的溶解、破坏起着重要作用。脑微血管有两种解剖和功能上的屏障,即微血管内皮细胞紧密连接和微血管基底膜及细胞外间质。其中基底膜和细胞外间质防止血液及血细胞渗出,对微血管起着支撑作用。脑缺血再灌注后,脑微血管基底膜的溶解、脱落、缺损使微血管结构的完整性被破坏,同时细胞外间质的大量降解使微血管失去支撑,更易引起血管源性脑水肿及出血,这可能是再灌注损伤的重要机制之一。
Ⅳ型胶原和层连蛋白是构成基底膜的主要物质。Hamann等〔7〕 和Okada等〔8〕 用激光共聚焦显微镜和免疫荧光组织化学法观测,发现局部脑缺血再灌注24h后脑微血管基底膜层连蛋白、纤维连接蛋白、Ⅳ型胶原等的数量和信号强度均明显减少,血管基底膜抗原也同步消失,表明脑缺血再灌注后存在脑微血管基底膜损害。本实验进行的脑缺血再灌注长时间动态观察发现,再灌注后的脑水肿和并发的出血以再灌注12h至3d最为严重。再灌注12h至7d,脑微血管基底膜呈大片脱落、溶解、缺损;同时,作为脑微血管基底膜主要成分的Ⅳ型胶原抗原、层连蛋白抗原明显减少并逐步近于消失,其分布范围与脑水肿、出血相一致。因而,本研究从形态结构和组织化学成分,说明了脑缺血再灌注脑微血管损害是以基底膜破坏为主,而且病理改变持续1周左右;脑微血管基底膜Ⅳ型胶原、层连蛋白等成分的减少是基底膜破坏的根本原因。目前有关基底膜成分降解的机制尚不清楚,推测可能与内皮源性金属蛋白酶和纤溶酶系统有关。
基金项目:广东省科委攻关基金项目(97009)
参考文献
1,黄如训,曾进胜,苏镇培,等.易卒中型肾血管性高血压大鼠模型. 中国神经精神 疾病杂志,1991,17:257-260.
2,李玲,黄如训,苏镇培.高血压大鼠局部脑缺血再灌注病灶区超微结构改变. 中国神经精神疾病杂志, 1996,22:193-195.
3,申洪. 免疫组织化学染色定量方法研究(Ⅲ).中国组织化学与细胞化学杂志, 19 95,4:89-91.
4,李玲, 黄如训,苏镇培.慢性高血压对局部脑缺血再灌注梗塞灶影响的实验 研究. 高血压杂志,1998,1:16-19.
5,Yang GY, Betz AL. Reperfusion-induced injury to the blood-brain barr ie r after middlecerebral artery occlusion in rats. Stroke, 1994,25:1658-1664.
6,唐外星,杨于嘉,虞佩兰,等.大鼠脑缺血再灌注模型的脑水肿属性与发生机制.中 华医学杂志,1989,69:160-162.
7,Hamann GF, Okada Y, Fitridge R, et al. Microvascular basal lamina antigens dis appearduring cerebral ischemia and reperfusion. Stroke, 1995,26:2120-2126.
8,Okada Y, Copeland BR, Fitridge R, et al. Fibrin contributes to microva scularobstructions and parenchymal changes during early focal cerebral ischemia and reperfusion.Stroke, 1994,25:1847-1853.
(收稿日期:1999-08-11 ) , http://www.100md.com