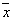 |
关键词:肺表面活性物质;婴儿;新生;肺透明膜病
【摘要 】 目的 探讨肺表面活性物质(Exosurf)治疗新生儿肺透明膜病(HMD)的疗效及其并发症。 方法 采用回顾性分析的方法对用药前、用药后30分钟及用药后6小时血气指标,机械通气参数进行比较分析,通过肺氧合情况判断疗效,分析转归及并发症。结果 16例患儿血气指标及机械通气的参数用药前与用药后6小时比较差异有显著性,氧分压(PO2 )由(41.6±6.0)mmHg(1mmHg=0.13kPa)升高至(62.9±2.0)mmHg,动脉压泡氧分压比值(a/APO2 )由(0.12±0.03)mmHg升高至(0.24±0.11)mmHg,PO2 /FiO2 由(74.6±16.4)mmHg升高至(147.4±59.9)mmHg,FiO2 由0.58±0.07降至0.45±0.09,MAP由(13.0±1.3)mmHg降至(11.1±1.6)mmHg。24小时内复查胸片13例明显好转,2例无改变,1例合并肺出血。其中痊愈12例(治愈率75%),死亡2例,放弃2例。结论 肺表面活性物质(Exosurf)的运用可以改善肺透明膜病的转归,降低病死率。
The Application ofPulmonary Surfactant and
Prognosis of Hyaline Membrane Disease
LUO Xianqiong
Guangdong Provincial Hospital for Maternal and Children Health, Gougzhou, 510010
【 Abstract 】 Objective To explore the therapeutic effectand complications of pulmonary surfactant(Exosurf) in the treatment of hyaline membranedisease of newborn. Methods Blood gas indexes and parameterof mechanical ventilation before, 30 minute and 6 hours after the Exosurf were analyzedretrospectively. Results Before and 6 hours after theExosurf was given, there was significant difference in blood gas indexes and parameters ofmechanical ventilation of 16 newborns with HMD.PO2 increase from 41.6±6.0 mmHgto 62.9±2.0 mmHg,a/APO2 from 0.12±0.03 mmHg to 0.24±0.11 mmHg,PO2 /FiO2 from 74.6±16.4 mmHg to 147.4±59.9 mmHg, FiO2 decrease from 0.58±0.07 to 0.45±0.09,MAP from 13.9±1.3 mmHg to 11.1±1.6 mmHg, 13 newborn's chest X-ray films were improvedobviously in 24 hours,2 had no change,1 complicate with pulmonary hemorrhage.12 werehealed, and 2 died and 2 abandoned treatment. Conclusion The pulmonary surfactant(Exosurf) can improve theprognosis of HMD, decrease the mortality, but Exosurf is synthetic pharmaceutical and theapplication needs further study.
【 Keywords 】 Pulmonarysurfactant Newborn Hyaline membrane disease
肺表面活性物质治疗肺透明膜病(HMD)在发达国家已成为常规。其替代疗法可以减少HMD的病死率,缩短机械通气的时间,减少并发症。我院自1996年6月~1997年12月运用肺表面活性物质(Exosurf)治疗新生儿HMD16例,现总结如下。
临床资料
一、一般资料
男12例,女4例。胎龄(27±3)周~(36±5)周。体重0.8kg~1.9kg。分娩产式:剖宫产6例,顺产7例,臀牵引产3例。母并发症:前置胎盘4例,胎膜早破4例,多胎(2胎以上)6例,脐带脱垂1例。轻度窒息5例,重度窒息5例。
二、给药条件及方法
1.给药条件:(1)临床及X线确诊为新生儿HMD。胸片示网状颗粒阴影加支气管充气征6例;毛玻璃样改变加支气管充气征7例;白肺3例。(2)合并呼吸衰竭需行气管插管机械通气。(3)血气分析指标动脉肺泡氧分压比值(a/APO2 )<0.22。
2.给药时间:生后1~16小时(3.94小时±3.49小时)。
3.给药剂量:从经济、节省、疗效等多方面出发,用药剂量不等44.08~118mg/kg[平均(67.75±17.1)mg/kg]。
4.方法:先将108mg 1支的Exosurf置于手心温化,并溶解于已配置好的8ml溶剂中,充分摇匀,抽到10ml注射器中,给药方法有2种:其中14例为侧孔给药,气管插管连接带有侧孔的连接器,药液通过连接于气管插管与呼吸机管道之间的特殊连接器上的侧孔注入,分左侧、仰卧、右侧三个体位各1/3剂量缓慢注入。每次1~2分钟,共10分钟完成给药。用药过程中不断以复苏囊加压给氧,使药液充分进入两肺。另2例为喂养管给药,用无菌注射器吸取药液将与注射器相接的细管通过气管插管送至气管分叉处,仰卧位在5秒钟内一次快速给药,给药后复苏囊加压给氧1~2分钟。
用药前后注意事项:用药前检查气管插管位置是否正确,吸净气道分泌物,用药后6小时内不吸痰(除外有呼吸道阻塞现象);给药后根据患儿情况调节呼吸机参数,保持血气指标及血氧饱和度在正常范围;定期复查血气分析及24小时内复查胸片。
结果
一、16例患儿血气指标及机械通气参数用药前与用药后6小时比较差异有显著性意义,PO2 由(41.6±6.0)mmHg(1mmHg=0.13kPa)升高至(62.9±2.0)mmHg,a/APO2 由(0.12±0.03)mmHg升高至(0.24±0.11)mmHg,PO2 /FiO2 由(74.6±16.4)mmHg升高至(147.4±59.9)mmHg,FiO2 由0.58±0.07降至0.45±0.09,MAP由(13.0±1.3)mmHg降至(11.1±1.6)mmHg。而用药前与用药后30分钟各项参数变化不显著,仅PaCO2 、MAP有显著性意义(见表1)。
表1 16例患儿运用PS前后血气分析指标及机械通气参数变化情况(±s)
| 用药时间 | PO2 (mmHg) | PaCO2 (mmHg) | a/APO2 | PaO2 /FiO2 (mmHg) | FiO2 | MAP(mmHg) |
| 用药前 | 41.6±6.0 | 54.8±10.7 | 0.12±0.03 | 74.6±16.4 | 0.58±0.07 | 13.0±1.3 |
| 用药后半小时 | 48.2±8.1 | 50.0±8.6 | 0.16±0.04 | 97.5±20.7 | 0.50±0.05 | 12.2±1.4* |
| 用药后6小时 | 62.9±2.0** | 41.3±8.9* | 0.24±0.11** | 147.4±59.9** | 0.45±0.09** | 11.1±1.6* |
| F值 | 14.58 | 8.36 | 13.73 | 15.49 | 10.21 | 6.96 |
24小时内复查胸片结果:13例明显好转,2例无改变,1例合并肺出血。
平均上机时间:2例因放弃治疗不统计上机时间,2例因肺出血合并严重感染反复上机17~19天。余12例上机时间为23~87小时(42.6小时±23.0小时)。
二、并发症
肺部感染4例,肺出血3例,颅内出血3例,动脉导管未闭3例,支气管肺发育不良1例,早产儿视网膜病1例。
三、转归
痊愈12例(治愈率75%),死亡2例(原因为肺出血合并严重感染),放弃2例(1例颅内出血合并严重脑积水,1例为经济原因,体重0.77kg而放弃)。
讨论
一、对于不可避免的早产,于产前数日运用糖皮质激素促进肺表面活性物质成熟,可使HMD的发生率减少55%~65%,而在基层广大泛围内,孕母无产检,多数不可避免的早产在来不及运用糖皮质激素时胎儿已分娩,因此HMD仍是早产儿严重并发症之一。本院在转运的早产儿中HMD占17.48%,因此机械通气及肺表面活性物质替代治疗是降低HMD病死率的重要手段之一。
二、肺表面活性物质分人工合成和自然提取的两种。Exosurf为人工合成制剂,是美国Clements等用二棕榈卵磷脂(DPPC)、16-烷醇和四丁酚醛以13.5∶1.5∶1比例组成,DPPC降低表面张力,16-烷醇加速DPPC吸附,四丁酚醛则促进DPPC扩散。肺表面活性物质注入终末气道内由于降低了肺泡内气液交界面周围的表面张力使呼气时肺泡腔的大小保持稳定,降低气道和肺泡在开放时的压力,有利于肺泡功能的恢复。本文PO2 /FiO2 及a/A值显著升高,说明肺的换气功能明显改善。注入后短期内能使萎缩的肺泡容积增加,气体交换改善,需要机械通气的条件明显改善,压力降低,吸入氧浓度降低,机械通气时间缩短,治愈率明显提高。本文16例治愈12例,治愈率75%。
三、本文所列并发症肺部感染4例考虑与机械通气有关,而颅内出血3例及肺出血3例均在运用PS后较早期发生,因此考虑与PS有关。PS引起肺出血的原因尚不明确,可能与下列因素有关:由于肺泡表面活性物质进入终末气道后肺泡迅速膨胀,肺泡膨胀后,血流重新分配,大量血入肺,肺毛细血管扩张,缺氧、感染、酸中毒使毛细血管通透性改变,是肺出血的一个原因。大量血入肺后,血压波动,因此易至颅内出血,而正压通气的压力也可通过枕骨大孔直接传导到颅内,可影响上腔静脉返流,使颅内压增高,引起新生儿颅内出血。肺表面活性物质还可诱发前列腺素释放,使动脉导管重新开放,采用及时调整呼吸机参数及给予消炎痛治疗,3例于给药后48小时闭合。有文献报道因Exosurf中添加剂的原因,运用后可使呼吸暂停增多,本文16例在预计撤机前即开始运用氨茶碱,时间1~2周,无1例出现呼吸暂停。
四、Exosurf运用中失败的原因也较复杂,综合考虑如下因素:(1)因经济及药物来源的问题,肺表面活性物质用量不足,本文平均剂量(67.75±17.11)mg/kg,而常规推荐剂量为80mg/kg,目前一般运用剂量为100~200mg/kg。肺功能不成熟及机械通气的损害可使肺泡内大量蛋白及大分子物质渗出,从而抑制肺表面活性物质的作用,因此肺表面活性物质给药充足或重复用药,可使肺泡内血浆蛋白等抑制物质的作用减弱,增强疗效。(2)由于人工制剂缺少天然肺表面活性物质所含有的特异蛋白,因此使PS在肺泡壁上的吸附及展开能力较天然制剂差,另外有实验表明,该种外源性的PS磷脂制剂因有待于内源性PS蛋白的大量分泌,然后才协同发挥作用。因此,用药后起效慢,氧合改善慢。(3)用药方法不当:用药过程中药物返流或运用过迟,应尽量在机械通气前应用,返流时应减慢给药速度,给予复苏囊加压给氧。呼吸较强时用镇静剂或呼吸抑制剂减轻对抗,从而防止返流。(4)体重过低,其它器官功能不成熟。(5)用药过程中出现严重并发症,如合并肺部感染、肺出血、动脉导管未闭,从而影响肺表面活性物质的作用。本文2例死于肺出血合并严重感染,因此,应用中应注意无菌操作,及时监测血气分析,调整呼吸机参数,减少并发症,更进一步提高肺表面活性物质的临床应用疗效。
致谢 本文得到本院周晓光医师的指导及信息科穆荔科长的帮助,在此表示感谢。
参考文献
1 许植之,陈自励.新生儿呼吸系统疾病学.北京:中国医药科技出版社,1993.326-341.
2 宋国维.肺表面活性物质在小儿呼吸系统疾病中的应用.中国实用儿科杂志,1994,5:267-268.
3 陈志敏,孙眉月.肺表面活性物质的临床应用进展.新生儿科杂志,1996,1:34-35.
4 刘传合,董声焕.肺表面活性物质临床治疗的现状.国外医学. 儿科学分册,1996,1:17-20.
5 陈树宝主编.儿科学新理论与新技术.上海科技教育出版社,1997.57.
收稿日期:1998-04-21;修回日期:1998-09-28 , http://www.100md.com