关键词:CIT;碘放射性同位素;同位素标记;药代动力学
【摘要】 目的 评价125 I-甲基-3β-(4-碘苯基)托烷-2β-羧酸甲基脂(β-CIT)在体内和脑内的结合特性。方法 应用过氧乙酸标记法和氯胺-T法进行125 I-β-CIT标记,并进行动物体内分布特性研究。结果 标记率分别为(53.4±7.9)%和(88.4±3.49)%。小鼠静脉注射125 I-β-CIT后,放射性主要浓聚在纹状体等脑区,其峰值摄取出现在药物注射后2h。GBR12909显著抑制纹状体内125 I-β-CIT的摄取,而clomipramine则显著抑制大脑皮层和海马内125 I-β-CIT的摄取。大鼠整体放射自显影表明,125 I-β-CIT主要通过肝胆途径代谢。结论 碘标β-CIT是一种良好的中枢多巴胺转运蛋白显像剂。
The Preparationof 125 I-β-CIT and its biological distribution in animal
SUN Wenshan, LIU Zhenguo,SHEN Minghua
(Ruijin Hospital of Shanghai Second Medical University, Shanghai 200025, China)
【Abstract】 Objective To prepare and label the 125 I-β-CIT andstudy its biological distribution in animal. Methods 125 I-β-CITwas prepared by the peracetic acid method and the chloramine-T method, and dopaminetransporter (DAT) binding properties of 125 I-β-CIT were examined by in vivobiodistribution and inhibition studies in mice and whole body autoradiography in rats. Results Theradiolabeling yields of the peracetic acid and the chloramine-T methods were (53.4±7.9)%and (88.4±3.49)%, respectively. Following intravenous injection in mice, 125 I-β-CITshowed high accumulation in striatum, time to peak level uptake was 2 h after injection.GBR12909 significantly inhibited 125 I-β-CIT binding in striatum, whileclomipramine significantly inhibited 125 I-β-CIT binding in hippocampus andcerebral cortex. The rat whole body autoradiography showed that the clearance of thetracer occurred through the hepatobiliary route. Conclusions Theresults indicate β-CIT is an agent suitable for DAT imaging and can be used for the studyof Parkinson's disease.
【Key words】 CIT; Iodine radioisotopes;Isotope labeling; Pharmacokinetics
多巴胺转运蛋白(DAT)在控制多巴胺(DA)能神经传递的过程中发挥着重要作用[1] 。Parkinsons病(PD)的严重程度与DA能神经终末DAT丧失相平行[2] ,因此,放射性标记的DAT显像剂可以进行PD的早期诊断。目前,可卡因类衍生物显像剂甲基-3β-(4-碘苯基)托烷-2β-羧酸甲基脂(β-CIT)已广泛用于PD等神经精神紊乱疾病的临床研究[3] 。我们参照Baldwin等[4] 的方法,分别用过氧乙酸法和氯胺-T法制备了125 I-β-CIT,并对标记物的体内分布与脑内结合特性进行评价,现报道如下。
材料和方法
一、 材料
标记前体trimethylstannyl-β-CT 50 μg,美国RBI公司产品;Na125 I溶液,购自Amesharm公司。
二 方法
1. 125 I-β-CIT的标记制备与鉴定。过氧乙酸标记方法参照文献[4],在含2μg标记前体的反应瓶内加入5 μL乙醇和50 μL 0.5 mol/L H3 PO4 ,投入适量的Na125 I,摇匀后注入新鲜配制的100μL 0.32%过氧乙酸,室温下反应15 min,加入100 μL NaHSO3 液(100 g/L)终止反应。氯胺-T法方法基本同上,氯化物用4g/L的氯胺-T 50 μL,加入50 μL Na2 S2 O3 终止反应。标记物采用萃取法进行纯化:反应液中加入1mL饱和NaHCO3 溶液,调pH值至中性或偏碱性,用1 mL无水乙醚萃取3次,合并有机相,过无水Na2 SO4 柱,N2 吹干,加入适量无水乙醇溶解备用。用薄层层析法和纸层析法测定放化纯度,支持物选用G254硅胶薄层板,展开体系为氯仿∶乙醇∶氨水=9∶1∶0.2。
将标记物与非标记β-CIT同时点于G254硅胶板层析后,用显色剂显色,并分段测定放射性,观察非标记β-CIT的斑点位置与标记物的放射性峰是否一致。然后将所得标记物溶于无水乙醇,加入适量1g/L的抗坏血酸溶液,置4 ℃冰箱保存,每日测定标记物的放化纯度,观察其稳定性。
2. 125 I-β-CIT小鼠体内与脑内分布实验。动物用昆明小鼠,雌性,体重18~22g,每组5只,尾静脉注射125 I-β-CIT 0.2 mL 74 kBq后,在5 min~12 h等不同时相将各组小鼠断头处死,迅速解剖脑、心等器官组织,脑进一步分离纹状体、大脑皮层、小脑、海马等脑区,称组织湿重后,用γ计数器测组织放射性,计算每克组织放射性占注射剂量的比值(%ID/g)。
3. 125 I-β-CIT小鼠脑内结合抑制研究。雌性昆明小鼠15只,体重18~22g,分为3组:生理盐水组、GBR12909组和clomipramine组。各组首先经尾静脉注射0.1mL生理盐水或相应药物(10 mg/kg ),注射5 min后,再向尾静脉内注射0.1 mL125 I-β-CIT 74 kBq,在注射125 I-β-CIT后2 h时将各组小鼠断头处死,迅速取出脑组织,分离纹状体、大脑皮层、小脑、海马等,称组织湿重后,γ计数器测组织放射性,计算组织%ID/g。
4. 大鼠整体放射自显影。向正常SD大鼠尾静脉内注射0.1 mL 125 I-β-CIT(3.7MBq)4 h后,迅速浸入-80 ℃丙酮与干冰的混合液中,然后用质量分数为8%的羧甲基纤维素制备的包埋剂包埋,-80℃冰箱中冷冻2 h,LKB-2250PMV大型推拉式冰冻切片机切片,切片厚度为40 μm,冰冻脱水干燥,用GS-250分子成像系统(核医学国家重点实验室提供)进行扫描,观察125 I-β-CIT在大鼠体内和脑内的放射性分布。
结 果
1. 125 I-β-CIT制备。过氧乙酸标记法和氯胺-T法的标记率分别为(53.4±7.9)%(n=7)和(88.4±3.49)%(n=6)。G254薄层层析与硅胶纸层析对游离125 I和125 I-β-CIT均有良好的分离度。2种标记方法的反应物经萃取纯化后放化纯度均>95%,125 I-β-CIT和非标记β-CIT在薄层层析板上Rf值均为0.7(游离I2 Rf=0.0),表明标记物是所期望的125 I-β-CIT。稳定性实验表明,125 I-β-CIT在无水乙醇中稳定性好,保存4周后,标记物的放化纯度仍大于90%。
2. 小鼠体内及脑内分布研究。125 I-β-CIT经尾静脉注入后,迅速进入脑组织,脑摄取高峰出现在注射后15min, 药物入脑量为注射剂量的16%左右,早期肺肾摄取较高,5 min内即达到高峰,然后迅速下降,肝脏于15min达到高峰,但清除缓慢(表1)。小鼠脑内分布研究表明:药物主要浓聚于纹状体,其次为海马和大脑皮层,小脑放射性最低。纹状体摄取高峰出现在注药后2h(图1),此时纹状体/小脑放射性比值-1(STA/CB-1)为2.2,随时间延长,STA/CB-1值逐渐增加,在6和12h分别达5.0和8.1。

图1 125 I-β-CIT小鼠脑区不同时相的放射性分布
表1 125 I-β-CIT小鼠体内分布(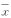
| 组织 | 时 间(min) | ||||||
| 5 | 15 | 30 | 60 | 120 | 360 | 720 | |
| 血 心 肺 脾 肾 肝 肌肉 脑 | 9.341±4.618 14.925±7.236 41.951±10.996 16.740±2.463 28.756±7.165 18.404±4.388 3.944±1.544 12.534±4.376 | 6.872±0.528 11.107±3.609 24.975±4.004 18.480±4.509 18.480±4.509 29.292±6.766 4.338±1.353 16.399±1.705 | 4.661±0.839 6.962±1.565 20.703±6.04 17.825±1.706 15.144±3.272 28.639±4.283 2.578±0.278 16.505±0.882 | 4.067±0.898 7.324±1.840 15.842±2.657 14.289±4.323 16.552±9.569 27.904±5.872 2.068±0.236 15.887±1.371 | 4.660±0.840 6.376±1.790 15.127±2.672 13.329±2.364 11.880±0.769 28.836±3.402 2.107±0.273 16.241±1.459 | 2.625±1.172 3.194±1.042 9.297±2.499 5.655±2.398 7.824±1.257 27.253±9.986 1.325±0.219 9.825±3.773 | 0.936±0.158 0.988±0.275 4.283±2.396 1.811±0.746 2.236±0.338 12.009±7.391 0.436±0.153 3.303±0.841 |

图2 GBR12909与clomipramine对125 I-β-CIT的脑内抑制作用
4.大鼠整体放射自显影。大鼠整体放射自显影可见放射性在脑、心、肺、肾、肝脏、胃肠等均有放射性分布,肝脏和肠道放射性浓聚较高,在脑内也有很高的放射性浓聚(图3)。

图3 125 I-β-CIT大鼠整体放射自显影
讨 论
一般认为,低浓度过氧乙酸作为氧化剂具有氧化作用温和、易于控制和反应副产物低等优点。过氧乙酸进行标记的标记率为53.4%,较文献值[4] 略低,可能与不同实验条件有关。氯胺-T法标记率优于过氧乙酸法,有易于获得、标记率高、重复性好、使用安全等优点。在进行标记物纯化时,我们用了简单萃取法,用乙醚替代乙酸乙酯,缩短了制备时间。本法制备的125 I-β-CIT放化纯度>95%,经薄层色谱鉴定无放射性杂质存在,且稳定性4周内保持在90%以上,表明该法能获得稳定的标记品。
125 I-β-CIT小鼠体内与脑内分布研究表明,125 I-β-CIT可迅速通过血脑屏障,在纹状体内有较高的浓聚,有很高的靶与非靶比值。GBR12909是一种选择性DA重吸收抑制剂,与DAT有较强的亲和能力。小鼠注射GBR12909后,纹状体内STA/CB-1值显著降低,表明125 I-β-CIT在纹状体内主要结合于DAT上;而大脑皮层和海马的放射性与小脑比值-1与生理盐水组差异无显著性,与该脑区DAT分布较少是一致的。Clomipramine为选择性的5-羟色胺转运蛋白(5-HTT)重吸收抑制剂,实验结果表明clomipramine不能抑制纹状体内的放射性,而明显抑制海马、大脑皮层的放射性。
125 I-β-CIT大鼠整体放射自显影结果表明,标记物在大鼠体内放射性分布特征与小鼠体内分布结果基本一致。放射性在大鼠脑内浓聚较高,提示标记物有较高的入脑量,肝脏、胃肠等也有较高放射性分布,表明标记物主要经消化道排泄。
作者单位:沈鸣华(上海医科大学药学院放射药学研究室)
钱隽(上海医科大学药学院放射药学研究室)
参 考 文 献
1,Thakur M, Defulvio J.Determination of reduced disulfide groups in monoclonal antibodies. Biotechniques, 1990,8:512.
2,Rosebrough S. Pharmacokinetics and biodistribution of radiolabeled avidin,streptavidin and biotin. Nucl Med Biol, 1993, 20:663-668.
(收稿日期:1999-07-26 ) , http://www.100md.com