关键词:心肌梗塞;钙通道;钙运作;钠/钙交换
摘要
目的:研究心肌梗塞细胞钙通道、钙运作及钠/钙交换功能变化。
方法:运用膜片钳全细胞记录法测细胞膜钙电流,荧光技术测细胞内钙浓度。
结果:心肌梗塞细胞钙离子密度明显下降(正常细胞:9.8±1.4 pA/pF,心肌梗塞细胞:3.7±0.6 pA/pF,P<0.01),肌浆网钙诱发钙释放功能下降,钙回落缓慢而钠/钙交换功能无变化。
结论:钙通道及钙运作功能异常可能与心肌梗塞后心力衰竭、心律失常的发生有关。
A Study on L-TypeCalcium Channel, Ca2+ Handling and Na+ /Ca2+
Exchange Function of Infarcted Myocardial Cells
Department of Clinical Electrophysiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037)
Pu Jielin, Boyden PA.
Abstract
Objective: Tostudy the calcium channel function, Ca2+ handling and Na+ /Ca2+ exchange in cells from myocardial infarction of canine model.
Methods:Patch-clamp technique whole cell recording configuration was used to record L-type calciumcurrent and fluorescent technique to monitor changes of intracellular Ca2+ concentration.
Results: Ca2+ currents density was significantly reduced in infarct cells compared to normal cells (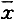
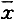
Conclusion: Theabnormalities of L-type calcium channel function and Ca2+ handling may beresponsible for the development of heart failure and arrhythmia after myocardialinfarction.
Key words Myocardial infarction;Calcium channel; Ca2+ handling; Na+ /Ca2+ exchange
心律失常和心力衰竭是心肌梗塞后的常见并发症。动物实验发现心律失常往往发生在心肌梗塞后1周左右,而且来源于心肌梗塞后心外膜存活的心肌细胞[1] 。近年来作者对这一模型进行了深入的研究,现报告有关钙通道及钙运作方面的结果。
1 材料和方法
心肌梗塞细胞来自狗结扎冠状动脉前降支5天左右的梗塞部位,正常狗同部位作对照。用酶学方法分离出单个细胞,详细方法见参考文献[2]。
钙电流测定采用经典全细胞记录法,采用Axon Clamp 200放大器(美国)。室温下(20~23℃)测钙电流,维持钳压-40mV,刺激脉冲250 ms,电压从-30 mV~+60 mV。设定的细胞内、外液组成如下(单位为mmol) 外液:CaCl2 5,氯化四乙胺(TEACl)140,MgCl2 0.5,葡萄糖10,羟乙基哌嗪乙磺酸(HEPES)10,4-Ap2,pH 7.3(CsOH滴定)。内液:氢氧化铯(CsOH)125,Aspartic酸125,TEACl 20,HEPES10,Mg-ATP 5,EGTA 10,pH 7.3(CsOH滴定)。测定钙运作和钠/钙交换采用PTI光电测定仪合用钳压术,维持电压-80mV,刺激脉冲1 s,从-70 mV~+80 mV。Fura-2作钙染料,激发细胞光波波长为340nM和380 nM,接收发散波长为520 nM。以340/380信号比值指示细胞内钙浓度。细胞内、外液组成如下(单位为mmol) 外液:NaCl135,CaCl2 2,CsCl 10,MgCl2 1,葡萄糖10,HEPES 10,当测钙运作时只加河豚毒素(TTX)30μmol以阻断钠电流,测钠/钙交换时再加异搏定10 μmol,Ryanodine 10 μmol及Thapsigargin5 μmol以进一步阻断钙电流、肌浆网钙的释放和重吸收。内液:CsCl135,MgCl2 2,HEPES 10,Fura-2 70 μmol,当测钠/钙交换时,另加NaCl 10mmol或20 mmol,pH 7.2(CsOH滴定)。测定肌浆网钙贮存总量时快速加10 mmol咖啡因。
统计学处理:数据用平均值±标准误表示,t检验比较差异。多组比较时,采用ANOVA(Sigma软件,美国)检测差异。
2 结果
L型钙通道:钙电流密度在正常细胞与心肌梗塞细胞分别为9.8±1.4 pA/pF(n=10)和3.7±0.6 pA/pF(n=8)。心肌梗塞细胞中钙电流密度明显下降(P<0.01)。电流密度的计算以高峰电流(以pA为单位)除以细胞膜电容(以pF为单位)表示。钙电流规迹衰退时间常数在正常和心肌梗塞细胞间无显著差异。钙电流稳态失活曲线中点电压值在正常和心肌梗塞细胞间分别为-16.0±1.3mV和-20.5±2.0 mV,心肌梗塞细胞中曲线左移。表示在同样电压下,钙通道的失活部分增加。心肌梗塞细胞钙电流恢复过程缓慢,时间常数在正常和心肌梗塞细胞间分别为T1 =57.3±4.8,T2 =797.0±24.5和T1 =80.0±16.7,T2 =1930.0±1.0(P<0.05)。
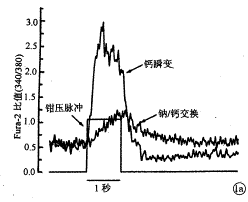
钙运作(Ca2+ handling):钙运作是研究钙离子引起肌浆网钙释放的过程,即钙离子通过钙通道进入细胞内,触发肌浆网钙的大量释放,然后钙又被肌浆网重吸收或通过钠/钙交换排出胞浆外。如图1a的钙瞬变(Ca2+ transient)曲线的上升支和下降支所示。图中Fura-2比值反映细胞内钙的浓度。从图1b正常细胞(左侧)和心肌梗塞细胞(右侧)钙瞬变曲线中可以看出:心肌梗塞细胞的Fura-2比值峰值降低,平均幅度(峰值-静息值)在正常细胞和心肌梗塞细胞分别为0.87±0.15(n=11)和0.47±0.12(n=9),P<0.05。而且曲线的衰退过程在心肌梗塞细胞明显变慢,其时间常数正常细胞为296±32ms,心肌梗塞细胞为427±39 ms(P<0.05)。
钠/钙交换:图1a钠/钙交换曲线所示为通过钠/钙逆交换运进到细胞内的钙浓度。此钠/钙交换可被镍(2 mmol)完全阻断(未显示)。本实验中细胞内钠控制在10 mmol或20 mmol,结果未发现心肌梗塞细胞中有异常。
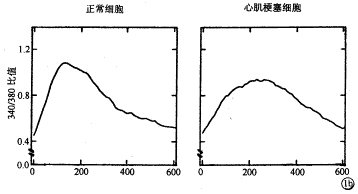
图1 钙瞬变及钠/钙交换 1a:钙瞬变曲线指示钳压条件下肌浆网钙诱发的钙释放和回落过程。钠/钙交换曲线为肌浆网阻断后,钙离子通过钠/钙交换进出细胞的过程。Fura-2比值指示钙浓度。1b:示典型正常细胞和心肌梗塞细胞钙瞬变曲线,可见心肌梗塞细胞钙释放峰值降低,回落过程缓慢
肌浆网钙总含量:快速注入咖啡因10 mmol来放空肌浆网的钙,并进行测定。如图2所示,经过6个钳压刺激诱发钙释放后,给予18秒左右的重吸收间歇,突然加入咖啡因,看到钙大量的释放。咖啡因诱发钙释放幅度在正常细胞为0.94±0.13(n=5),心肌梗塞细胞为0.48±0.03(n=4),P<0.05。表明心肌梗塞细胞肌浆网钙含量降低。而且由钳压刺激所诱发的钙释放占总肌浆网钙含量的比例也不同:正常细胞占80%,心肌梗塞细胞却占100%,即正常细胞有钙贮备而心肌梗塞细胞却没有。
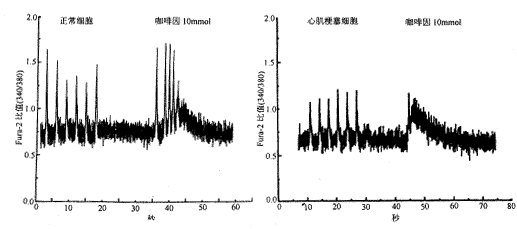
图2 咖啡因诱发钙贮量测定 图中示六个钳压刺激引起钙释放,加咖啡因后在正常细胞仍有更多的钙释放出来,表示有钙贮备。而心肌梗塞细胞却无钙贮备。咖啡因释放钙幅值在正常细胞较心肌梗塞细胞为大
3 讨论
心肌梗塞后存活下来的心肌细胞发生了一系列心电学方面的变化。如运作电位幅度下降、超射降低和运作电位时程缩短,形成了运作电位“三角形”化的特点。这些变化在心肌梗塞后1周左右开始显著,2周时达顶峰,2个月后恢复[1] 。随着心电学异常的出现,心脏容易被诱发出折返性室性心动过速[2] 。近来的研究已证实了钠通道、钾通道(It01 )、氯通道(It02 )和钙通道功能的降低[3~6] 。本实验又进一步发现了细胞内钙运作的异常。这些发现构成了心电学改变的离子通道学基础。
本实验中心肌梗塞细胞钙通道功能异常与先前报道一致[6] ,证明此组细胞有代表性。心肌梗塞细胞中钙诱发钙释放(钙瞬变)幅值下降可以部分用钙通道功能下降来解释。钙电流的减少不仅减小了刺激肌浆网钙释放的触发(trigger)作用,而且减少肌浆网钙的充盈,降低钙瞬变的幅值。钙通道刺激剂BayY 5959可以使钙瞬变幅值升高便是另一个佐证[7] 。然而,肌浆网钙释放及重吸收速率的减慢不能完全用钙通道功能下调来解释。况且本实验未发现有钠/钙交换功能异常,这一因素可以排除。其他原因包括肌浆网本身的钙释放通道异常,如数量的减少或功率的下降,可以影响钙释放的速率;肌浆网ATP酶活性降低或者细胞内ATP含量下降则可降低肌浆网钙泵的效率,延缓钙的重吸收。这方面工作仍待进一步研究。
肌浆网钙释放和重吸收功能下调至少有两个病理学意义。首先钙释放量减少可以影响心肌收缩力。没有足够的钙离子与肌钙蛋白结合,不能触发肌纤维收缩,可成为心肌梗塞后心力衰竭的原因之一。肌浆网钙重吸收速率减慢可在心搏较快时钙吸收不完全而使细胞内钙浓度升高(Ca2+ overload)。这不仅可以影响心肌细胞的舒张,而且钙积聚可以引起后除极,是形成心律失常触发机制的原因。
实验研究已经发现心肌梗塞细胞存在离子通道功能的异常,预防和消除这些异常将可成为治疗临床病症的目标。已有实验提示钙通道兴奋剂可以终止心肌梗塞后诱发的室性心动过速[8] 。这是一个令人振奋的消息。然而,研究心肌梗塞后细胞超微结构与功能的关系尚未展开,期待着我们去探索。
4 参考文献
1 Ursell PC, Gardner PI, Albala A, et al. Structural andelectrophysiological changes in the epicardial border zone of canine myocardial infarctsduring infarct healing. Circ Res, 1985,56:436—451.
2 Dillon S,Allessie MA, Ursell PC, et al. Influences of anisotropic tissue structure on reentrantcircuits in the epicardial border zone of subacute canine infarcts. Circ Res, 1988,63:182—206.
3 Pu J, Boyden PA.Alterations of Na+ currents in myocytes from epicardial border zone of theinfarcted heart: A possible ionic mechanism for reduced excitability andpostrepolarization refractoriness. Circ Res, 1997,81:110—119.
4 Lue WM, BoydenPA. Abnormal electrical properties of myocytes from chronically infarcted canine heart.Circulation, 1992,85:1175—1188.
5 Aggarwal R, PuJ, Boyden PA. Ca2+ -dependent outward currents in myocytes dispersed from theepicardial border zone of the 5-day infarcted canine heart. Am J Physiol, 1997,273:H1386—1394.
6 Aggarwal R,Boyden PA. Diminished Ca2+ and Ba2+ currents in myocytes survivingin the epicardial border zone of the 5-day infarcted canine heart. Circ Res, 1995,77:1180—1191.
7 Pu J, Ruffy F,Boyden PA. Effects of Bay Y 5959 on Ca2+ currents and intracellular Ca2+ in cellls that have survived in the epicardial border of the infarcted canine heart. JCardiovasc Pharma, 1999,33:929—937.
8 Cabo C, SchmittH, Coromilas J, et al. A new mechanism of antiarrhythmic drug action: increasing inward Ltype calcium current can stop reentrant ventricular tachycardia in the infarcted canineheart. Circulation, 1997,96:I745.
(收稿:1999-07-30) , http://www.100md.com