关键词:经皮腔内血管成形术;切割球囊;血管内超声
摘 要 目的:通过血管内超声(IVUS)对比研究单纯球囊血管成形术(POBA)与切割球囊血管成形术(CBA)的不同作用机制。方法:随机分配病例进入POBA与CBA组。介入过程在造影指导下完成,球囊扩张前后均进行IVUS检查。对比造影及IVUS下术前术后斑块部位质与量的变化。及临近参考血管的改变。结果:37例,共39处病变,23处进入CBA组,16处进入POBA组。造影下CBA组较POBA组弹性回缩及弹性回缩率小分别为(0.18±0.08)mmvs(0.61±0.32)mm,P<0.001;(7.59±2.68)% vs (22.02±12.88)%,P<0.001。IVUS下术前术后血管面积的增大,POBA组大于CBA组(1.30±0.66)mm2 vs(0.49±0.38)mm2 ,P<0.01;斑块面积缩小CBA组大于POBA组,(2.03±1.23)mm2 vs(1.49±1.00)mm2 ,P<0.01;夹层发生率CBA组小于POBA组,26.1% vs50%,P=0.033。结论:切割球囊与普通球囊比较两者可获得相似的即刻管腔扩大程度。POBA使管腔扩大的主要机制是血管的被动扩张(占50%左右);相反CBA的主要机制是斑块的压缩。CBA对血管的损伤小于POBA,推测CBA发生再狭窄率较POBA低。
Comparison of Cutting BalloonAngioplasty and Conventional Balloon Angioplasty:An Intravascular Ultrasound Study
Xu Hongyu,Chen Shaoliang,DuanBaoxiang,et al
(Dept.Cardiology,Nanjing First Affiliatited Hospital,Nanjing Medical University China 210006)
ABSTRACT Objective:This intravascularultrasound study demonstrated the different mechanisms of acute lumen enlargement betweencutting balloon angioplasty(CBA)and plain old balloon angioplasty(POBA).Methods:Thirtyseven patients with angina pectoris and 39 lesions were enrolled in this study,matched 23lesions in CBA group with 16 lesions in POBA group randomizedly.The procedure was guidedby the angiography,and IVUS was performed before and immediately after balloondilatation.Difference between pre-and post-procedure of the target vessel and referencevessel was recorded with angiography and IVUS.Results:Acute recoil and acute recoil ratewere significantly different in CBA and POBA group (0.18±0.08)mm vs.(0.61±0.32)mm,P<0.001;(7.59%±2.68%)vs.(22.02%±12.88%),P<0.001,respectively.Comparison of EEM-A,PA and PB betweenpre-and post-procedure was significantly different in CBA and POBA group (0.49±0.38)mm2 vs(1.30±0.66)mm2 ,P<0.01;(2.03±1.23)mm2 vs.(1.49±1.00)mm2 ,P<0.01;(19.05%±6.00%)vs.(48.19%±12.25%),P<0.001,respectively.Dissections were present in 6 patients inCBA group (26.1%)and 8 in POBA group(50%) with p value of 0.033.Conclusions:CBA and POBAhave the different mechanisms of acute lumen enlargement,with increasing of vesselarea(vessel expansion rate,more than 50%)in POBA group,and plaque compression in CBAgroup(>80%).The lesser vessel injury for CBA might be acquitted lower restenosis rate.
KEY WORDS Percutaneous transluminal coronary angioplasty Cuttingballoon angioplasty Intravascular ultrasound
经皮腔内冠脉成形术(PTCA)已广泛运用于临床冠心病的治疗,且是运用最广泛而有效的血运重建术,但再狭窄一直是PTCA存在的主要问题。由于球囊扩张引起不同程度的血管壁损伤使单纯球囊扩张成形术(POBA)后的再狭窄率>30%。Barath等〔1〕 设计的切割球囊(CuttingBalloon)将微切割与球囊扩张机制相结合,减轻血管壁的损伤,达到降低再狭窄的目的。
血管造影对病变的定性评价是公认的“金标准”。然而造影存在其固有的局限性——仅能够对血管腔作出描述;不能观察和判断血管内膜下的组织特征;病变部位狭窄程度的测定是通过病变部位与参考血管比较获得的间接信息。血管内超声(IVUS)在确定斑块和血管壁内的结构方面比造影具有肯定的优越性。通过测量IVUS下术前与术后的管腔面积与斑块面积的改变,提供了分析即刻管腔扩大的机制的机会。
资料与方法
选择1999年7月~2000年1月所有接受择期介入治疗的稳定型与不稳定型心绞痛患者37例,随机分配入CBA与POBA两组。两组患者除了血脂水平外,在年龄、性别、易患因素、病变部位、病变分级上均无差异(表1)。介入过程均在造影指导下完成。成形术术前术后均用3.2F、30MHz超声导管接受IVUS检查,超声仪采用CVISINSIGHT Ⅲ。采用单次球囊扩张方法,扩张成功的标志为残余狭窄<50%,前向血流TIMI3级。
表1 研究对象的临床及造影资料
| 项 目 | CBA(n=21) | POBA(n=16) | |
| 性别(M/F) 年龄(岁) 稳定/不稳定心绞痛 高血压 糖尿病 吸烟 高血脂 病变部位 LAD LCX RCA 病变类型 A型 B1型 B2型 | 17/4 59.57±11.09 8/13 11/21(52.4%) 3/21(14.3%) 10/21(47.6%) 16/21(76.2%) 18/23(78.3%) 1/23(4.3%) 4/23(17.4%) 8/23(34.8%) 13/23(56.5%) 2/23(8.7%) | 14/2 59.94±10.91 5/11 7/16(43.75%) 4/16(25%) 7/16(43.75%) 6/16(37.%)* 14/16(87.5%) 0/16(0%) 2/16(12.5%) 5/16(31.25%) 10/16(62.5%) 1/16(6.25%) | |
造影下的定性指标包括:偏心、钙化、球囊扩张后是否发生夹层;定量指标包括:术前术后病变部位最小管径(MLD)、临近参考血管平均直径、直径狭窄度。其它指标包括:即刻获得管径(AcuteLumen Gain,ALG)=术后病变部位最小管径-术前病变部位最小管径;即刻弹性回缩(Acute Recoil,AR)=球囊扩张时的最小直径-术后即刻MLD;即刻弹性回缩率(AcuteRecoil Rate,ARA)=即刻弹性回缩/球囊最小直径。IVUS下的定性指标包括:病变偏心性(定义偏心指数<0.5)、钙化、性质以及球囊扩张后是否发生夹层。定量指标包括:术前术后病变部位及临近参考血管的管腔面积(LA)、血管面积(EEM-A)、斑块面积(PA=EEM-A-LA)、斑块负荷(PB=PA/EEM-A×100%)、最小直径(MLD)。计算病变部位的ΔLA、ΔEEM-A、ΔPA、ΔPB、两端参考部位ΔPB之和以及ΔEEM-A/ΔLA×100%。
记录随访期间发生的心脏事件、是否需要再介入及冠状动脉搭桥术治疗。统计学方法采用成组t检验,检验水准为0.05,数据以
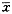 ±s表示。
±s表示。 结 果
37例患者,共观察了39处病变,其中23处进入CBA组(包括一处支架后再狭窄病例),16处进入POBA组。球囊扩张前CBA与POBA两组在造影下定量指标、钙化检出率无差别,而偏心检出率CBA组较POBA组大(26.09%vs.6.25%,P<0.05);IVUS下两组定性指标无差别、病变部位及两端参考血管部位的定量指标也无差别(表2)。两组的成功率均为100%。
表2 球囊扩张前造影与IVUS下斑块特点
| 检查方法 | 斑块特点 | CBA | POBA |
| 造影 | 病变偏心 病变钙化 MLD(mm) 平均参考血管直径(mm) 直径狭窄(%) | 6/23(26.09%) 2/23(8.70%) 1.33±0.30 2.95±0.47 54.46±9.33 | 1/16(6.25%) 0/16(0%) 1.36±0.58 3.31±0.45 58.67±15.44 |
| IVUS | 病变组成 软斑块(个) 硬/混合斑块(个) 钙化灶(个) 偏心(个) 参考血管LA(mm2 ) EEM-A(mm2 ) PA(mm2 ) PB(%) 病变LA(mm2 ) EEM-A(mm2 ) PA(mm2 ) PB(%) 最小管径(mm) | 9 14 6 11 8.59±3.51 14.29±5.15 5.73±2.16 39.77±8.67 3.51±2.42 14.58±5.02 10.81±3.87 74.49±10.27 1.72±0.42 | 5 11 5 9 7.73±1.80 13.31±3.90 5.59±2.35 40.69±7.62 3.21±1.36 14.16±5.13 10.95±4.43 76.50±6.73 1.85±0.43 |
球囊扩张后,造影下CBA与POBA两组的最小管腔径(MLD)相似,残余直径狭窄度分别为22.45%±10.16%与29.12%±13.29%,P=NS,直径狭窄度改变、ALG也相似。而AR及ARR,CBA组与POBA组存在显著差异,分别为(0.18±0.08)mmvs.(0.61±0.32)mm,P<0.001;7.59%±2.68% vs.22.02%±12.88%,P<0.001。造影下夹层的发生率在CBA组为2/23(8.70%),POBA组为4/16(25%),P=0.21。(图1)。
IVUS下CBA组与POBA组ΔLA分别为(2.52±1.53)mm2 及(2.79±1.51)mm2 ,P=NS;ΔEEM-A(0.49±0.38) mm2 vs(1.30±0.66) mm2 ,P<0.01;ΔPA (2.03±1.23)mm2 vs(1.49±1.00) mm2 ,P<0.01;ΔEEM-A/ΔLA×100% 19.05%±6.00% vs.48.19%±12.25%,P<0.001;病变两侧参考血管的斑块负荷在术前术后差值(ΔPB)之和两组分别增加了4.27%±2.40%与15.57%±7.00%,P<0.001。POBA组共有11例检出存在代偿性扩张(68.75%),无或负向收缩病例5例(31.25%)。两亚组球囊扩张后ΔLA、ΔEEM-A无统计学差异,而ΔPA(1.65±1.00) mm2 vs.(0.96±0.82) mm2 ,P<0.01;ΔEEM-A/ΔLA×100%44.30%±10.10% vs.56.59%±12.04%,P<0.001。球囊扩张后发生夹层率在CBA组较POBA组低,CBA组6/23(26.1%),POBA组8/16(50%),P=0.033(图2)。
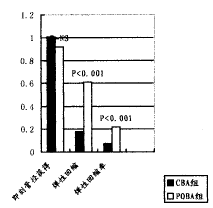
图1 造影下CBA与POBA的即刻对比

图2 IVUS下球囊扩张即刻效果的对比
平均随访时间为(6.32±2.16)个月。随访期间两者均无严重心脏事件(心肌梗死、猝死、急诊介入与搭桥术)发生,CBA组有3/21例发生心绞痛(占14.29%),POBA组4/16例发生心绞痛(占25%),P=0.45。虽然无统计学意义,但具有CBA较POBA再次心绞痛发生率低的趋势。
讨 论
自从PTCA运用临床治疗冠心病以来,有关其机制存在多种假说。最初心脏病学家认为粥样斑块的压缩与再分布是PTCA后管腔扩大的主要机制〔2〕 ,而组织学研究表明血管壁破裂与被动扩张〔3〕 才是PTCA的主要机制。PTCA机制的研究很长一段时间内只局限于动物模型或是尸检所得病理标本〔4〕 。可是,这些动物模型上的粥样斑块的特性与人类的斑块之间差异甚大,即使是尸检所得病理标本切片也不能全面反映PTCA术后病变的改变。IVUS是唯一可以实现体内研究斑块性质与组成的方法。该方法较造影可更准确的分析出血管壁破裂〔4〕 ,并且可以准确地测定介入前后的管腔与斑块面积的改变。正是由于这些特性,使IVUS成为研究PTCA机制的主要手段。最近的IVUS研究表明,PTCA后大部分病变部位发生了血管壁的破裂,以及PTCA后管腔扩大的主要机制是血管壁的被动扩张〔5、6〕 。
1989年Barath等〔1〕 发明了一种特殊的球囊,即切割球囊,其指导思想为将微切割机制与球囊扩张机制相结合,在球囊扩张血管壁前切割球囊上的刀片预先沿血管纵轴方向辐射状切开斑块纤维帽、弹力纤维和平滑肌,形成一个扩开的几何模型,从而使球囊成形时球囊的扩张压力降低,减少螺旋型撕裂的发生,降低血管的弹性回缩程度,从而减少单纯球囊扩张所致的血管损伤,降低再狭窄率。Barath将切割球囊运用于猪外周动脉,经切割球囊扩张后的扩张段血管损伤仅局限于切割区域,14天后的组织修复(平滑肌增生)也局限于切割部位,未切割区几无变化,球囊扩张后1小时切割球囊扩张的血管径大于基础血管径的9%,而普通球囊成形术后同样程度扩张的血管段完全弹性回缩,甚至小于原来水平的5%。从组织学上证明了切割球囊对血管壁的损伤小于普通球囊。九十年代中期,IVUS研究通过对比切割球囊与普通球囊扩张后管腔后斑块面积的改变的不同,指出切割球囊使管腔扩大的主要机制不再是血管壁的被动扩张,而是斑块的压缩〔7、8〕 ,提示CBA使管腔扩大的同时,较POBA减少了对血管中层与外膜的损伤。Suzukiet al〔9〕 用IVUS随访发现CBA组较POBA组内膜增生轻。进一步证实了切割球囊较普通球囊的更具微创伤性。最近有学者〔10〕 从分子生物学角度上论证了切割球囊的血管损伤明显小于POBA。
本研究结论表明,造影下切割球囊(CB)与普通球囊(POB)有相似的即刻管径获得(ALG),扩张效果相似;而球囊的弹性回缩(AR)及弹性回缩率(ARR)两者有显著的差异,CB较POB明显小,提示前者使血管扩张的程度较后者小,从而证明CB对血管的损伤小于POB。IVUS下球囊扩张后管腔面积的增加两组无差别;而整个血管截面积(EEM-A)的增加CBA组小于POBA组,斑块压缩的程度CBA组大于POBA组,ΔEEM-A/ΔLA在CBA组明显小于POBA组。该结果提示CB使管腔扩大的机制主要是斑块的压缩,而血管的被动扩张只占管腔扩大的19%左右。相反,POB使管腔扩大的机制有48%左右是血管被动扩张实现的,提示两球囊在病变部位实现血运重建的机制有显著的差异。从IVUS下球囊扩张后的夹层发生率来看,CBA组发生率为26.1%,POBA的发生率为50%,提示夹层是POBA获得管腔扩大的主要机制之一,而在CBA组则非主要因素。另外,球囊扩张后对病变两端参考血管的影响在两组间也存在着差异。CBA组参考血管斑块负荷的改变明显小于POBA组,提示在POBA组病变部位扩张后存在显著的斑块移位,提示POBA的另一机制是球囊扩张后斑块的重新分布,而CBA组这一机制产生的作用很小。可能斑块移位或向病变两端重分布是造成POBA术后再狭窄重于CBA的主要机制之一。
本研究从四个方面论证了CBA对血管的损伤小于POBA。其一:造影下CBA组血管的弹性回缩与弹性回缩率较POBA组明显小;其二:IVUS下CBA组整个血管面积的扩大小于POBA;其三:IVUS下斑块压缩程度CBA组大于POBA组;其四:发生夹层率CBA组小于POBA组。推测由于CBA对血管损伤小于POBA,因而再狭窄率低于POBA。随访期间CBA具有发生心绞痛的比例小于POBA的趋势,这一结果论证了上述推测。日本、欧洲等运用CB较多与较早的国家已从循证医学的角度,运用大规模多中心的随机试验论证了单纯CBA术后发生再狭窄率或靶病变再介入治疗率低于POBA。
本课题获得江苏省科委科研基金资助
参考文献
1,Barath P,Fishbein MC,Vari S,etal.Cutting balloon:A novel approach to pervcutaneous angioplasty.Am J Cardiol,1991,68:1249~1252.
2,Gruentzig AR Transluminal dilatation of coronary artery stenosis.Lancet,1978,1:263~267.
3,Farb A,Virmani R,Atkinson JB et al.Plaque morphology and pathologic changes inarteries from patients dying after coronary balloon angioplasty.J Am CollCardiol,1990,16:1421~1429.
4,Virmani R,Farb A,Burke AP. Coronary angioplasty from the perspective ofatherosclerotic plaque:Morphologic predictors of immediate success and restenosis.Am HeartJ,1994,127:163~179.
5,Nakamura S,Mahon DJ,Maheswaran B,et al.An explanation for discrepancy betweenangiographic and intravascular ultrasound measurements after percutaneous transluminalcoronary angioplasty.J Am Coll Cardiol,1995,25:633~639.
6,Di Mario C,Gil R,Camenzind E,et al.Quantitative assessment with intracoronaryultrasound of the mechanisms of resenosis after percutaneous transluminal coronaryangioplasty and directional coronary atherectomy.Am J Cardiol,1995;75:772~777.
7,Tsuchikane E,Funamoto M,Sumitsuji S,et al.Mechanism of lumen enlargement and chronicvessel response after cutting balloon angioplasty assessed by serial ultrasoundstudy.(abstract)J Invas Cardiol,1996,8:73.
8,Goicolea J,Martinez D,Alfonso F,et al.Intravascular ultrasound findings after cuttingballoon angioplasty.(abstract)Circulation,1996,94:635.
9,Suzuki T,Suzuki T,Hosokawa H et al.Comparison of the restenosis mechanism of cuttingballoon angioplasty and plain old balloon angioplasty:A series intravascular ultrasoundstudy.(abstract)J Am Coll Cradiol,1998,31:498A.
10,Teruo Inoue,Yoshihiko S,Kazuhiro H,et al.Lower expression of neutrophil adhesionmolecule indicates less vessel wall injury and might explain lower restenosis rate aftercutting balloon angioplasty.Circulation,1998,97:2511~2518.
收稿日期:2000-05-29
171天刊出 , http://www.100md.com