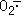 |
关键词:
近年研究表明,在临床及实验性胰腺炎中均伴有程序性细胞死亡(programmedcell death, PCD),且与疾病的发生、发展及愈后有重要关系,因此对PCD的深入了解,有助于临床有效、合理地治疗胰腺炎。
1 PCD在胰腺炎中的表现
用末端脱氧核苷酸转移酶介导的duTP生物素缺口末端标记(TUNEL)法,可在慢性胰腺炎患者的胰液中检测出典型的PCD细胞〔1〕 ;胰管结扎、注射蛙皮素、无胆碱乙硫胺酸(CDE)饮食,酒精及高脂饮食所诱发胰腺炎动物模型的不同阶段均可见PCD〔2,3〕 ,胰腺腺泡细胞对PCD敏感,在胰管阻塞、胰腺短暂缺血及功能紊乱时,只有胰腺腺泡细胞发生PCD,而胰管细胞反而增生〔4〕 。不同种属动物的胰腺对PCD的敏感程度亦不同。用同样方法结扎大鼠和负鼠的胰管诱发急性胰腺炎,胰腺组织中细胞坏死和PCD并存,但是PCD和细胞坏死的比率却明显不同,大鼠以持续PCD为主,而负鼠则以组织坏死为主〔5〕 。众多动物胰腺炎模型均表明,胰腺炎的严重程度和PCD的发展程度成反比,即重型胰腺炎坏死明显而PCD轻微;轻型胰腺炎则以PCD为主〔2〕 。
2 PCD在胰腺炎病程中的发生机理
2.1 基因在PCD中的作用
bcl-2族的一些基因: bcl-xL、mcl-1、AI、Nr13、ced-9、BHRF-1对PCD有抑制作用;而另一些基因: Bax、bcl-xs、BaK、BiK、Bad对PCD则有促进作用〔6〕 。亦有实验证实bcl-2与Bax的比值(bcl-2/Bax)决定细胞的存活〔7〕 。Bag-1(bcl-2-associated anthanogene)基因能增强bcl-2基因的表达,并协同bcl-2的表达产物抗PCD,其机理不详。胰腺腺泡细胞不含bcl-2基因,胰管细胞含有bcl-2基因,且在胰腺炎时过分表达〔4〕 ,故胰腺腺泡细胞易死于PCD,而胰管细胞则增生。
p53基因定位于第17对染色体上(17q13),野生型p53是抑癌基因,该基因在细胞对DNA损伤的反应中起重要作用。当DNA损伤时,p53基因促使细胞生长停止及发生PCD〔8〕 。胰腺炎时炎症及氧自由基均造成DNA损伤,从而诱导p53基因过分表达,促使细胞发生PCD〔9〕 。
2.2 氧自由基对PCD的影响
胰腺炎病程中,因黄嘌呤氧化酶作用于次黄嘌呤以及通过吞噬细胞的呼吸爆发途径、磷脂-花生四烯酸途径和线粒体及微粒体途径产生大量氧自由基(oxygenfree radical, OFR)。OFR是胰腺炎病因之一,并影响其病程发展及愈后〔10〕 。OFR清除剂和黄嘌呤氧化酶抑制剂能明显减轻胰腺炎的病变程度及减少细胞死亡。甲萘醌(维生素K3 )能通过氧化还原反应链增加超氧阴离子(),Sata等〔9〕 人用甲萘醌作用于胰腺细胞系AR42J,结果诱发DNA裂解及PCD。目前认为OFR是PCD的激活因子或参与了PCD的信号传递。
2.3 ICE类半胱氨酸蛋白酶在PCD中的作用
白细胞介素β转换酶类(interleukin-1 β-converting enzyme-like, ICE-like)半胱氨酸蛋白酶参与了PCD的发生。该酶主要分解细胞核的基底蛋白,基底蛋白破碎是PCD的早期改变〔11〕 。在体外阻止ICE类半胱氨酸蛋白酶,可在一定程度上阻止PCD,表明尚有其它因素参与了PCD的发生。现已发现一组编码ICE类半胱氨酸蛋白酶的基因:nedd-2/ich-1、TX/ich-2/ICErel-Ⅱ、ICErel-Ⅲ、CPP32。由于ICE族基因表达过剩,所以缺少其中一种,并不能对PCD产生明显影响;bcl-2对ICE半胱氨酸蛋白酶有抑制作用。
2.4 血液及细胞中活性物质在PCD中的作用
肿瘤坏死因子(TNF)是胰腺炎病程中造成PCD及胰腺细胞损伤的重要中介物质,用特异性抗体中和TNF后,能在一定程度上阻止PCD及减轻细胞损伤。肿瘤坏死因子FasL(Fas的配位体)、TNFα分别与肿瘤坏死因子受体Fas、TNFR1结合后,会导致受体所在细胞的PCD〔12〕 。Fas、TNFR1含有的特定区域称“死区”(deathdomain),与PCD的激活及信号传递有关。还有一些细胞表面蛋白含有死区,如FADD、MORT-1、TRADD、RIP、FAF-1,这些蛋白的死区与Fas、TNFR1的死区相互作用,共同诱导PCD的发生,其详细生化过程尚不清楚。胰腺炎的原始损伤,坏死或PCD均可导致细胞因子的表达,进而促使中性粒细胞的激活及浸润。实验表明,在胰腺炎病程中,血小板活化因子(PAF)能直接诱导PCD,并能趋化中性粒细胞;中性粒细胞则能促使胰腺细胞由PCD向坏死发展〔13〕 。内源性糖皮质激素能维持胰腺腺泡细胞的存活,防止其发生PCD。另有实验表明,除去内源性糖皮质激素后,胰腺腺泡细胞PCD增加6倍〔14〕 。另外,PCD时胰腺腺泡细胞染色质的分解,是依靠激活一种Ca2+ 、Mg2+ 依赖性核酸内切酶来完成的,因此该酶的含量及活性亦影响PCD的程度。
2.5 其它
在胰腺炎病程中还有一些机理参与了PCD,其原理目前不明。胰腺凋亡细胞中SGP-2(sulfatedglycoprotein-2)基因的信息RNA表达,该基因常与PCD的发生有关;急性胰腺炎后,凋亡的腺泡细胞中出现β-转移生长因子(transforminggrowth factor β),在非凋亡细胞中不出现〔15〕 ;胰腺炎模型中可见细胞结构微管蛋白错乱,可能是PCD的早期改变。上述现象有待进一步研究。
3 展望
随着对胰腺炎中PCD研究的不断深入,一致认为PCD与细胞坏死在胰腺炎中同时存在。PCD的相对含量与胰腺炎的严重程度呈反比。Kaiser等〔2〕 和Bhatia等〔16〕 用5种不同的动物胰腺炎模型证实,胰腺损伤特别是急性胰腺炎,PCD相对增多对胰腺腺泡细胞是有利的,坏死相对增多是不利的。尽管动物实验存在种属敏感性的差异,但是使我们对胰腺炎的发病、病程进展及转归有了更深刻的认识,为寻找新的治疗方法开辟了途径。多种基因参与了PCD过程,也为转基因治疗提供了可能。总之,进一步深入研究胰腺炎病程中的PCD,将对更合理、更有效地治疗胰腺炎具有积极意义。
参考文献
1 Maacke H, Kessler A, Schmiegel W. Overexpression ofp53 protein during pancreatitis. Br J Cancer, 1997; 75(10)∶1501
2 Kaiser AM, Saluja AK, Sengupta A, et al. Relationship between severity, necrosisand apoptosis in five models of experimental acute pancreatitis. Am J Physiology, 1995;269(5ptl)∶c1295
3 Thatte U, Dahanukar S. Apoptosis: clinical relevance and pharmacologicalmanipulation. Drugs, 1997; 54(4)∶511
4 Wada M, Hosotani R, Doi R, et al. Involvement of bcl-2 and PCNA in the preventionof ductal cell apoptosis after rat pancreatic duct ligation. Digestion, 1996; 57(4)∶275
5 Gukovskaya AS, Perkins P, Zaninovic V, et al. Mechanisms of cell death afterpancreatic duct abstruction in the opossum and the rat. Gastroenterology, 1996; 110(3)∶875
6 Reed JC. Mechanisms of bcl-2 family protein function and dysfunction in health anddisease. Behring Institute Mitteilungen, 1996; Oct(97)∶72
7 Yin XM, Oltvai ZN. Korsmeyer SJ. BH1 and BH2 domains of bcl-2 are required forinhibitin of apoptosis and heterodimerization with Bax. Nature, 1994; 369(6478)∶321
8 Ambs S, Hussain SP, Harris CC. Interactive effects of nitric oxide and the p53tumor suppressor gene in carcinogenesis and tumor progression. FASEB J, 1997; 11(6)∶443
9 Sata N, Klonowski H, Han B, et al. Menadione, supraphysiological concentrations ofcaerulein induce apoptosis in the rat pancreatic acinar cell line AR42J potentially viawild type p53. Gastroenterology, 1996; 110(4)∶428
10 Furukawa M. Role of oxygen-derived free radicals in acute necrotizing pancreatitisinduced by stress and cerulein in rats. Pancreas, 1994; 9(1)∶67
11 Ncamati N, Femandez A, Wright S, et al. Degradation of laminin B1 precedesoligonucleosomal DNA fragmentation in apoptotic thymocytes isolated thymocyte nuclei. J Immunol, 1994; 154(12)∶1693
12 Nagata S, Golstein P. The Fas death factor. Science, 1995; 267(5203)∶1449
13 Sandoval D, Gukovskaya A, Reavey P, et al. The role of neutrophkils andplatelet-activating factor in mediating experimental pancreatitis. Gastroenterology, 1996;111(4)∶1081
14 Kimura K, Sasano H, Shimosegawa T, et al. Selective induction of pancreatic acinarcell apoptosis by depletion of endogenous glucocerticoids. Gastroenterology, 1996; 110(2)∶405
15 Matsuzaki S, Ito M, Onizuka S. Correlation between transforming growth factor-βexpression and apoptosis in the rat pancreas during regeneration from caerulein-induced pancreatitis. Digestion, 1996; 57(8)∶245
16 Bhatia M, Wallig MA, Hofbauer B, et al. Induction of apoptosis in pancreaticacinar cell reduces the severity of acute pancreatitis. Biochem Biophys Res Commun, 1998;246(2)∶476
(1998-07-16收稿,1999-04-13修回)
, http://www.100md.com