胸腔积液中脱落细胞p53基因突变的检测及其意义
http://www.100md.com
万雨明. 曹美菊.
p53基因.抑癌基因.胸腔积液.聚合酶链反应-单链构象多态性.
参见附件(207kb)。
作者:万雨明曹美菊
单位:万雨明(湖北省十堰市东风公司芽箭医院 442012);曹美菊(西安交通大学第一医院呼吸内科,西安 710061)
关键词:p53基因;抑癌基因;胸腔积液;聚合酶链反应-单链构象多态性
西安医科大学学报000309摘 要:目的 探讨聚合酶链反应-单链构象多态性分析(PCR-SSCP)检测胸液脱落细胞p53基因突变在恶性胸腔积液(MPE)诊断中的可行性及价值。方法 用PCR-SSCP分别检测了19例MPE及12例结核性胸腔积液中新鲜脱落细胞标本的抑癌基因—p53基因5~8外显子的突变情况,并与正常胸膜组织进行对照。结果 7例MPE有p53基因突变,突变率为36.84%。其中5例发生在第5外显子,2例发生在第7外显子,第6、8外显子未检出突变,有2例突变检出早于临床病理诊断。结核性胸液无1例突变。结论 提示p53基因突变在MPE脱落细胞中较常见;PCR-SSCP分析胸液脱落细胞中p53基因突变可以作为MPE的一种辅助诊断方法。
中图分类号:R374.3 文献标识码:A
文章编号:0258-0659(2000)03-0220-03
Detection of p53 gene mutations and its clinical
implications in the cells from pleural effusion
Wan Yuming,Cao Meiju
(Department of Respiratory Internal Medicine, First Hospital,Xi′an Jiaotong University, Xi′an 710061,China)
ABSTRACT:Objective To explore the diagnostic value of detecting mutations of p53 gene in the cells from pleural effusion for malignant pleural effusion(MPE) by polymerase chain reaction-single strand conformation polymor-phism analysis (PCR-SSCP)technique.Methods The exons 5 through 8 of p53 tumor suppressor gene of cells from 19 MPE and 12 tuberculous pleural effusion by PCR-SSCP were examined.Results It was found that p53 gene mutations in 7 cases of MPE and 0 case of tuberculous pleural effusion.There were 5 cases in exon 5 and 2 cases in exon 7.No mutation was detected in exon 6 and exon 8.In the same sample, no genetic change in two or more exons was found.Conclusion The results indicate that p53 gene mutation is frequent in cells from MPE and detecting mutations of p53 gene in the cells from pleural effusion by PCR-SSCP is a valuable diagnostic method for MPE.
KEY WORDS: p53 gene;tumor suppressor gene;pleural effusion;PCR-SSCP
恶性胸腔积液(Malignant pleural effusion, MPE)是恶性肿瘤常见的临床征象,临床上往往难与良性胸腔积液相鉴别。近年来,人们试图通过检测基因突变及其产物对肿瘤进行早期诊断[1]。抑癌基因—p53基因的突变是人类肿瘤中最常见的基因变化,其突变主要集中在第5~8外显子[2]。检测p53基因突变及其表达产物用于肿瘤诊断国内外均有报道[1,3],但用于MPE诊断则鲜有报道。本研究采用PCR-SSCP方法对19例恶性胸腔积液及12例结核性胸液中脱落细胞进行了p53基因第5~8外显子分析,以探讨PCR-SSCP方法检测胸液脱落细胞p53基因突变在MPE诊断中的价值。
1 材料和方法
1.1 材料
1.1.1 标本 19例MPE(恶性组)及12例结核性胸腔积液(良性组)病例均为1997年9月~1998年5月本院呼吸内科住院病人。恶性组(男6,女13,年龄32~78岁,平均53岁)均经病理学证实,其中肺腺癌14例,鳞癌2例,小细胞癌3例。良性组(男7,女5,年龄20~70岁,平均40岁)均经临床和病理学证实。所有患者取胸液前均未确诊,且未经抗癌或抗结核治疗。正常对照为胸外伤手术所取正常胸膜组织。空白对照为双蒸水。
1.1.2 主要仪器及试剂 9801-D型PCR扩增仪,西安交通大学开元公司。TGL-16C型高速台式离心机,上海安亭科学仪器厂。DY-3C型电泳仪,江苏兴化分析仪器厂。
p53基因5~8外显子PCR扩增引物(上海复星科技公司)序列如下:
外显子5(可扩增181bp)
5′-TACTCCCCTGCCCTCAACAAGA-3′
5′-CATGAGCGCTGCTCAGATAGCG-3′
外显子6(可扩增132bp)
5′-GATTGCTCTTAGGTCTGGCCCCTCCTCAGC-3′
5′-CCTATGAGCCGCCTGAGGTCTG-3′
外显子7(可扩增119bp)
5′-GTAGGTTGGCTCTGACTGATCCACCATCC-3′
5′-CACACTGGAAGACTCCAGGTCA-3′
外显子8(可扩增173bp)
5′-GGAATTCCTGCTTGCTTACCTACCTCG-3′
5′-GGAATTCCTATCCTGAGTAGTGGTAA-3′
TaqDNA聚合酶、10×扩增缓冲液、dNTP、氯化镁,加拿大Sangon公司。电泳用琼脂糖、丙烯酰胺、双丙烯酰胺,中国科学院上海药物研究所。其它试剂均为国产分析纯。
1.2 方法
1.2.1 标本采集 常规胸穿采集胸液,立即无菌瓶盛装,4℃保存,1~3h内提取DNA。取胸液同时做胸膜活检及胸液涂片进行病理检查。
1.2.2 DNA提取 取5ml胸液10 000r/min,离心3min取沉淀,加入双蒸水1ml混匀后再次离心取沉淀,重复此步骤至沉淀无红色;用酚-氯仿抽提,乙醇沉淀提取DNA,置4℃保存。采用紫外分光光度法测定核酸浓度。
1.2.3 p53基因体外扩增 PCR反应体系为20μl,内含引物20pmol,dNTP1.21μl,加入Taq DNA聚合酶1μl后以石蜡油20μl覆盖。扩增条件为94℃变性2min,94℃变性50s,55℃ 退火45s,72℃延伸60s,30次循环,循环完后72℃保持300s。每次扩增除恶性组、良性组外还设有空白对照和正常对照。扩增产物用2%琼脂糖电泳、溴乙锭染色,用紫外透射分析仪观察扩增效果。
1.2.4 SSCP分析[4] 电泳胶为8%(89∶1)SSCP聚丙烯酰胺凝胶,取5μl PCR扩增产物加10μl SSCP上样液,95℃热浴5min后立即冰浴,之后上样,在1×TBE电泳液、60V、4℃条件下电泳9h。银染后观察电泳结果中对照组、恶性组、良性组各区带的异同,与对照组相比发现有区带数目增加、减少或位置变化,则判定为该样品存在基因突变。
1.2.5 统计处理 采用χ2检验。
2 结果
所提取DNA含量为0.1~0.25μg/μl。所有恶性组、良性组胸液标本及正常胸膜组织均成功扩增出p53基因5、6、7、8外显子,无非特异性条带(图1、2),空白对照无扩增产物。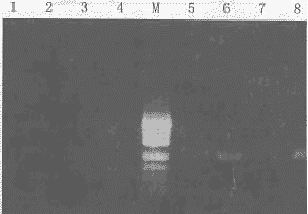
图1 p53基因第5、6外显子PCR扩增结果
M:Markers (自下而上,93bp,122bp,146bp,190bp,242bp,331bp,405bp);
1,2,3,4为Exon 6扩增产物(132bp);5,6,7,8为Exon 5扩增产物(181bp);
2,7为空白对照;1,8为正常胸膜;3,6为良性组标本;4,5为恶性组标本
图2 p53基因第7、8外显子PCR扩增结果
M:Markers(自下而上,93bp,122bp,146bp,190bp,242bp,331bp,405bp);
1,2,3,4为Exon 8扩增产物(173bp);5,6,7,8为Exon 7扩增产物(119bp);
2,7为空白对照;1,8为正常胸膜;3,6为良性组标本;4,5为恶性组标本
19例MPE中7例(36.84%)出现电泳区带位置异常,7例中5例(71.42%)发生在第5外显子(图3中E3,图4中E8为典型变化),2例(28.5%)发生在第7外显子(图5中E11为典型变化),而第6、8外显子未发现异常。未发现同一例恶性胸液脱落细胞中出现p53基因5~8外显子两个以上区带的泳动异常,12例结核性胸腔积液均未出现泳动异常(图3)。
图3 p53基因第5外显子SSCP结果
E为恶性胸液;N为正常对照;
B为结核胸液;E3为突变
图4 p53基因第5外显子SSCP结果
E为恶性胸液组;N为正常对照;E8为突变
图5 p53基因第7外显子SSCP结果
E为恶性胸液;N为正常对照;E11为突变
7例有p53基因突变的MPE患者经病理证实1例为肺鳞癌,2例为小细胞癌,4例为腺癌,它们在各病理类型的突变率见附表。
附表 p53基因5~8外显子突变与病理类型的关系 组织类型
n
p53基因突变
合计(突变率)
Exon5
Exon6
Exon7
Exon8
良性组(结核性)
12
0
0
0
0
0(0.00)
恶性组
19
5
0
2
0
7(36.84)*
小细胞癌
3
1
0
1
0
2(66.67)
鳞 癌
2
1
0
0
0
1(50.00)
腺 癌
14
3
0
1
0
4(28.57)
*与良性组突变率相比P<0.05
19例MPE取胸液同时行胸膜活检及细胞涂片病理检查,10例得以确诊。其余9例经2~4次胸膜活检或多次细胞涂片方得以确诊,而其中2例经1次PCR-SSCP银染法确定了p53基因突变,早于病理诊断。
3 讨论
SSCP是一种利用电泳条带的变化检测单链DNA构象变化的技术,此构象又取决于单链DNA碱基序列,故用SSCP可检测基因的点突变。PCR技术能在短时间内将DNA片段扩增上百万倍。银染技术不使用同位素,经济、简便、易行。因此PCR-SSCP银染技术是定性检测基因突变灵敏、可靠的方法,对MPE诊断有一定应用价值。
p53基因结构和表达异常是目前人类肿瘤中常见的基因改变。结构异常最常发生在高度保守序列的5~8外显子,且多为点突变。本文结果提示肺癌所致MPE脱落细胞中p53基因的突变发生在其外显子5、7,突变率为36.84%,稍低于文献报道[5],笔者认为可能与以下因素有关:①恶性胸液中往往含有非癌变细胞,使突变的检出率下降。②p53基因突变以5~8外显子常见,但也可在其它外显子。③与所选病例的遗传及生活环境有关。④SSCP方法对基因突变检出率为80%~95%[6]。
本文所检测病例均为肺癌所致MPE p53基因突变,提示肺癌所致胸腔积液中脱落细胞p53基因突变可能与肺癌的转移有关,与文献报道一致[7]。
MPE是恶性肿瘤常见的临床征象,有的还以MPE为首发表现,MPE的诊断直接影响到原发肿瘤的诊断及患者的生存质量,但良恶性胸液有时难以鉴别,近年耐药结核分枝杆菌的增加、老年结核病和中青年恶性肿瘤的增多增加了良、恶性胸液的诊断难度。胸膜活检带有盲目性且仅能检测到转移至胸膜壁层的肿瘤组织。细胞学检查需较多量的胸液,并且恶性细胞在胸液中易变形,难与间变或炎性增生间皮细胞区别。胸腔镜及开胸活检创伤大,部分病人不适用。本文用PCR-SSCP银染法特异性高(100%),方法简便,所需胸液量少,不受细胞形态变化的干扰,在所取胸液标本中只要有恶性细胞即可检出。虽本文检出率还不高(36.84%),但相信进一步改进方法可望提高检出率,用于MPE的早期诊断。顾其华[8]等用测序法检测了MPE脱落细胞p53基因7、8外显子以诊断MPE,虽可明确突变碱基与癌症具体关系有利于探讨发病机理,但仪器昂贵、过程复杂、花费大、需时长,推广有一定困难。
我们在取MPE标本同时行胸膜活检及胸液细胞学检查,有9例经反复重复这两项检查才得以确诊,而采用PCR-SSCP法有2例MPE的诊断确定先于病理诊断,提示对原因不明的胸腔积液尤其是疑为MPE而难以确定时,用PCR-SSCP法可望尽快明确诊断。
参考文献:
[1] Mao L,Hruban RH, Boyle JO ,et al.Detection of oncogene mutations in sputum precedes diagnosis of lung cancer[J].Cancer Res,1994,54(7)∶1634
[2]Chang F, Syrjsnen ,Kurvien K ,et al.The p53 tumor suppressor gene as a commom cellular target in human carciongenesis[J].Am J Gastroenterol ,1993,88(1)∶174
[3]Mullick SS,Green LK,Ramzy I ,et al.p53 gene product in pleural effusions :Practical use in distinguishing benign from malignant cells[J].Acta Cytol,1996,40(5)∶855
[4]赵蔚明.PCR-SSCP分析技术及其在肿瘤学研究中的应用[J].国外医学肿瘤学分册,1995,22(3)∶133
[5] 罗慰慈.亚太地区呼吸系统疾病研究进展[J].中华结核和呼吸杂志,1997,20(6)增刊∶1
[6] Cotton RGH.Current methods of mutation detection[J].Mutation Res, 1993,285(6)∶125
[7] Marchetti A, Butlitla F, Merlo G ,et al.p53 alterations in non-small cell lung cancers correlate with metastatic involovement of hilar and mediastinal lymph nodes[J].Cancer Res,1993,53(12)∶2846
[8] 顾其华,李玲芝,李修荣,等.肺癌患者胸腔积液标本p53基因顺序[J].中国现代医学杂志,1998,8(1)∶45
(收稿日期:1999-10-23 修回日期:2000-03-20)
作者:万雨明曹美菊
单位:万雨明(湖北省十堰市东风公司芽箭医院 442012);曹美菊(西安交通大学第一医院呼吸内科,西安 710061)
关键词:p53基因;抑癌基因;胸腔积液;聚合酶链反应-单链构象多态性
西安医科大学学报000309摘 要:目的 探讨聚合酶链反应-单链构象多态性分析(PCR-SSCP)检测胸液脱落细胞p53基因突变在恶性胸腔积液(MPE)诊断中的可行性及价值。方法 用PCR-SSCP分别检测了19例MPE及12例结核性胸腔积液中新鲜脱落细胞标本的抑癌基因—p53基因5~8外显子的突变情况,并与正常胸膜组织进行对照。结果 7例MPE有p53基因突变,突变率为36.84%。其中5例发生在第5外显子,2例发生在第7外显子,第6、8外显子未检出突变,有2例突变检出早于临床病理诊断。结核性胸液无1例突变。结论 提示p53基因突变在MPE脱落细胞中较常见;PCR-SSCP分析胸液脱落细胞中p53基因突变可以作为MPE的一种辅助诊断方法。
中图分类号:R374.3 文献标识码:A
文章编号:0258-0659(2000)03-0220-03
Detection of p53 gene mutations and its clinical
implications in the cells from pleural effusion
Wan Yuming,Cao Meiju
(Department of Respiratory Internal Medicine, First Hospital,Xi′an Jiaotong University, Xi′an 710061,China)
ABSTRACT:Objective To explore the diagnostic value of detecting mutations of p53 gene in the cells from pleural effusion for malignant pleural effusion(MPE) by polymerase chain reaction-single strand conformation polymor-phism analysis (PCR-SSCP)technique.Methods The exons 5 through 8 of p53 tumor suppressor gene of cells from 19 MPE and 12 tuberculous pleural effusion by PCR-SSCP were examined.Results It was found that p53 gene mutations in 7 cases of MPE and 0 case of tuberculous pleural effusion.There were 5 cases in exon 5 and 2 cases in exon 7.No mutation was detected in exon 6 and exon 8.In the same sample, no genetic change in two or more exons was found.Conclusion The results indicate that p53 gene mutation is frequent in cells from MPE and detecting mutations of p53 gene in the cells from pleural effusion by PCR-SSCP is a valuable diagnostic method for MPE.
KEY WORDS: p53 gene;tumor suppressor gene;pleural effusion;PCR-SSCP
恶性胸腔积液(Malignant pleural effusion, MPE)是恶性肿瘤常见的临床征象,临床上往往难与良性胸腔积液相鉴别。近年来,人们试图通过检测基因突变及其产物对肿瘤进行早期诊断[1]。抑癌基因—p53基因的突变是人类肿瘤中最常见的基因变化,其突变主要集中在第5~8外显子[2]。检测p53基因突变及其表达产物用于肿瘤诊断国内外均有报道[1,3],但用于MPE诊断则鲜有报道。本研究采用PCR-SSCP方法对19例恶性胸腔积液及12例结核性胸液中脱落细胞进行了p53基因第5~8外显子分析,以探讨PCR-SSCP方法检测胸液脱落细胞p53基因突变在MPE诊断中的价值。
1 材料和方法
1.1 材料
1.1.1 标本 19例MPE(恶性组)及12例结核性胸腔积液(良性组)病例均为1997年9月~1998年5月本院呼吸内科住院病人。恶性组(男6,女13,年龄32~78岁,平均53岁)均经病理学证实,其中肺腺癌14例,鳞癌2例,小细胞癌3例。良性组(男7,女5,年龄20~70岁,平均40岁)均经临床和病理学证实。所有患者取胸液前均未确诊,且未经抗癌或抗结核治疗。正常对照为胸外伤手术所取正常胸膜组织。空白对照为双蒸水。
1.1.2 主要仪器及试剂 9801-D型PCR扩增仪,西安交通大学开元公司。TGL-16C型高速台式离心机,上海安亭科学仪器厂。DY-3C型电泳仪,江苏兴化分析仪器厂。
p53基因5~8外显子PCR扩增引物(上海复星科技公司)序列如下:
外显子5(可扩增181bp)
5′-TACTCCCCTGCCCTCAACAAGA-3′
5′-CATGAGCGCTGCTCAGATAGCG-3′
外显子6(可扩增132bp)
5′-GATTGCTCTTAGGTCTGGCCCCTCCTCAGC-3′
5′-CCTATGAGCCGCCTGAGGTCTG-3′
外显子7(可扩增119bp)
5′-GTAGGTTGGCTCTGACTGATCCACCATCC-3′
5′-CACACTGGAAGACTCCAGGTCA-3′
外显子8(可扩增173bp)
5′-GGAATTCCTGCTTGCTTACCTACCTCG-3′
5′-GGAATTCCTATCCTGAGTAGTGGTAA-3′
TaqDNA聚合酶、10×扩增缓冲液、dNTP、氯化镁,加拿大Sangon公司。电泳用琼脂糖、丙烯酰胺、双丙烯酰胺,中国科学院上海药物研究所。其它试剂均为国产分析纯。
1.2 方法
1.2.1 标本采集 常规胸穿采集胸液,立即无菌瓶盛装,4℃保存,1~3h内提取DNA。取胸液同时做胸膜活检及胸液涂片进行病理检查。
1.2.2 DNA提取 取5ml胸液10 000r/min,离心3min取沉淀,加入双蒸水1ml混匀后再次离心取沉淀,重复此步骤至沉淀无红色;用酚-氯仿抽提,乙醇沉淀提取DNA,置4℃保存。采用紫外分光光度法测定核酸浓度。
1.2.3 p53基因体外扩增 PCR反应体系为20μl,内含引物20pmol,dNTP1.21μl,加入Taq DNA聚合酶1μl后以石蜡油20μl覆盖。扩增条件为94℃变性2min,94℃变性50s,55℃ 退火45s,72℃延伸60s,30次循环,循环完后72℃保持300s。每次扩增除恶性组、良性组外还设有空白对照和正常对照。扩增产物用2%琼脂糖电泳、溴乙锭染色,用紫外透射分析仪观察扩增效果。
1.2.4 SSCP分析[4] 电泳胶为8%(89∶1)SSCP聚丙烯酰胺凝胶,取5μl PCR扩增产物加10μl SSCP上样液,95℃热浴5min后立即冰浴,之后上样,在1×TBE电泳液、60V、4℃条件下电泳9h。银染后观察电泳结果中对照组、恶性组、良性组各区带的异同,与对照组相比发现有区带数目增加、减少或位置变化,则判定为该样品存在基因突变。
1.2.5 统计处理 采用χ2检验。
2 结果
所提取DNA含量为0.1~0.25μg/μl。所有恶性组、良性组胸液标本及正常胸膜组织均成功扩增出p53基因5、6、7、8外显子,无非特异性条带(图1、2),空白对照无扩增产物。

图1 p53基因第5、6外显子PCR扩增结果
M:Markers (自下而上,93bp,122bp,146bp,190bp,242bp,331bp,405bp);
1,2,3,4为Exon 6扩增产物(132bp);5,6,7,8为Exon 5扩增产物(181bp);
2,7为空白对照;1,8为正常胸膜;3,6为良性组标本;4,5为恶性组标本

图2 p53基因第7、8外显子PCR扩增结果
M:Markers(自下而上,93bp,122bp,146bp,190bp,242bp,331bp,405bp);
1,2,3,4为Exon 8扩增产物(173bp);5,6,7,8为Exon 7扩增产物(119bp);
2,7为空白对照;1,8为正常胸膜;3,6为良性组标本;4,5为恶性组标本
19例MPE中7例(36.84%)出现电泳区带位置异常,7例中5例(71.42%)发生在第5外显子(图3中E3,图4中E8为典型变化),2例(28.5%)发生在第7外显子(图5中E11为典型变化),而第6、8外显子未发现异常。未发现同一例恶性胸液脱落细胞中出现p53基因5~8外显子两个以上区带的泳动异常,12例结核性胸腔积液均未出现泳动异常(图3)。

图3 p53基因第5外显子SSCP结果
E为恶性胸液;N为正常对照;
B为结核胸液;E3为突变

图4 p53基因第5外显子SSCP结果
E为恶性胸液组;N为正常对照;E8为突变

图5 p53基因第7外显子SSCP结果
E为恶性胸液;N为正常对照;E11为突变
7例有p53基因突变的MPE患者经病理证实1例为肺鳞癌,2例为小细胞癌,4例为腺癌,它们在各病理类型的突变率见附表。
附表 p53基因5~8外显子突变与病理类型的关系 组织类型
n
p53基因突变
合计(突变率)
Exon5
Exon6
Exon7
Exon8
良性组(结核性)
12
0
0
0
0
0(0.00)
恶性组
19
5
0
2
0
7(36.84)*
小细胞癌
3
1
0
1
0
2(66.67)
鳞 癌
2
1
0
0
0
1(50.00)
腺 癌
14
3
0
1
0
4(28.57)
*与良性组突变率相比P<0.05
19例MPE取胸液同时行胸膜活检及细胞涂片病理检查,10例得以确诊。其余9例经2~4次胸膜活检或多次细胞涂片方得以确诊,而其中2例经1次PCR-SSCP银染法确定了p53基因突变,早于病理诊断。
3 讨论
SSCP是一种利用电泳条带的变化检测单链DNA构象变化的技术,此构象又取决于单链DNA碱基序列,故用SSCP可检测基因的点突变。PCR技术能在短时间内将DNA片段扩增上百万倍。银染技术不使用同位素,经济、简便、易行。因此PCR-SSCP银染技术是定性检测基因突变灵敏、可靠的方法,对MPE诊断有一定应用价值。
p53基因结构和表达异常是目前人类肿瘤中常见的基因改变。结构异常最常发生在高度保守序列的5~8外显子,且多为点突变。本文结果提示肺癌所致MPE脱落细胞中p53基因的突变发生在其外显子5、7,突变率为36.84%,稍低于文献报道[5],笔者认为可能与以下因素有关:①恶性胸液中往往含有非癌变细胞,使突变的检出率下降。②p53基因突变以5~8外显子常见,但也可在其它外显子。③与所选病例的遗传及生活环境有关。④SSCP方法对基因突变检出率为80%~95%[6]。
本文所检测病例均为肺癌所致MPE p53基因突变,提示肺癌所致胸腔积液中脱落细胞p53基因突变可能与肺癌的转移有关,与文献报道一致[7]。
MPE是恶性肿瘤常见的临床征象,有的还以MPE为首发表现,MPE的诊断直接影响到原发肿瘤的诊断及患者的生存质量,但良恶性胸液有时难以鉴别,近年耐药结核分枝杆菌的增加、老年结核病和中青年恶性肿瘤的增多增加了良、恶性胸液的诊断难度。胸膜活检带有盲目性且仅能检测到转移至胸膜壁层的肿瘤组织。细胞学检查需较多量的胸液,并且恶性细胞在胸液中易变形,难与间变或炎性增生间皮细胞区别。胸腔镜及开胸活检创伤大,部分病人不适用。本文用PCR-SSCP银染法特异性高(100%),方法简便,所需胸液量少,不受细胞形态变化的干扰,在所取胸液标本中只要有恶性细胞即可检出。虽本文检出率还不高(36.84%),但相信进一步改进方法可望提高检出率,用于MPE的早期诊断。顾其华[8]等用测序法检测了MPE脱落细胞p53基因7、8外显子以诊断MPE,虽可明确突变碱基与癌症具体关系有利于探讨发病机理,但仪器昂贵、过程复杂、花费大、需时长,推广有一定困难。
我们在取MPE标本同时行胸膜活检及胸液细胞学检查,有9例经反复重复这两项检查才得以确诊,而采用PCR-SSCP法有2例MPE的诊断确定先于病理诊断,提示对原因不明的胸腔积液尤其是疑为MPE而难以确定时,用PCR-SSCP法可望尽快明确诊断。
参考文献:
[1] Mao L,Hruban RH, Boyle JO ,et al.Detection of oncogene mutations in sputum precedes diagnosis of lung cancer[J].Cancer Res,1994,54(7)∶1634
[2]Chang F, Syrjsnen ,Kurvien K ,et al.The p53 tumor suppressor gene as a commom cellular target in human carciongenesis[J].Am J Gastroenterol ,1993,88(1)∶174
[3]Mullick SS,Green LK,Ramzy I ,et al.p53 gene product in pleural effusions :Practical use in distinguishing benign from malignant cells[J].Acta Cytol,1996,40(5)∶855
[4]赵蔚明.PCR-SSCP分析技术及其在肿瘤学研究中的应用[J].国外医学肿瘤学分册,1995,22(3)∶133
[5] 罗慰慈.亚太地区呼吸系统疾病研究进展[J].中华结核和呼吸杂志,1997,20(6)增刊∶1
[6] Cotton RGH.Current methods of mutation detection[J].Mutation Res, 1993,285(6)∶125
[7] Marchetti A, Butlitla F, Merlo G ,et al.p53 alterations in non-small cell lung cancers correlate with metastatic involovement of hilar and mediastinal lymph nodes[J].Cancer Res,1993,53(12)∶2846
[8] 顾其华,李玲芝,李修荣,等.肺癌患者胸腔积液标本p53基因顺序[J].中国现代医学杂志,1998,8(1)∶45
(收稿日期:1999-10-23 修回日期:2000-03-20)
您现在查看是摘要介绍页,详见PDF附件(207kb)。