注重综合建设 弥补软件不足——近年来药品GMP认证检查不合格项目分析
 |
 |
 |
 |
 |
这篇分析报告角度新颖、分析透彻、观点凝练,是了解近年来药品GMP实施情况的一个很好的“平台”。作者对我国制药行业6年来GMP认证检查的总体情况进行了深入分析,利用数据和图表清晰地展示出制药企业在实施药品GMP中薄弱项目的变化和特点,并从规范质量管理的角度,提出了建设合格软件管理体系的合理化建议,对制药企业更好地实施药品GMP有很强的指导作用。
——编者按
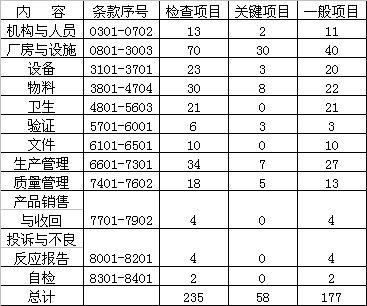
《药品生产质量管理规范》(以下简称药品GMP)是制药企业在药品生产和质量管理过程中必须遵守的基本准则,药品GMP认证则是国家药品监督管理部门对企业药品生产全过程进行监督检查的重要手段,是一种对企业实施药品GMP情况进行检查认可的过程。根据药品GMP制定的《药品GMP认证检查评定标准》,目前共有检查项目235项,包括机构与人员、厂房与设施、设备、物料等十二章内容,其中关键项目为58项,一般项目为177项(见表1)。
表1:各章节检查项目数
, http://www.100md.com
截至2004年底,国家食品药品监督管理局已完成对4000多家制药企业的药品GMP认证,共计颁发药品GMP证书7000多张。本文应用药品GMP认证计算机管理系统(国家食品药品监督管理局及药品认证管理中心进行药品GMP认证管理工作所使用的计算机系统),对1999年至2004年间药品GMP认证检查中出现的不合格项目情况进行统计,并对统计结果进行较细致的分析,希望分析结果能为药品GMP认证管理工作及制药企业实施药品GMP提供参考。
■统计:文件和验证位居不合格项目前列
统计一:按年度进行统计。
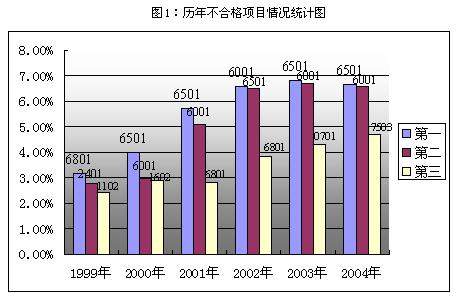
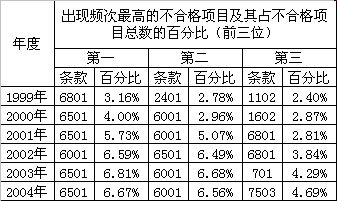
从1999年至2004年间的整体情况来看,几乎所有的检查项目都有不合格记录,不合格项目分布较广。经过对同一检查项目出现不合格情况的频次进行统计,并与不合格项目总数进行比较,将得出的具体百分比按从高到低的顺序排列,前三位依次是6501项、6001项和6801项,百分比分别为5.59%、5.39%和3.59%,对照表1查出所属章节分别为文件、验证和生产管理(见表2屯?)。
, 百拇医药
表2:历年不合格项目情况统计表
统计二:按章节进行统计。
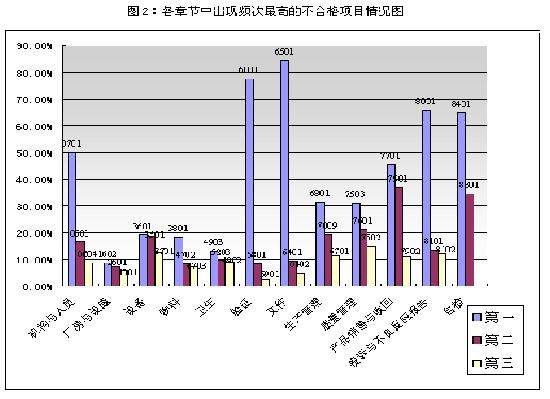
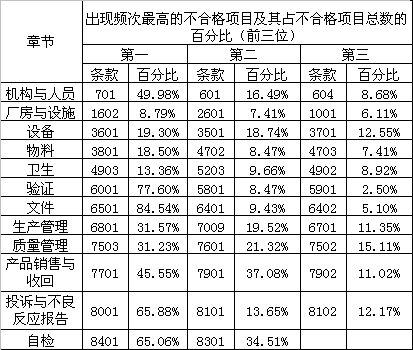
对各章节同一检查项目出现不合格情况的频次进行统计,并与此章节的不合格项目总数进行比较可以看出,序号为6501、6001、8001、8401和0701的检查项目不合格频次最高,均占所在章节不合格项目总数的50%以上。对照表1查出所在章节分别是文件、验证、投诉与不良反应报告、自检和机构与人员(见表3和图2)。
表3:各章节中出现频次最高的不合格项目情况统计表
■分析:软件管理不够规范
分析一:从统计结果看,历年药品GMP认证检查中,不合格数最多的项目占不合格项目总数的百分比都不超过10%(见表2),说明不合格项目比较分散,制药企业存在的问题比较多样化。其中,不合格率最高的检查项目集中于序号6501、6001、8001、8401、0701、7503和6801等,而这些都属于一般项目,究其原因是企业重视关键项目,轻视一般项目。
, 百拇医药
1999年和2000年不合格项目主要集中在生产管理、文件、厂房与设施等方面,软、硬件问题同时存在,但软件问题略高于硬件问题。2001年及以后几年的不合格项目主要集中在文件、验证、生产管理、质量管理等方面,说明企业存在的最主要问题是软件问题,硬件问题已不再是主要问题。综合分析显示,历年来不合格项目主要集中在文件、验证及生产管理上,说明制药企业在软件建设方面还比较薄弱,软件问题成为质量管理中比较突出的问题,今后必须加强这方面的建设和管理。
其实,药品GMP中的每一条对保证药品质量都至关重要,都关系到人民群众用药的安全有效,制药企业不应只注重关键项目,而对一般项目马马虎虎。如果企业实施药品GMP的目的只是取得一张药品GMP证椋敲丛蛴秀S谑凳┮┢稧MP认证的初衷了。所以,企业应兼顾软件和硬件建设,通过规范实施药品GMP使生产和质量管理得到提高和完善,真正保证药品质量的安全有效。
分析二:统计结果表明,2003年以前,不合格数最多的项目占不合格项目总数的百分比呈逐年增高的趋势,而2003年以后则稍有下降。这说明随着药品GMP认证工作的深入开展,制药企业在实施药品GMP过程中所出现的问题越来越集中。
, 百拇医药
以上两种统计方法得出同一结果,即历年来不合格率最高的项目主要集中在序号为6501和6001的检查项目。从表3中可以看出,序号为6501的不合格项目数几乎占该章节不合格项目总数的90%,成为认证检查中最突出的问题。序号为6501的检查项目是文件,该条款的具体内容为“文件的制定是否符合规定”。检查中发现企业在这一项目上存在的主要问题有:部分文件的制定不符合规定;部分文件的制定缺乏可操作性和指导性;部分文件内容不全;部分文件制定不规范,与实际生产管理有差距,需进一步完善;部分文件使用的语言模棱两可、不确切。从以上现场检查缺陷描述中可以看出,企业在实施药品GMP中,部分文件的制定与生产是脱节的,制定文件不是为了指导生产而是为了应付检查。
序号为6001的检查项目为验证,该条款的具体内容为“验证过程中的数据和分析内容是否以文件形式归档保存,验证文件是否包括验证方案、验证报告、评价和建议、批准人等”。检查中发现企业在这一项目上存在的主要问题有:验证过程中的部分数据和分析内容归档不完整;验证方案不具体,没有可操作性;验证文件中评价不准确,无建议;个别设备的验证方案不够具体。从以上现场检查缺陷描述中可以看出,企业对验证的内容和实质理解得并不到位,甚至存在敷衍了事或弄虚作假的问题。
, 百拇医药
■建议:立足规范加强软件建设
从以上统计分析我们可以得出这样一个结论:制药企业对药品GMP认证认识不够全面,对软件体系建设和管理不够重视,还没有把它当作促进企业发展必不可少的重要手段。鉴于此,笔者提出以下建议:
首先,制药企业要树立综合建设、协调发展的意识。药品GMP实质上是一个包括软件和硬件两个体系建设的管理规范,因此,企业在实施过程中不可以重硬件建设,轻软件建设,重关键项目,轻一般项目,而应以求真务实、规范发展的态度对待药品生产和质量管理的每一个环节,做好内部审核及自检工作。同时,制药企业还要不断增强实施药品GMP的自觉性,树立持续改进的理念,认真分析和评价生产管理现状,客观识别改进区域,科学寻找解决方法,努力实现确定目标,进而在实施药品GMP的过程中持续不断地前进。
其次,制药企业要规范软件体系建设和管理。文件编制和组织验证是药品质量保证体系中极为重要的内容,要做好它们,企业必须确立质量管理部门的地位和职责,从组织上、制度上确保其权限的行使;健全文件起草、审核、批准、修改、再批准的制度和程序,不能流于形式;结合药品生产的剂型、品种特点,编制可操作性强的SOP(标准生产操作规程),不能照搬照抄其他企业的SOP;在验证过程中严格依照建立验证机构、确定验证内容、制定验证方案、实施验证、编写验证报告和审批发放验证证书等程序认真进行,通过验证数据和实际操作,不断修改和完善SOP,做到操作规程切实可行。
, 百拇医药
此外,行政管理部门要加强日常监管。药品监管部门应通过跟踪检查和飞行检查等方式,督促企业规范实施药品GMP。同时,还应深入地开展调查研究,制定一些专业性较强的具体指导意见,补充和完善行政管理的不足,并在逐步总结经验和开展试点工作的基础上,完善现行的药品GMP认证检查方法、内容和项目。认证管理机构、行业协会等也应充分发挥作用,进一步加大药品GMP的宣传力度,如举办多种形式的培训或再教育,开展国内与国外、省与省之间、检查员之间、企业与监管部门之间的交流活动等,增强企业规范实施GMP的自觉性。
国家食品药品监督管理局药品认证管理中心 樊晓东
图1:历年不合格项目情况统计图
图2:各章节中出现频次最高的不合格项目情况统计图, http://www.100md.com