双下肢麻木、声音嘶哑、发热
 |
病历摘要
患者,女性,38岁, 因“双下肢麻木5个月,发热3个月,声音嘶哑10天”入院。
患者5个月前无诱因出现左足底部麻木感,渐扩大至左足背和胫前,并出现间断双膝、双肘关节疼痛,双下肢乏力,活动后加重,平路可步行400米,无上肢上举困难,无呼吸、吞咽困难,无饮水呛咳,无眼睑上抬困难等。4个月前,麻木感累及右侧足底,不能下地活动。3个月前,患者出现发热,体温38℃~39.5℃,无其他伴随症状。当地医院先后给予多种抗生素治疗,症状无明显缓解。予地塞米松治疗后体温可降至正常,停药后反复。
患者入院前10天突然出现声音嘶哑,无憋气及饮水呛咳。我院门诊查血白细胞(WBC)18.88×109/L[正常值(4.0~10.0)×109/L],中性粒细胞(NEUT)79.8%(正常值50%~75%),血红蛋白(Hb)115 g/L(正常值110~150 g/L),血小板(PLT)635×109/L[正常值(100~350)×109/L]。双髋关节X线检查:双髋间隙略窄,左髋小囊样改变。
, 百拇医药
个人史:河南农民,不嗜烟酒,无牛羊接触史。
入院查体:T 38.1℃,全身皮肤未见皮疹,声音嘶哑,伸舌居中,舌腭弓可见2个小溃疡,咽反射存在。心肺腹检查未见异常。左膝以下痛觉稍减退。四肢肌张力正常,左足背屈肌力V-级,余肢体肌力V级,无明显肌肉萎缩。双上肢腱反射对称正常,左膝反射略高于右侧,双侧Babinski征(-)。
诊断分析
患者为青年女性,慢性病程,进行性加重。以神经、肌肉系统症状为突出表现,伴中至高度发热,多种抗生素治疗无效,糖皮质激素有一定疗效。因患者神经系统症状突出,故首先从此入手。患者主要表现为非对称性双下肢感觉异常,除左足背屈肌力略减退外,四肢肌力正常,生理反射基本对称,双侧病理征阴性。近期患者出现声音嘶哑,咽反射正常,提示单侧喉返神经可能受累。综上所述,病变可定位于周围神经,为多发性单神经病。
, 百拇医药 在多发性单神经病患者中,1/3为脱髓鞘疾病,2/3为灶性轴突损害,多为神经滋养血管疾病所致。电诊断(electrodiagnostic,EDX)对判断神经病变是原发轴索性还是脱髓鞘性病变具有重要意义。值得内科医师注意的是,多发性单神经病也可以是一些内科疾病的神经系统表现,如麻风、结节病、淀粉样变性、冷球蛋白血症、艾滋病、血管炎和糖尿病等。结合患者有发热,应考虑血管炎、结节病、HIV/AIDS和代谢性疾病的可能,可行相关实验室检查明确。该患者有长期应用糖皮质激素史,易合并各种感染,因此还需行相关病原体检查除外有无继发性感染。
入院检查:血WBC 13.1×109/L,NEUT 76.9%,Hb 103 g/L,PLT 530×109/L,血涂片正常。肝肾功能:白蛋白(ALB) 27 g/L(正常值35~51 g/L),余正常。尿白细胞70个/ml,蛋白和红细胞(-)。大便常规和潜血(-)。3次血培养、3次清洁中段尿培养均(-)。人类免疫缺陷病毒(HIV)抗体、梅毒抗体(RPR)、莱姆病抗体、结核菌素纯蛋白衍生物(PPD)皮试均阴性。蛋白电泳:γ球蛋白 22.3%(正常值10.6%~23.5%)。血免疫球蛋白(Ig)定量:IgM 3.21 g/L(正常值0.6~2.5 g/L),余正常。免疫电泳未见单克隆区带。骨髓涂片基本正常。甲状腺功能、叶酸及维生素B12检查均正常。心电图及超声心动图(-)。胸腹CT:肝右叶小囊肿,肝右后叶点状钙化灶。盆腔B超(-)。
, http://www.100md.com
寻找病因:①患者入院后反复血培养、清洁中段尿培养、影像学、血涂片及骨髓涂片均不支持普通细菌感染;②HIV抗体、莱姆病抗体阴性,可除外HIV/AIDS及莱姆病;③患者PPD皮试阴性,无肺部、消化道、泌尿系统症状,影像学无结核感染证据,故结核可能性不大;④无肝脾肿大,影像学无纵隔及腹膜后淋巴结肿大,无脏器占位性病变,蛋白电泳及免疫电泳未见单克隆区带,骨髓涂片未见明显异常,故可除外肿瘤及副肿瘤综合征;⑤患者空腹血糖、肝肾功能、甲状腺功能、叶酸及维生素B12检查均正常,可除外常见代谢性疾病所致多发性单神经病。因此应重点考虑系统性血管炎。
入院后第3天,患者无诱因突然出现复视,无头晕、头痛、恶心和呕吐,无视物旋转、意识障碍、肢体活动障碍。查体:双瞳孔等大,对光反射正常,眼睑无下垂,左眼下视不全,双眼下视时出现复视,余各方向运动不受限,眼球震颤未引出,左侧Babinski征(+)。
急诊头颅CT(-)。腰穿:脑脊液压力230 mm H2O,常规和生化未见明显异常。
, http://www.100md.com
患者新出现复视、左眼下视不全、左侧病理征阳性,因此病变可定位于中枢神经系统。结合头颅CT正常,脑脊液压力稍高(常规和生化正常),定性上可除外出血性卒中,考虑为缺血性卒中。其病因可能有:①栓塞性疾病 心源性栓塞、大动脉粥样硬化斑块和附着物脱落、感染性菌栓等;②脑血栓形成 动脉粥样硬化、动脉壁炎症(结核性、梅毒性、化脓性、结缔组织病、变态反应性动脉炎等)、先天性血管畸形、真性红细胞增多症等。
该患者入院后查超声心动图正常,无普通细菌、结核、HIV、梅毒感染和真性红细胞增多症等证据;患者为年轻女性,无高血压、糖尿病和高脂血症,无相应阳性家族史。可除外心源性栓塞、感染性脓栓、动脉粥样硬化、动脉粥样硬化斑块和附着物脱落、真性红细胞增多症等所致缺血性脑卒中,而先天性血管异常难以解释病情全貌,故考虑血管炎引起缺血性脑卒中可能性大。
查血沉(ESR) 67 mm/60 min(正常值<18 mm/60 min)、C反应蛋白(CRP)10.7 mg/dl(正常值<2.5 mg/dl),抗核抗体(ANA)、抗双链DNA抗体(dsDNA)、抗可提取性核抗原(ENA)抗体均阴性,补体正常,类风湿因子(RF)327.8 U/ml,抗角蛋白抗体(AKA)、抗核周因子(APF)阴性,核周型(p)抗中性粒细胞胞浆抗体(ANCA)1∶ 160(正常值<1∶ 10)。
, http://www.100md.com
肌电图:双下肢周围性神经源性损害(感觉运动纤维均受损)和肌源性损害。头颅磁共振成像(MRI):右侧额叶皮层下点状略长T2信号,考虑缺血性改变。电子喉镜提示右声带旁正中位固定。甲状腺B超(-)。
患者有多发性单神经病、发热、缺血性脑卒中、肌病(肌电图提示肌源性损害)等多系统受累表现,考虑血管炎可能性大。血管炎可分为:
1. 继发性血管炎
①系统性红斑狼疮(SLE):多系统性损害,常有ANA、抗ENA抗体阳性,补体减低。本例患者ANA及抗ENA抗体正常,补体正常,故不支持SLE。②类风湿关节炎(RA):虽然患者在病程中曾有关节痛,RF阳性,但RA的神经系统受累主要表现为多发性周围神经病,如尺、桡、腓、胫神经分布区域感觉异常,正中神经受压也可引起腕管综合征;而中枢神经系统受累较为少见,且RA早期标志物如AKA、APF等均阴性,故RA可能性不大,可行手、足关节X线检查进一步除外。③干燥综合征(SS):SS合并周围神经病变较多见,主要累及三叉神经及其他感觉纤维,导致感觉过敏、感觉缺失或运动障碍,但也可累及运动神经。患者无口、眼干燥症的表现,抗ENA抗体阴性,不支持该诊断。④其他系统性疾病如混合性结缔组织病、皮肌炎、硬皮病等疾病的神经系统损害罕见。
, 百拇医药
2. 原发性血管炎
①结节性多动脉炎(PAN):为一种中等大小动脉受累的血管炎。其常有神经系统受累,有时可为PAN的首发表现,如感觉异常、麻木、疼痛、四肢末端呈手套或袜套样改变,也可出现运动障碍,四肢均可受累。也可出现中枢神经系统的临床表现,如头痛、精神障碍、偏瘫、癫痫发作、脑出血等。可有胞浆型(c)抗中性粒细胞胞浆抗体(ANCA)阳性。中小动脉活检提示,动脉壁有中性粒细胞或中性粒细胞和淋巴细胞浸润。本例要考虑PAN的可能。
②白塞病:其神经系统损害可侵袭脑干、脑膜及周围神经。特点是男性多于女性,多在发病后1~3年出现,中枢神经系统受累较周围神经系统受累多见,全身血管均可累及,早期血管炎类似白细胞破碎性血管炎,或中性粒细胞性血管炎,晚期则为淋巴细胞性血管周围炎。
③显微镜下多血管炎(microscopic polyangiitis,MPA):可有周围神经病表现,p-ANCA阳性,但肾脏损害更为突出。病理为小血管的节段性纤维素样坏死,在小动脉、微动脉、毛细血管和静脉壁上有多核白细胞和单核细胞浸润,可伴有血栓形成。
, 百拇医药
④其他如变应性肉芽肿性血管炎(CSS)、韦格纳肉芽肿(Wegener’s granulomatosis,WG)等均可有周围神经病表现。因此,为进一步明确诊断,需行相关神经及肌肉活检以明确是否存在血管炎以及血管炎的类型。
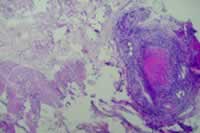
患者双手、足关节X线检查正常。腓浅神经及腓骨短肌活检:横纹肌组织活动性炎性改变伴血管炎,神经重度亚急性活动性轴索性神经病,伴炎性反应(图1)。患者接受泼尼松60 mg/d ×1个月(规律减量),环磷酰胺(CTX)1.0 g iv,qw ×2周,此后每个月1次治疗。
治疗2天后患者体温正常,病情基本稳定。3周后复查血WBC 12.4×109/L,Hb 106 g/L,PLT 336×109/L,ESR 38 mm/60min,CRP 5.33 mg/dl,p-ANCA 1∶ 80。
患者的神经和肌肉病理结果均支持小血管炎,但是结合其临床表现和ANCA阳性,目前难以将其划分为具体某一类型小血管炎,故诊断为ANCA相关小血管炎。考虑到患者炎症活动明显,病情进行性加重,给予足量泼尼松及大剂量CTX冲击治疗后,患者体温正常,病情基本稳定,复查炎性指标(血WBC、PLT、ESR、CRP)和p-ANCA滴度均下降,进一步肯定了上述诊断。
, http://www.100md.com
讨 论
系统性血管炎按其侵犯血管的大小可将其分为大、中、小等3种血管炎。小血管炎可进一步按ANCA是否阳性分为ANCA相关及非ANCA相关小血管炎。
ANCA相关小血管炎包括:MPA、WG、Churg-Strauss综合征和药物诱导的血管炎。因其短期内常可出现重要脏器致命性损害,激素及免疫抑制剂治疗可取得戏剧性效果,故临床工作中迅速识别并诊断ANCA相关小血管炎具有重要意义。
在临床上对于小血管炎的诊断,要考虑以下3个问题:①什么时候要怀疑小血管炎的可能?②如何诊断小血管炎?③如何具体分型?
当患者出现多系统损害(如皮肤、肾脏、肺、神经系统、消化系统等),尤其是皮肤的紫癜样皮疹、蛋白尿或镜下血尿或肾功能异常、罕见部位的动脉血栓形成、急性肺间质病和弥漫性肺泡出血,以及突发的神经系统异常时要引起注意,同时要考虑与广泛动脉栓塞(心内膜炎、抗磷脂综合征、心房粘液瘤和易栓症)、药物中毒(重金属中毒等)的鉴别诊断。另外,要注意除外感染(病毒、细菌、真菌等)或恶性肿瘤(淋巴瘤、白血病、骨髓增殖性疾病,实体瘤罕见)所致的继发性小血管炎。
, 百拇医药
血管炎的诊断主要依据血清学和病理学的诊断。在小血管炎中,ANCA是一个比较特异的血清学指标,而病理学发现血管周围的非感染性炎症更是血管炎的金标准。根据抗体作用靶点的不同,ANCA可分为两种:胞浆型(c)ANCA和核周型(p)ANCA。蛋白酶3(PR3)是c-ANCA的抗原,常见于WG。髓过氧化物酶(MPO)是p-ANCA的主要抗原,常见于MPA、CSS和Good-Pasture综合征。
相对特异的临床表现和ANCA的类型是ANCA相关血管炎的分型基础。例如,WG主要侵犯上、下呼吸道和肾脏,可表现为鼻和鼻窦炎、肺病变和进行性肾功能衰竭;CSS主要受累器官为肺、心、肾、皮肤和外周神经,多数患者外周血嗜酸性粒细胞增多,伴有哮喘或变应性鼻炎;MPA主要侵犯肾、肺、皮肤和外周神经等,主要表现为亚急性进行性肾功能不全、肺间质炎症、肺泡出血等。但是仍有许多ANCA相关小血管炎无法被明确分型。事实上,因为治疗方法相似,同时ANCA相关小血管炎短期内常可出现重要脏器致命性损害,故在临床实践中,在尚未明确分型之前就应给予积极的激素及免疫抑制剂治疗。
ANCA相关小血管炎的治疗包括:诱导缓解、维持治疗以及复发后治疗。药物治疗通常包括激素及免疫抑制剂,目前尚无治疗方案的规范。但是,对于进展迅速、短期内出现重要脏器损害的病例,需要大剂量甲泼尼龙及环磷酰胺冲击治疗。
点 评
通过这个病例,作者详细介绍了小血管炎的临床特点、分型和鉴别诊断,在临床上应特别强调,一旦诊断ANCA相关小血管炎,一定要积极治疗,分秒必争,否则会出现不可逆转的重要脏器致命性损害。(刘晓红), 百拇医药