气促、指趾端青紫
 |
 |
病历摘要
患儿,女, 2岁11个月,因“气促8个月,指趾端青紫、肿胀6个月”入院。
入院查体 呼吸稍促38次/分,余生命体征平稳。发育落后,营养不良,神志清,反应尚可,慢性病容,颜面和耳廓毛细血管扩张。卡介苗瘢痕阳性。浅表淋巴结未触及。患儿哭闹后口唇发绀,无鼻翼扇动和三凹征。咽稍充血。双肺呼吸音粗,未闻及干湿罗音和喘鸣音,心脏查体未见异常。腹平软,肝肋下1.5 cm,剑下3.0 cm,质硬,脾未及。杵状指趾,甲床紫绀。
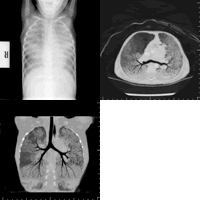
实验室检查 血常规、血沉、C反应蛋白(CRP)均正常。血气分析:pH 7.349,PO2 74.9 mmHg,PCO2 36.9 mmHg,HCO3-19.9 mmol/L,BE-5.8,SO2 94%。2次查心脏彩超提示右房室内径轻度增大。电解质、肝肾功正常,乳酸脱氢酶334 IU/L,余生化项目正常。胃液未见含铁血黄素细胞。头颅CT未见异常。腹部B超大致正常。HIV抗体阴性。结核菌素纯蛋白衍生物(PPD)阴性。CD系列:CD4 36.3%(正常值55%~57%),余正常。Ig系列:IgG 18.81 g/L(正常2.93 ~8.06 g/L),IgM>3.851g/L(0.16~1.64g/L)。X线胸片示,双肺纹理粗重模糊,双肺广泛点网状改变,部分融合成片。印象:双肺间实质浸润(如图1)。
, 百拇医药
病例分析
本病例特点:(1) 女性幼儿,起病隐匿,病史长。(2) 主要表现为逐渐加重的呼吸困难和杵状指趾,抗感染治疗无效,无发热、咳嗽、咯血等其他症状。(3) 查体:发育落后,营养不良,呼吸促,哭闹后口唇发绀,颜面和耳廓毛细血管扩张,双肺呼吸音粗,未闻及干湿罗音和喘鸣音,杵状指趾,甲床紫绀,肝脏稍大。(4) 血常规、CRP、血沉正常。血气示低氧血症。CD系列提示CD4稍减低,余正常。Ig系列提示IgG和IgM明显增高。心脏彩超提示右室内径轻度增大。X线胸片示两肺弥漫性间、实质浸润。
综合上述临床特点,入院诊断“双肺间实质病变原因待查”。分析病因:
1. 感染性疾病:患儿按计划接种疫苗,无明确感染接触史,临床上无发热、咳、痰、喘等表现,无明显感染中毒症状,肺部无明显阳性体征,外院间断抗炎、抗病毒和加强呼吸道管理治疗无效,实验室检查未见炎性指标增高,无感染征象,故感染性疾病不能完全解释患儿病情。
, 百拇医药
2. 非感染性疾病:
(1) 免疫缺陷病 患儿有输血史,CD4低于正常,结合胸片表现,应考虑如获得性免疫缺陷综合征、Digeorge综合征、纤毛不动症等免疫缺陷病合并感染,如卡氏肺孢子虫、真菌等可能。应行HIV抗体、支气管内膜活检、胸腺CT等检测。但患儿无感染证据,且单用本病本身无法完全解释双肺间实质浸润,依据不足。
(2) 结缔组织病 本患儿系幼儿期女童,胸片呈两肺弥漫性间实质浸润,面部和耳廓可见毛细血管扩张,应考虑结缔组织病。但患儿无皮疹、脱发、日光过敏、关节炎表现、口腔溃疡、腺体分泌障碍等症状,未出现其他脏器受累表现,查自身抗体阴性,不支持。
(3) 特发性肺纤维化 本患儿活动耐量减低,有进行性加重的呼吸困难和缺氧征,结合患儿起病隐匿病史长,胸片可见广泛点网状改变,应考虑本病。但需进一步查肺高分辨CT和肺活检协诊。
, http://www.100md.com
(4) 遗传性毛细血管扩张症 根据本患儿上述临床特点,查体可见耳廓毛细血管充血,应考虑本病。但患儿无相关家族病史,应做肺增强CT和肺活检协助诊断。
(5) 肺血管畸形 本患儿无明显诱因出现进行性呼吸困难,慢性缺氧,杵状指趾、紫绀,胸片提示双肺间实质病变,应考虑做肺增强CT和肺活检。
(6) 肺泡蛋白沉着症 本病临床均隐袭起病,有进行性活动后气短、呼吸困难,有时伴发绀,常伴有干咳、乏力、消瘦,偶尔有咯血。肺部高分辨CT(HRCT)可有典型的铺路石样改变。本患儿以活动耐量减低,逐渐加重的呼吸困难,明显的缺氧征和杵状指趾为主要表现,结合胸片提示双肺间实质浸润,应考虑本病。入院后可行HRCT、支气管灌洗液和肺组织病理检查协诊。
入院后安排患儿行肺HRCT可见(图2、3):双侧胸廓饱满,两肺广泛分布磨玻璃样、碎石样改变,分布于右肺上叶、下叶及左肺各叶,其内可见网点状结构影、小囊片状低密度影及支气管充气征,病灶间穿插可见小片状肺透光度增高区,两肺背侧胸膜下肺门病变密度高,右中叶内除病灶外肺野透光度明显增高,左肺门著明,心影不大。印象:两肺广泛间实质病变。肺动静脉均匀增粗,未见明确动静脉瘘,心影不大。腔静脉后、气管周围及左肺门区淋巴结增大。主动脉弓下点状钙化。胸腺略小。符合肺泡蛋白沉着症的典型表现。
, 百拇医药
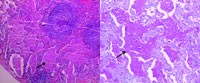
入院第9天患儿接受肺活检,术中可见肺叶上中下均色暗,肺表面有广泛小颗粒样改变,三叶肺粘连重,剪开处均有白色黏液流出。病理结果提示:肉眼可见肺组织表面有多发弥漫性黄或灰白色硬结节,肺切面有黄白色液体渗出。光镜下见:胸膜轻度增厚,肺泡间隔宽,纤维组织增生,毛细血管扩张充血,部分肺泡受压变窄,部分肺泡腔扩张,肺泡腔及细支气管内充满脂质蛋白沉积物,肺泡Ⅱ型细胞明显增生肥大,肺泡巨噬细胞常呈泡沫状。肺泡间隔及肺泡腔内密集淋巴细胞,少量中性白细胞,有淋巴滤泡形成。CD3(+),CD20(+),CD1a(-)CD68(+),F13(-),S-100(-),CK(+),Actin(平),小血管(+)(见图4)。PAS染色阳性,PAS物质呈特征性同心圆排列的层状结构充满肺泡腔(见图5)。术中创面渗出物培养阴性。结合患儿上述临床特点,最后诊断为肺泡蛋白沉着症。
讨 论
肺泡蛋白沉着症(PAP)是一种病因未明的肺部疾病,于1958年由Rosen等首先报告,1964 年侯杰在国内首次对本病进行了综述,该病是一种少见疾病,其病理组织学特征为肺泡及细支气管腔内充满过量的无定形PAS 染色阳性的富磷脂蛋白样物质,导致肺的通气和换气功能障碍。
, 百拇医药
PAP 包括原发型、继发型2类。继发型PAP继发于急性硅沉着症和其他吸入性疾病、免疫缺陷病,以及恶性肿瘤尤其是血液系统恶性肿瘤。在原发性PAP发病机制的研究中,发现本病的发生有编码表面活性蛋白B或C、或粒细胞-巨噬细胞集落刺激因子(GM-CSF)受体βc链、或ABC-A3的基因突变的因素;另外,在最近一些学者对原发性PAP的研究中,在原发性PAP患者的支气管灌洗液(BALF)中,发现一种特异性的GM-CSF 的自身抗体,可抑制GM-CSF 培养液中外周血单核细胞及TF-1细胞生长,同时在原发性PAP患者的血清中也检测到这种自身抗体的存在。这一发现使人们意识到原发性PAP很可能是一种自身免疫性疾病,GM-CSF的功能缺陷可能与这种自身抗体的抑制作用存在相关。最终均导致肺泡表面活性物质代谢的异常和肺泡巨噬细胞清除功能的下降导致肺泡腔内大量表面活性蛋白和脂质的沉积,出现以肺泡及细支气管腔内充满过量的无定形PAS 染色阳性的富磷脂蛋白样物质为病理组织学特征的表现。
PAP临床表现和病程进展多样,从新生儿到老年人均可发病,大多数为原发性,少部分可继发于其他疾病或吸入某些化学物质等引起。半数以上病人临床症状均隐袭起病,有进行性活动后气短、呼吸困难,有时伴发绀,常伴有干咳、乏力、消瘦,偶尔有咯血。咳嗽和呼吸困难症状与肺泡内聚积物的量有关,但临床症状与胸部X线表现不平行,临床症状常较胸部X线表现轻。且此肺部病变基础上,易合并多种病原感染,加重呼吸道症状,咳嗽明显,咳脓性痰,经抗感染治疗可暂时好转,易反复,故本病也可以反复呼吸道感染起病。因此本病患者多因反复呼吸道感染、进行性呼吸困难、缺氧征逐渐加重等临床症状而多方求诊,但由于早期缺乏特异性临床表现和影像学特征,很难给予明确诊断。多在辗转诊治无效后,呼吸困难明显,出现杵状指趾、紫绀等慢性缺氧体征,经肺部HRCT检查发现典型铺路石征等表现后,经肺活检明确诊断。
, http://www.100md.com
影像学检查:X线表现:主要以肺腺泡为基本单位的肺泡实变,即显示散在的结节状边缘模糊的阴影,并有融合成片状阴影的趋势。在结节状融合影中可伴有小的透亮区,后者表示尚未实变而呈代偿性肺气肿或残留含气的肺泡。病变进展则呈大片状云絮状密度影,以肺野中央部较多,自肺门向外放射,形如蝶翼状,类似肺泡性肺水肿的X 线表现,但无后者的心脏扩大、KerleyB 线、叶间裂增厚和胸腔积液等左心功能不全的表现。充气支气管征不常见。晚期有间质增生时,可表现为网状或伴有结节阴影。一般肺门淋巴结不肿大。CT表现:典型的PAP 在CT 上表现为肺部形态各异的斑片状实变阴影,与周围正常的肺组织分界清楚,在肺野中呈“地图样”表现。无好发肺叶或区域。HRCT可见上述地图样病变为边界清楚的云雾状肺实变阴影,其中间还衬以增多增粗的肺纹理。特别值得注意的是与病变相间的肺组织完全正常,正常与异常的肺组织截然分开。
Murch等认为,这种CT表现不同于其他任何实变的肺部疾患。这种地图样的分布原因还不十分清楚,但据Singh等所做肺活检证实,其可能由于病变以肺小叶为单位;小叶间隔在一定程度上限制了病变的蔓延。另外可能和病变周围相对正常的肺组织存在一定程度代偿性肺气肿有关。即使是做过肺灌洗的患者,其剩余的肺实变仍然边界清楚,说明小叶间隔使病变边缘形成多角形、弧形或直线形。关于在肺实变中有增多、增粗和紊乱的肺间质纹理,有学者经肺活检证实其为小叶间隔或腺泡间隔水肿或者合并细胞浸润,并非肺纤维化。一般认为此病不伴有纵隔和肺门淋巴结肿大,其主要并发症是合并感染。
, http://www.100md.com
PAP 的肺功能检查示限制性通气功能障碍和弥散功能下降,血气分析示低氧血症。乳酸脱氢酶(LDH)轻至中度升高,但缺乏特异性,支气管肺泡灌洗液典型外观为米汤样混浊,沉淀涂片PAS 染色发现与病理组织一致的阳性富含磷脂物质,可帮助诊断。
确诊主要靠病理诊断,经纤支镜肺活检或开胸获取肺组织。支气管肺泡灌洗液呈乳白色,光镜下可见大量嗜酸颗粒,PAS染色阳性,电镜可见较多嗜锇性层状体,并可见肺泡Ⅱ型细胞。活检标本:光镜示肺泡和呼吸性细支气管管腔内充满致密、均质性蛋白样物质,可见大量嗜酸颗粒,PAS 染色阳性,AB 染色阴性;电镜观察肺泡Ⅱ型细胞增生,分泌增多,肺泡腔内有大量肺泡Ⅱ型细胞分泌的嗜锇性和絮状物质,以及肺间质变宽,成纤维细胞、胶原和弹力纤维增生,淋巴细胞浸润等改变。本患儿最后依靠特征性HRCT表现和肺活检病理结果确诊。
部分原发性PAP患者可不经任何治疗自愈,病情进展而明显影响呼吸功能者需积极治疗。但到目前为止尚无有效的药物治疗,支气管肺泡灌洗(BAL)仍是迄今为止惟一被证明行之有效的治疗方法。通过BAL 将肺泡内沉积物质排去,从而改善肺通气和换气功能,但很多情况下仅能暂时缓解症状,需定期反复进行。据文献报道,有部分PAP患者可不经治疗而自然缓解,故只有那些症状较明显,或由于长期缺氧已出现脏器损害的患者才需要进行BAL治疗。通常是在全麻下插入Carlen’s 双腔管作一侧全肺灌洗,另一侧肺行人工通气。每次灌洗量5~25 L 不等,直至流出的BALF基本澄清为止。一般不主张经纤维支气管镜行BAL,因受麻醉时间限制,灌洗持续时间短,且灌洗范围小。其他方法如使用胰酶和黏痰溶解剂呼吸道吸入治疗PAP,但药物难以到达远端气道和肺泡腔,故难以发挥作用,已被基本否定。曾有人报告1 例PAP 患者接受双侧肺移植后复发,说明PAP 是一全身性疾病,并非肺局部病变,肺移植并不能治愈本病。
, http://www.100md.com
有文献报告,自转基因动物实验发现GM-CSF缺乏可导致PAP,且PAP可被呼吸道局部GM-CSF 重建逆转。目前认为,对确证GM-CSF 缺乏或水平过低患者,GM-CSF 替代治疗可能会收到较好疗效。又如,动物实验发现骨髓移植可使βC受体缺乏小鼠肺部PAP 病理改变完全恢复,表明骨髓移植可能对部分被证明存在βC受体缺损的PAP 患者和继发于髓性白血病者将是一有效的治疗手段。对于继发性PAP患儿,主张以控制原发病为首要治疗要点,如脱离致病环境,减少有害物质吸入、积极治疗血液病和恶性肿瘤、调节患儿免疫功能等,同时给予上述针对肺泡蛋白沉积的相关治疗以期恢复呼吸功能,改善预后。
综上所述,PAP缺乏特征性临床表现,实验室检查目前亦无确诊本病的特异性指标,且肺部影像学表现与临床症状不平行,对本病相关知识缺乏了解时易于漏诊和误诊,故应引起相应重视。但随着HRCT检查的普遍开展,发现如前述的“铺路石”样等特殊改变,结合病史,常可发现与其他疾病鉴别之处,确诊尚需肺组织病理检查。对于本病患者,虽正规诊治前呼吸困难呈进行性加重,但经临床学者研究和实践,反复支气管肺泡灌洗的疗效已被广泛认可,患者肺通气和换气功能均能得到不同程度的改善;且随着对GM-CSF替代治疗和骨髓移植、基因治疗等手段研究的进展,PAP患者的预后尚有可观的前景。, 百拇医药