亚甲蓝抑制癌细胞DNA合成的光敏作用机理
作者:周秀芳 郑荣梁
单位:兰州大学生物系生物物理教研室*
关键词:亚甲蓝;光疗法;肝肿瘤;脱氧核糖核酸
中华医学杂志920211 摘要 不同浓度(38、3.8、0.38、0.038、0.0038umol/L)的亚甲蓝光敏反应,对腹水型肝癌细胞(AH)DNA合成具有很明显的抑制作用,其抑制作用随亚甲蓝浓度的增加和照光时间的延长而加剧,表明光敏作用的产生与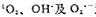 无关,而与H2O2密切相关.亚甲蓝光敏作用抑制AH细胞DNA合成的原因在于DNA复制的模板受到了损伤.
无关,而与H2O2密切相关.亚甲蓝光敏作用抑制AH细胞DNA合成的原因在于DNA复制的模板受到了损伤.
光敏反应可以用来诊断和治疗癌症,亚甲蓝是一种光敏剂,它又具有抗癌作用[1,2]。本实验就亚甲蓝的光敏作用对癌细胞DNA损伤的影响,及其机理进行了探讨.
, http://www.100md.com
材料与方法
1.试剂:亚甲蓝(上海试剂三厂产品)用灭菌无离子水配成103、102、101、1umol/L溶液.β-胡萝卜素,分析纯(Sigma公司产品)用1,2-丙二醇配成1mmol/L。组氨酸,分析纯(中国科学院生物化学研究所产品),用灭菌无离子水配成0.01mol/L。甘露醇,化学纯(成都化学试剂厂产品),用灭菌无离子水配成0.01m/L。超氧化物歧化酶(SOD),分析纯(军事医学科学院放射医学研究所产品),用灭菌无离子水配成2mglm/L。过氧化氢酶(CAT),分析纯(Sigma公司产品),用灭菌无离子水配成1mg/ml。
2.光源:1000W碘钨灯,光距37cm,用水隔热,水层厚16cm,玻璃厚0.5cm,光强度为4.2×104lx,亚甲蓝最大吸收波长为660nm,室温20℃左右。
3.DNA合成的测定:将昆明种小白鼠腹水肝癌细胞(AH)1×106/瓶,培养于含20%小牛血清的RPMI-1640培养液中,每瓶5ml,PH7.3,加青霉素100IU/ml及链霉素100ug/ml,置37℃,CO2培养箱15-20小时,再加不同浓度的亚甲蓝温育1小时后照光10分钟,然后加[3H]脱氧胸苷([3H]TdR,上海原子核研究所产品),终浓度为37kBq/ml,2或24小时后收获细胞,用生理盐水洗2次,除去亚甲蓝,干燥后加HCLO4和H2O2各1滴,在80℃烘箱消化40分钟,加闪烁液置FJ-2100全自动液体闪烁仪测其放射性。避光组在细胞瓶外包一层黑纸。
, 百拇医药
4.DNA损伤检测:AH细胞与亚甲蓝温育1小时后照光10分钟,用生理盐水洗2次除去亚甲蓝,加新鲜培养液继续温育0、2、4和6小时,再分别加入[3H] TdR,使终浓度为74kBq/ml,60分钟后测其放射性,如果清洗掉桑色素后一段时间内,DNA合成速率迅速恢复,属代谢型抑制,如果清洗掉亚甲蓝后合成速率继续下降,则为DNA模板损伤型。
结果
1.亚甲蓝的光敏作用:在亚甲蓝作用于时间(1小时)和照光(10分钟)相同的条件下,照光组细胞DNA合成明显下降,说明亚甲蓝光敏反应对癌细胞DNA合成有明显的抑制作用(图1),其抑制随亚甲蓝浓度的增加(0.0038、0.038、0.38、3.8、38umol/L)而加剧,抑制率高达99.7%[3]。
注:X=0.0038 umol/L;Xn=0.0038,0.038,0.38,3.8,38umol/L;与避光组比较**P<0.05***P<0.01
, 百拇医药
图1 不同浓度的亚甲蓝对AH细胞DNA合成的影响
2.不同照光时间对细胞DNA合成的影响:当亚甲蓝浓度(0.038,0.38umol/L)和作用时间(1小时)固定后,分别照光1、5、10和20分钟,发现随着照光时间的增加,DNA合成抑制加剧(图2)。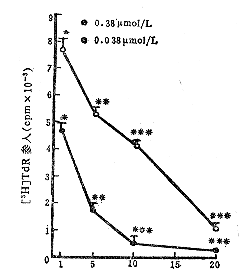
照光时间(min)
注:与对照组比较*P>0.05,**P<0.05,***P<0.01
图2 不同照光时间对AH细胞DNA合成的影响
3.DNA损伤检测结果:将亚甲蓝(0.038umol/L)与细胞温育1小时后照光10分钟,洗去亚甲蓝,细胞DNA合成抑制率迅速上升(图3),表明DNA合成速率的下降,估计亚甲蓝在光照下破坏了DNA复制的模板。
, 百拇医药
4.亚甲蓝光敏作用机制:将β-胡萝卜素,组氨酸,甘露醇和SOD分别与已加入亚甲蓝的AH细胞温育1小时,照光10分钟后24小时对细胞DNA合成无影响。在加入亚甲蓝的同时,加入过氧化氢酶(CAT),则对细胞有明显的保护作用,抑制率降低了52%。加入灭活的CAT,细胞DNA合成的抑制与对照组(只加亚甲蓝,不加清除剂)相近(附表)。
清除药物后时间(h)
图3 亚甲蓝(0.038umol/L)从培养基中清除后,DNA合成抑制率的变化
附表 不同自由基清除剂对亚甲蓝光敏反应的影响( s)
s)
亚甲蓝+自由基清除剂(ug/ml)
, http://www.100md.com
DNA合成(cpm×10-3)
亚甲蓝浓度0.38
(umol/L)0.038
对照组
7.8±0.7
16.9±0.7
β-胡萝卜素(20.6)
6.2±0.8*
8.9±0.2*
组氨酸(60.0)
6.4±1.2*
, 百拇医药
11.9±0.7*
甘露醇(20.0)
7.6±0.4*
16.6±0.6*
SOD(76.5)
7.5±1.0*
11.8±1.3*
灭活SOD(76.5)
7.5±0.1*
14.8±1.5*
CAT(38.4)
16.3±0.1**
, http://www.100md.com
25.3±1.1**
灭活CAT(38.4)
8.4±0.03*
16.5±1.1*
注:与对照组比较*P>0.05,**P<0.05讨论
β-胡萝卜素、组氨酸、甘露醇、SOD和(AT)分别是1O2,OH·O2·-和H2O2的有效清除剂[4,5],它们对AH细胞DNA合成没有什么影响,说明亚甲蓝光敏反应与1O2,OH·及O2·-无关(附表)。CAT对细胞有明显的保护作用,可见亚甲蓝光敏反应与H2O2密切相关。本结果与巨噬细胞[6]和四溴荧光素[7]杀伤癌细胞的光敏作用机理相同,本实验证实了亚甲蓝光敏作用对癌细胞DNA合成有明显的抑制作用。
, 百拇医药
参考文献
1.赖白塘,等.亚甲蓝抗肿瘤作用的研究.结核病与肺部肿瘤1988;2:1.
2.赖白塘,等.亚甲蓝体内抗肿瘤作用及药理学研究.中华肿瘤杂志1989;2:98.
3.Painter RB. Rapid test to detect agents that damage huyman DNA.Nature 1977;265:560.
4.Weitzman SA,Stossel TP.Effect of oxygen radical scavengers and antioxidants on phagocyte-induced mutagenesis.J Immunol 1982;128:2770.
5.McCord JM,Fridovich I.Superoxide dismutase:An enzymic function for erythrocuprein (hemocuprein).J Biol Chem 1969;244:6049.
6.Nathan CF,Cohn ZA.Antitumor effects of hydrogen peroxide in vivo.J Exp Med 1981;154:1539.
7.周秀芳,等.四溴荧光素对细胞杀伤作用的活性氧机理.中国药理学报1989;10:374.
*邮政编码 730000, http://www.100md.com
单位:兰州大学生物系生物物理教研室*
关键词:亚甲蓝;光疗法;肝肿瘤;脱氧核糖核酸
中华医学杂志920211 摘要 不同浓度(38、3.8、0.38、0.038、0.0038umol/L)的亚甲蓝光敏反应,对腹水型肝癌细胞(AH)DNA合成具有很明显的抑制作用,其抑制作用随亚甲蓝浓度的增加和照光时间的延长而加剧,表明光敏作用的产生与
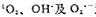 无关,而与H2O2密切相关.亚甲蓝光敏作用抑制AH细胞DNA合成的原因在于DNA复制的模板受到了损伤.
无关,而与H2O2密切相关.亚甲蓝光敏作用抑制AH细胞DNA合成的原因在于DNA复制的模板受到了损伤.光敏反应可以用来诊断和治疗癌症,亚甲蓝是一种光敏剂,它又具有抗癌作用[1,2]。本实验就亚甲蓝的光敏作用对癌细胞DNA损伤的影响,及其机理进行了探讨.
, http://www.100md.com
材料与方法
1.试剂:亚甲蓝(上海试剂三厂产品)用灭菌无离子水配成103、102、101、1umol/L溶液.β-胡萝卜素,分析纯(Sigma公司产品)用1,2-丙二醇配成1mmol/L。组氨酸,分析纯(中国科学院生物化学研究所产品),用灭菌无离子水配成0.01mol/L。甘露醇,化学纯(成都化学试剂厂产品),用灭菌无离子水配成0.01m/L。超氧化物歧化酶(SOD),分析纯(军事医学科学院放射医学研究所产品),用灭菌无离子水配成2mglm/L。过氧化氢酶(CAT),分析纯(Sigma公司产品),用灭菌无离子水配成1mg/ml。
2.光源:1000W碘钨灯,光距37cm,用水隔热,水层厚16cm,玻璃厚0.5cm,光强度为4.2×104lx,亚甲蓝最大吸收波长为660nm,室温20℃左右。
3.DNA合成的测定:将昆明种小白鼠腹水肝癌细胞(AH)1×106/瓶,培养于含20%小牛血清的RPMI-1640培养液中,每瓶5ml,PH7.3,加青霉素100IU/ml及链霉素100ug/ml,置37℃,CO2培养箱15-20小时,再加不同浓度的亚甲蓝温育1小时后照光10分钟,然后加[3H]脱氧胸苷([3H]TdR,上海原子核研究所产品),终浓度为37kBq/ml,2或24小时后收获细胞,用生理盐水洗2次,除去亚甲蓝,干燥后加HCLO4和H2O2各1滴,在80℃烘箱消化40分钟,加闪烁液置FJ-2100全自动液体闪烁仪测其放射性。避光组在细胞瓶外包一层黑纸。
, 百拇医药
4.DNA损伤检测:AH细胞与亚甲蓝温育1小时后照光10分钟,用生理盐水洗2次除去亚甲蓝,加新鲜培养液继续温育0、2、4和6小时,再分别加入[3H] TdR,使终浓度为74kBq/ml,60分钟后测其放射性,如果清洗掉桑色素后一段时间内,DNA合成速率迅速恢复,属代谢型抑制,如果清洗掉亚甲蓝后合成速率继续下降,则为DNA模板损伤型。
结果
1.亚甲蓝的光敏作用:在亚甲蓝作用于时间(1小时)和照光(10分钟)相同的条件下,照光组细胞DNA合成明显下降,说明亚甲蓝光敏反应对癌细胞DNA合成有明显的抑制作用(图1),其抑制随亚甲蓝浓度的增加(0.0038、0.038、0.38、3.8、38umol/L)而加剧,抑制率高达99.7%[3]。

注:X=0.0038 umol/L;Xn=0.0038,0.038,0.38,3.8,38umol/L;与避光组比较**P<0.05***P<0.01
, 百拇医药
图1 不同浓度的亚甲蓝对AH细胞DNA合成的影响
2.不同照光时间对细胞DNA合成的影响:当亚甲蓝浓度(0.038,0.38umol/L)和作用时间(1小时)固定后,分别照光1、5、10和20分钟,发现随着照光时间的增加,DNA合成抑制加剧(图2)。

照光时间(min)
注:与对照组比较*P>0.05,**P<0.05,***P<0.01
图2 不同照光时间对AH细胞DNA合成的影响
3.DNA损伤检测结果:将亚甲蓝(0.038umol/L)与细胞温育1小时后照光10分钟,洗去亚甲蓝,细胞DNA合成抑制率迅速上升(图3),表明DNA合成速率的下降,估计亚甲蓝在光照下破坏了DNA复制的模板。
, 百拇医药
4.亚甲蓝光敏作用机制:将β-胡萝卜素,组氨酸,甘露醇和SOD分别与已加入亚甲蓝的AH细胞温育1小时,照光10分钟后24小时对细胞DNA合成无影响。在加入亚甲蓝的同时,加入过氧化氢酶(CAT),则对细胞有明显的保护作用,抑制率降低了52%。加入灭活的CAT,细胞DNA合成的抑制与对照组(只加亚甲蓝,不加清除剂)相近(附表)。

清除药物后时间(h)
图3 亚甲蓝(0.038umol/L)从培养基中清除后,DNA合成抑制率的变化
附表 不同自由基清除剂对亚甲蓝光敏反应的影响(
 s)
s)亚甲蓝+自由基清除剂(ug/ml)
, http://www.100md.com
DNA合成(cpm×10-3)
亚甲蓝浓度0.38
(umol/L)0.038
对照组
7.8±0.7
16.9±0.7
β-胡萝卜素(20.6)
6.2±0.8*
8.9±0.2*
组氨酸(60.0)
6.4±1.2*
, 百拇医药
11.9±0.7*
甘露醇(20.0)
7.6±0.4*
16.6±0.6*
SOD(76.5)
7.5±1.0*
11.8±1.3*
灭活SOD(76.5)
7.5±0.1*
14.8±1.5*
CAT(38.4)
16.3±0.1**
, http://www.100md.com
25.3±1.1**
灭活CAT(38.4)
8.4±0.03*
16.5±1.1*
注:与对照组比较*P>0.05,**P<0.05讨论
β-胡萝卜素、组氨酸、甘露醇、SOD和(AT)分别是1O2,OH·O2·-和H2O2的有效清除剂[4,5],它们对AH细胞DNA合成没有什么影响,说明亚甲蓝光敏反应与1O2,OH·及O2·-无关(附表)。CAT对细胞有明显的保护作用,可见亚甲蓝光敏反应与H2O2密切相关。本结果与巨噬细胞[6]和四溴荧光素[7]杀伤癌细胞的光敏作用机理相同,本实验证实了亚甲蓝光敏作用对癌细胞DNA合成有明显的抑制作用。
, 百拇医药
参考文献
1.赖白塘,等.亚甲蓝抗肿瘤作用的研究.结核病与肺部肿瘤1988;2:1.
2.赖白塘,等.亚甲蓝体内抗肿瘤作用及药理学研究.中华肿瘤杂志1989;2:98.
3.Painter RB. Rapid test to detect agents that damage huyman DNA.Nature 1977;265:560.
4.Weitzman SA,Stossel TP.Effect of oxygen radical scavengers and antioxidants on phagocyte-induced mutagenesis.J Immunol 1982;128:2770.
5.McCord JM,Fridovich I.Superoxide dismutase:An enzymic function for erythrocuprein (hemocuprein).J Biol Chem 1969;244:6049.
6.Nathan CF,Cohn ZA.Antitumor effects of hydrogen peroxide in vivo.J Exp Med 1981;154:1539.
7.周秀芳,等.四溴荧光素对细胞杀伤作用的活性氧机理.中国药理学报1989;10:374.
*邮政编码 730000, http://www.100md.com