甲状旁腺激素的分子生物学研究进展
作者:张克勤
单位:210002 南京军区总医院内分泌科
关键词:
中华医学杂志930622 本文综述了近几年在基因水平甲状旁腺激素(parathyroid hormone,PTH)的研究成果,旨在为甲状旁腺疾病的诊断和治疗提供分子遗传学方面的认识。
一、PTH分子及其基因的重量结构与功能
PTH的合成主要遵循典型的胞内多肽合成途径,其前体前甲状旁腺激素原(PreProPTH)为115肽,在粗面内质网合成后N-端25个氨基酸(Pre部分)被信号肽酶切去,降解为激素原(ProPTH),ProPTH在高尔基体中N-端被进一步切去6肽(Pro部分),组装成有生物活性的PTH分泌颗粒。
, 百拇医药 PreProPTH(图1)的pre部分被称为信号肽,能引导合成后的多肽链穿透内质网膜转运,Pro部分6肽中前4个氨基酸随种属不同变异较大,后2个氨基酸(赖-精)则高度保守,可能有防止翻译后的活性PTH与其他肽类拼接〔1〕,以及保证信号肽酶对Pre部分的准确切除作用〔2〕。
蛋—异亮—脯—丙—赖—天冬—蛋—丙—
赖—缬—蛋—异亮—缬—蛋—亮—亮—丙—
—异亮—半胱—苯丙—亮—苏—赖—丝—天冬—
—甘—赖—丝—缬—赖—赖—精—PTH1-84
←—Pre|←——————Pro——————→|
图1 前甲状旁腺激素原的PrePro部分氨基酸序列图
, 百拇医药
PTH的分子结构与功能特点有:(1)血池中分子多态性;(2)功能区相对集中于N-端;(3)受体结合区域与激活受体的区域不完全重叠,即使同一位点,对受体的结合与激活能力也不一致。PTH在血中主要有PTH1-84、PTH1-34和PTH56-843种形式,其中PTH1-34具有PTH1-84完全一致的生活活性。主要受体结合位点在1-6,它的切除会导致全部活性丧失,但7-344-34,25-34及10-27肽段也有较弱的受体亲和力。Gardella等〔3〕将PTH基因1—4位密码子进行人工化学合成造突变,然后在体外细胞表达得到1—4位分别被其他氨基酸替代的突变型PTH:其中第3位丝氨酸若被异亮氨酸或苏氨酸取代,则活性下降较少,这可能与前两种氨基酸侧链较长有关;第1位也是类似情况;第2位缬氨酸被其他任何氨基酸取代都几乎完全失活,但与受体结合力下降不太大,可能与缬氨酸不影响二级结构有关;第4位谷氨酸被其他任何氨基酸取代后生物活性、受体结合力均大大下降,这可能与PTH立体构型被破坏有关,因为核磁共振分析谷氨酸的羧基与32位组氨酸的咪唑基形成盐桥。
, 百拇医药
Vasicek等〔1〕将人类胎肝基因组DNA文库建立在噬菌体中,筛选出含完整PTH基因的噬菌体,用化学法分析得到PTH基因碱基顺序(图2)。其特点有:(1)细胞只有一个PTH基因;(2)有3个外显子,由两段插入顺序(内含子)将它们隔开,其中第1外显子无编码肽链功能;(3)编码Pro的前4个与后2个密码子被第2内含子隔开;(4)在-3699到-3686区可能会形成Z-DNA结构;(5)没有体内基因重组。有关PTH基因调控机制了解尚不多,Okazaki等〔4〕最近证实PreProPTH基因上游-2.4~-3.6kb片段的两端各有一个抑制PreProPTH基因转录的位点,某些未知的核内因子与之结合后可抑制转录。但这种抑制作用要以5′端邻接区684bp的存在为前提。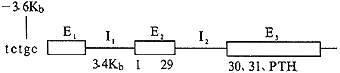
E1、E2和E3为外显子;I1和I2为内含子;1-31、PTH为密码子顺序
, 百拇医药
图2 PTH基因模式图
二、PTH基因的病理结构与功能
(一)甲状旁腺功能减低证(简称甲旁低):散发性特发性甲旁低及假性、假假性甲旁低的病因已有论述。近年对下述两种甲旁低的病因有进一步认识:
1.家族性特发性甲旁低(familial idiopathic hypoparathyroidism,FIH):表现为PTH免疫活性及生物活性的减低,其遗传方式可以是常染色体显性、隐性和X边锁遗传。Ahn等〔5〕用两种限制性片段长度多态性(RFLP)的遗传特征,发现8个家系中有2个家系(C、C家系)患者表现型与某种等位基因遗传关联密切,提示可能有PTH结构基因突变。其他家系患者与这两种内切酶的RFLP遗传特征关联不明显。说明(1)可能选用内切酶种类不够多,即使PTH结构基因异常也未检出;(2)突变不在PTH结构基因区。提示FIH分子遗传方式的多样性。
, 百拇医药
Arnold等〔6〕明确了上述家系患者基因突变部位,他们将患者白细胞DNA转移到噬菌体EMBL3内建立基因文库,筛选出含PTH基因的噬菌体,分两步将此基因克隆到噬菌体M13mp18及M13mp19进行双脱氧法序列分析,发现编码PreProPTH第18位半胱氨酸密码子中的T换成C;作者再把此家族内患者与非患者的PTH基因经聚合酶链反应(PCR)扩增后进行序列分析进一步验证了上述发现。此患者基因在体外转录—翻译系统表达后所获PreProPTH产物与正常基因相似,但只有4.7%转化成ProPTH(正常达75%)。推测18位亲水性的精氨酸代替疏水性的半胱氨酸后使信号肽疏水核心(第10—21位氨基酸组成)被破坏,使跨膜转运功能受损。
2.PTH分子异常导致甲旁低:McElduff等〔7〕发现1例家族性甲旁低患者PTH受体及受体后反应正常,但其血浆对3种抗体中的各种反应不与标准曲线平行,另一种抗体主要结合牛PTH,但可测到此例患者血中PTH;高压液相色谱分析发现了个异常疏水组分,其中含免疫反应性PTH。这些间接证据提示PTH分子结构异常而导致PTH失活。
, 百拇医药
(二)甲状旁腺机能亢进证(甲旁亢):
1.多发性内分泌腺瘤Ⅰ型(MEN-1):MEN-1通常以常染色体显性遗传,MEM-1基因位于染色体11q13区,更确切的定位尚不清楚。Friedman等〔8〕用8种探针针对11p的PTH、INS基因和11q和D11S149、PYGM、D11S146、INT2、D11S147和D11S144探针分别与患者甲状旁腺瘤细胞DNA和外周血白细胞DNA杂交,发现患者白细胞11号染色体基因完整,但14例EMN-1共16个甲状旁腺瘤中有10个发生了11号染色体上基因缺失,虽然患者之间缺失位点数量不同,但都在11q区至少缺失一位点。43例散发性甲状旁腺瘤患者有9例发生基因缺失。由于有基因缺失的肿瘤比无基因缺失的肿瘤体积大(均数分别为1.6及0.2g,P<0.002),认为可能在多克隆增生的基础上11号染色体基因缺失导致发生单克隆腺瘤。Thakker等〔9〕证实了同样的结果并提出MEN-1发生机理的二步隐性突变学说,即第一次隐性突变(目前尚未找到)使细胞产生了肿瘤发生倾向,第二次隐性突变消除了正常等位基因,可使第一次突变外显致肿瘤发生;散发性与家族性MEN-1的突变方式有所不同,散发性MEN-1于体细胞内发生两种突变,家族性MEN-1体细胞仅发生在第二步突变,第一步突变通过亲代生殖细胞就遗传下来了。部分MEN-1患者并未发生基因缺失,说明MEN-1的多因性,也可能肿瘤进一步发展才会产生等位基因缺失。
, 百拇医药
2.散发性甲状旁腺瘤:部分患者也有11号染色体等位基因缺失〔8〕。此外Arnold等〔10〕及Friedman等〔11〕还在总共86例患者中发现3例PTH基因与PTH基因外的基因(非PTH基因)发生重组,非PTH基因插入到外显子Ⅰ与Ⅱ之间;进一步用原位杂交证实为同一染色体内重组,位于11q13的非PTH基因区D11S287与位于11p15的PTH基因发生重组,重组的结果是把来自11q13区的基因置于活跃的PTH调节基因影响下,可以激活癌基因,也可以使肿瘤抑制基因失活。虽然目前尚未发现11号染色体上H-ras、N-ras和K-ras癌基因被突变激活〔11〕,但发现D11S287E在甲状腺腺瘤有过度表达〔12〕,它被认为可能为癌基因。
分子生物学手段的应用不但进一步揭示了上棕类型甲旁低、甲旁亢的病因,而且为有时颇为困难的甲状旁腺腺瘤、增生与腺癌的病理学鉴别提供了手段。Kendall等〔13〕用PTHcDNA为模版人工合成寡核苷酸链作探针,在探针3′端标记d-UTP-11地高辛配基,对7例正常甲状旁腺、25例增生、18例腺瘤和4例腺癌的常规切片进行原位杂交,用抗地高辛配基碱性磷酸酶作组化染色观察mRNA表达情况。结果见正常甲状旁腺组织呈弥漫性簇状细胞表达;增生组织表达细胞比例高,呈密集状态,但就单个细胞而言表达程度同正常组织有表达的细胞一样,增生者22例中12例有明显结节变,结节区细胞表达均匀,且各个结节一致;腺瘤组织有表达的细胞比例也比正常组织高,但密集性远不如增生组织,腺瘤边缘甲旁腺组织显色正常;例外的是2例MEN-1甲旁腺有广泛嗜酸变,其mRNA表达程度低。腺癌组织mRNA表达为局灶性增强,各例之间表达程度变化大,有明显侵独现象者mRNA表达程度低。此方法对结节样增生、腺瘤和腺癌鉴别意义较大。
, 百拇医药
三、PTH的基因工程
PTH的基因工程生产必将为甲旁低的治疗开辟一条较理想的途径。目前各家通过以下两种手段提高产量、纯度和方便提纯。
(一)引入强有力的启动子及构建融合蛋白基因:引入强有力的启动子能加速转录。已证实单纯PTH基因插入到大肠村菌表达产量很低,而融合mRNA或蛋白质稳定性高,不易被立即降解,有助于提高PTH产量。德国的Wingender等〔14〕在含hPTH基因组的Cos质粒克隆得到编码PTH10-84的基因片段,N端9个氨基酸及其前面一个额外的脯氨酸密码子为人工合成,整个序列克隆于质粒PEX,与其中的顺式-β-半乳糖苷酶的Z基因的3′-端连接,再转移到大肠杆菌N4830中。其表达的融合蛋白有3个特点:(1)表达效益高,占细菌蛋白50%以上;(2)PTH序列所占比例高;(3)具有遇酸不稳定的天冬氨酸-脯氨酸连接点,便于切开真核和原核细胞的蛋白。脯〔-1〕hPTH与hPTH生物活性一致,-1位脯氨酸具有防止氨基酸肽酶水解作用,延长脯〔-1〕hPTH的半衰基,最终的纯品产量达每升培养液3~5mg。美国的Gardella等〔15〕在生长激素(GH)表达质粒pGH-L9中将trp启动子-GH基因的C-端切开,插入凝血因子Xa(激活态)的切割位点,再连上PTH基因,构建成的质粒pGHP-1在大肠杆菌中表达,融合蛋白产量可达50mg/L,Xa可以在相应位点内准确切除,得到PTH1-841.5~3mg/L,且无PTH其他片段混杂。挪威的Hφgest等〔16〕在PTH基因N-端连接葡萄球菌蛋白A的启动子及信号肽基因,所表达的融合蛋白能被信号肽高效地引导跨膜转运且导致信号肽被切除,培养基纯化后PTH1-84达90%以上,但混有少量其他PTH分子片段。
, 百拇医药
(二)氨基端碱基改造:加拿大的Sung等〔17〕证实PTH基因N-端1-5密码子含较弱的核蛋白体结合顺序,会阻扰翻译进行,使翻译在第8密码子开始,故而实际上基因工程产物为PTH1-84及PTH8-84混合物(2∶1),且产量很低(分别为0.2及0.1mg/L)。作者在保持N-端氨基酸顺序不变的前提下,将1-5位密码人工合成,使每个密码子第3碱基全部换成A,则产量大增,且产物为单组分PTH1-84,如改造后的pPTH-AA-Eco 1-5位密码子为TCA、GTA、TCA、GAA、ATA,表达后产量达20mg/L。认为mRNA氨基端与核糖体结合位点间会形成“发夹结构”(mRNA的二级结构),能障较大,若1-5位密码子中富含A,则“发夹结构”减弱,能障减少,PTH翻译加速〔18〕。
本文蒙南京医学院第一附属医院陈家伟教授审校,特致谢
参考文献
, http://www.100md.com
1 Vasicek TJ.McDevitt BE,Freeman MW,et al.Nucleotide sequences of the human parathyroid hormone gene.Proc Natl Acad Sci USA,1983,80:2127.
2 Wiren KM,Potts JT Jr,Kronenberg HM,et al.Importance of the propeptide sequence of human preproparathyroid hormone for signal sequence function.J Biol Chem,1988,263:19771.
3 Gardella TJ,Axelrod D,Rubin D,et al.Mutational analysis of the receptor-activating region of human parathyroid hormone.J Biol Chem,1991,266:1341.
, 百拇医药
4 Okazaki T,Zajac JD.Igarashi T,et al.Negative regulatory elements in the human parathyroid hormone gene.J Biol Chem,1991,266:21903.
5 Ahn TG,Antonarakis SE,Kronenberg HM,et al.Familial isolated hypoparthyroidism:a molecular genetic analysis of 8 families with 23 affected persons.Medicine (Baltimore),1986,65:73.
6 Arnold A,Horst SA,Gardella TJ,et al.Mutation of the signal peptide-encoding region of the preproparathyroid hormone gene in familial isolated hypoparathyroidism.J Clin Invest,1990,86:1084.
, http://www.100md.com
7 McElduff A,Wilkinson M,Lackmann M,et al.Familial hypoparathyroidism due to an abnormal parathyroid hormone molecule.Aust N Z J Med,1989,19:22.
8 Frideman E,Sakaguchi K,Bale AE,et al.Clonality of parathyroid tumors in familial multiple endocrine neoplasia type1. N Eng1 J Med,1989,321:213.
9 Thakker RV,Bouloux P,Wooding C,et al.Association of parathyroid tumors in multiple endocrine neoplasia type 1 with loss of alleles on chromosome 11. N Eng1 J Med,1989,321:218.
, 百拇医药
10 Arnold A,Kim HG,Gaz RD,et al.Molecular cloning and chromosomal mapping of DNA rearranged with the parathyroid hormone gene in a parathyroid adenoma.J Clin Invest 1989;83:2034.
11 Friedman E,Bale AE,Marx SJ,et al.Genetic abnormalities in sporadic adenomas.J Clin Endocrinol Metab,1990,71:293.
12 Rosenberg CL,Kim HG,Shows TB,et al.Arnold A:rearrangement and overexpression of D11S287E,a candidate oncogene on chromosome 11q13 in benign parathyroid tumors.Oncogene,1991,6:449.
, 百拇医药
13 Kendall CH,Roberts PA,Pringle JH,et al.The expression of parathyroid hormone messenger RNA in normal and abnormal parathyroid tissue,J Pathol,1991,165:111.
14 Wingender E,Bercz G,Blocker H,et al.Expression of human parathyroid hormone in Escherichia coli.J Biol Chen,1989,264:4367.
15 Gardella TJ,Rubin D,Abou-Samra AB,et al.Expression of human parathyroid hormone-(1-84) in Escherichia coli as a factor Xcleavable fusion protein.J Biol Chem,1990,265:15854.
, http://www.100md.com
16 Hφgset A,Blingsmo OR,Saether O,et al.Expression and characterization of a recombinent human parathyroid hormone secreted by Escherichia coli emplying the staphylococcal protein A promoter and signal sequence.J Biol Chem,1990,265:7338.
17 Sung WL,Luk CK,Zahab DM,et al.Internal ribosome-binding site directs expression of parathyroid hormone analogue (8-84) in Escherichia coli.Biochem Biophys Res COmmun,1991,181:481.
18 Sung WL,Zahab DM,Barbier JR,et al.Specific degenerate codons enhanced selective expression of human parathyroid hormone in Escherichia coli.J Biol Chem,1991,266:2831.
(收稿:1992-08-03 修回:1993-01-20), 百拇医药
单位:210002 南京军区总医院内分泌科
关键词:
中华医学杂志930622 本文综述了近几年在基因水平甲状旁腺激素(parathyroid hormone,PTH)的研究成果,旨在为甲状旁腺疾病的诊断和治疗提供分子遗传学方面的认识。
一、PTH分子及其基因的重量结构与功能
PTH的合成主要遵循典型的胞内多肽合成途径,其前体前甲状旁腺激素原(PreProPTH)为115肽,在粗面内质网合成后N-端25个氨基酸(Pre部分)被信号肽酶切去,降解为激素原(ProPTH),ProPTH在高尔基体中N-端被进一步切去6肽(Pro部分),组装成有生物活性的PTH分泌颗粒。
, 百拇医药 PreProPTH(图1)的pre部分被称为信号肽,能引导合成后的多肽链穿透内质网膜转运,Pro部分6肽中前4个氨基酸随种属不同变异较大,后2个氨基酸(赖-精)则高度保守,可能有防止翻译后的活性PTH与其他肽类拼接〔1〕,以及保证信号肽酶对Pre部分的准确切除作用〔2〕。
蛋—异亮—脯—丙—赖—天冬—蛋—丙—
赖—缬—蛋—异亮—缬—蛋—亮—亮—丙—
—异亮—半胱—苯丙—亮—苏—赖—丝—天冬—
—甘—赖—丝—缬—赖—赖—精—PTH1-84
←—Pre|←——————Pro——————→|
图1 前甲状旁腺激素原的PrePro部分氨基酸序列图
, 百拇医药
PTH的分子结构与功能特点有:(1)血池中分子多态性;(2)功能区相对集中于N-端;(3)受体结合区域与激活受体的区域不完全重叠,即使同一位点,对受体的结合与激活能力也不一致。PTH在血中主要有PTH1-84、PTH1-34和PTH56-843种形式,其中PTH1-34具有PTH1-84完全一致的生活活性。主要受体结合位点在1-6,它的切除会导致全部活性丧失,但7-344-34,25-34及10-27肽段也有较弱的受体亲和力。Gardella等〔3〕将PTH基因1—4位密码子进行人工化学合成造突变,然后在体外细胞表达得到1—4位分别被其他氨基酸替代的突变型PTH:其中第3位丝氨酸若被异亮氨酸或苏氨酸取代,则活性下降较少,这可能与前两种氨基酸侧链较长有关;第1位也是类似情况;第2位缬氨酸被其他任何氨基酸取代都几乎完全失活,但与受体结合力下降不太大,可能与缬氨酸不影响二级结构有关;第4位谷氨酸被其他任何氨基酸取代后生物活性、受体结合力均大大下降,这可能与PTH立体构型被破坏有关,因为核磁共振分析谷氨酸的羧基与32位组氨酸的咪唑基形成盐桥。
, 百拇医药
Vasicek等〔1〕将人类胎肝基因组DNA文库建立在噬菌体中,筛选出含完整PTH基因的噬菌体,用化学法分析得到PTH基因碱基顺序(图2)。其特点有:(1)细胞只有一个PTH基因;(2)有3个外显子,由两段插入顺序(内含子)将它们隔开,其中第1外显子无编码肽链功能;(3)编码Pro的前4个与后2个密码子被第2内含子隔开;(4)在-3699到-3686区可能会形成Z-DNA结构;(5)没有体内基因重组。有关PTH基因调控机制了解尚不多,Okazaki等〔4〕最近证实PreProPTH基因上游-2.4~-3.6kb片段的两端各有一个抑制PreProPTH基因转录的位点,某些未知的核内因子与之结合后可抑制转录。但这种抑制作用要以5′端邻接区684bp的存在为前提。
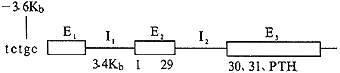
E1、E2和E3为外显子;I1和I2为内含子;1-31、PTH为密码子顺序
, 百拇医药
图2 PTH基因模式图
二、PTH基因的病理结构与功能
(一)甲状旁腺功能减低证(简称甲旁低):散发性特发性甲旁低及假性、假假性甲旁低的病因已有论述。近年对下述两种甲旁低的病因有进一步认识:
1.家族性特发性甲旁低(familial idiopathic hypoparathyroidism,FIH):表现为PTH免疫活性及生物活性的减低,其遗传方式可以是常染色体显性、隐性和X边锁遗传。Ahn等〔5〕用两种限制性片段长度多态性(RFLP)的遗传特征,发现8个家系中有2个家系(C、C家系)患者表现型与某种等位基因遗传关联密切,提示可能有PTH结构基因突变。其他家系患者与这两种内切酶的RFLP遗传特征关联不明显。说明(1)可能选用内切酶种类不够多,即使PTH结构基因异常也未检出;(2)突变不在PTH结构基因区。提示FIH分子遗传方式的多样性。
, 百拇医药
Arnold等〔6〕明确了上述家系患者基因突变部位,他们将患者白细胞DNA转移到噬菌体EMBL3内建立基因文库,筛选出含PTH基因的噬菌体,分两步将此基因克隆到噬菌体M13mp18及M13mp19进行双脱氧法序列分析,发现编码PreProPTH第18位半胱氨酸密码子中的T换成C;作者再把此家族内患者与非患者的PTH基因经聚合酶链反应(PCR)扩增后进行序列分析进一步验证了上述发现。此患者基因在体外转录—翻译系统表达后所获PreProPTH产物与正常基因相似,但只有4.7%转化成ProPTH(正常达75%)。推测18位亲水性的精氨酸代替疏水性的半胱氨酸后使信号肽疏水核心(第10—21位氨基酸组成)被破坏,使跨膜转运功能受损。
2.PTH分子异常导致甲旁低:McElduff等〔7〕发现1例家族性甲旁低患者PTH受体及受体后反应正常,但其血浆对3种抗体中的各种反应不与标准曲线平行,另一种抗体主要结合牛PTH,但可测到此例患者血中PTH;高压液相色谱分析发现了个异常疏水组分,其中含免疫反应性PTH。这些间接证据提示PTH分子结构异常而导致PTH失活。
, 百拇医药
(二)甲状旁腺机能亢进证(甲旁亢):
1.多发性内分泌腺瘤Ⅰ型(MEN-1):MEN-1通常以常染色体显性遗传,MEM-1基因位于染色体11q13区,更确切的定位尚不清楚。Friedman等〔8〕用8种探针针对11p的PTH、INS基因和11q和D11S149、PYGM、D11S146、INT2、D11S147和D11S144探针分别与患者甲状旁腺瘤细胞DNA和外周血白细胞DNA杂交,发现患者白细胞11号染色体基因完整,但14例EMN-1共16个甲状旁腺瘤中有10个发生了11号染色体上基因缺失,虽然患者之间缺失位点数量不同,但都在11q区至少缺失一位点。43例散发性甲状旁腺瘤患者有9例发生基因缺失。由于有基因缺失的肿瘤比无基因缺失的肿瘤体积大(均数分别为1.6及0.2g,P<0.002),认为可能在多克隆增生的基础上11号染色体基因缺失导致发生单克隆腺瘤。Thakker等〔9〕证实了同样的结果并提出MEN-1发生机理的二步隐性突变学说,即第一次隐性突变(目前尚未找到)使细胞产生了肿瘤发生倾向,第二次隐性突变消除了正常等位基因,可使第一次突变外显致肿瘤发生;散发性与家族性MEN-1的突变方式有所不同,散发性MEN-1于体细胞内发生两种突变,家族性MEN-1体细胞仅发生在第二步突变,第一步突变通过亲代生殖细胞就遗传下来了。部分MEN-1患者并未发生基因缺失,说明MEN-1的多因性,也可能肿瘤进一步发展才会产生等位基因缺失。
, 百拇医药
2.散发性甲状旁腺瘤:部分患者也有11号染色体等位基因缺失〔8〕。此外Arnold等〔10〕及Friedman等〔11〕还在总共86例患者中发现3例PTH基因与PTH基因外的基因(非PTH基因)发生重组,非PTH基因插入到外显子Ⅰ与Ⅱ之间;进一步用原位杂交证实为同一染色体内重组,位于11q13的非PTH基因区D11S287与位于11p15的PTH基因发生重组,重组的结果是把来自11q13区的基因置于活跃的PTH调节基因影响下,可以激活癌基因,也可以使肿瘤抑制基因失活。虽然目前尚未发现11号染色体上H-ras、N-ras和K-ras癌基因被突变激活〔11〕,但发现D11S287E在甲状腺腺瘤有过度表达〔12〕,它被认为可能为癌基因。
分子生物学手段的应用不但进一步揭示了上棕类型甲旁低、甲旁亢的病因,而且为有时颇为困难的甲状旁腺腺瘤、增生与腺癌的病理学鉴别提供了手段。Kendall等〔13〕用PTHcDNA为模版人工合成寡核苷酸链作探针,在探针3′端标记d-UTP-11地高辛配基,对7例正常甲状旁腺、25例增生、18例腺瘤和4例腺癌的常规切片进行原位杂交,用抗地高辛配基碱性磷酸酶作组化染色观察mRNA表达情况。结果见正常甲状旁腺组织呈弥漫性簇状细胞表达;增生组织表达细胞比例高,呈密集状态,但就单个细胞而言表达程度同正常组织有表达的细胞一样,增生者22例中12例有明显结节变,结节区细胞表达均匀,且各个结节一致;腺瘤组织有表达的细胞比例也比正常组织高,但密集性远不如增生组织,腺瘤边缘甲旁腺组织显色正常;例外的是2例MEN-1甲旁腺有广泛嗜酸变,其mRNA表达程度低。腺癌组织mRNA表达为局灶性增强,各例之间表达程度变化大,有明显侵独现象者mRNA表达程度低。此方法对结节样增生、腺瘤和腺癌鉴别意义较大。
, 百拇医药
三、PTH的基因工程
PTH的基因工程生产必将为甲旁低的治疗开辟一条较理想的途径。目前各家通过以下两种手段提高产量、纯度和方便提纯。
(一)引入强有力的启动子及构建融合蛋白基因:引入强有力的启动子能加速转录。已证实单纯PTH基因插入到大肠村菌表达产量很低,而融合mRNA或蛋白质稳定性高,不易被立即降解,有助于提高PTH产量。德国的Wingender等〔14〕在含hPTH基因组的Cos质粒克隆得到编码PTH10-84的基因片段,N端9个氨基酸及其前面一个额外的脯氨酸密码子为人工合成,整个序列克隆于质粒PEX,与其中的顺式-β-半乳糖苷酶的Z基因的3′-端连接,再转移到大肠杆菌N4830中。其表达的融合蛋白有3个特点:(1)表达效益高,占细菌蛋白50%以上;(2)PTH序列所占比例高;(3)具有遇酸不稳定的天冬氨酸-脯氨酸连接点,便于切开真核和原核细胞的蛋白。脯〔-1〕hPTH与hPTH生物活性一致,-1位脯氨酸具有防止氨基酸肽酶水解作用,延长脯〔-1〕hPTH的半衰基,最终的纯品产量达每升培养液3~5mg。美国的Gardella等〔15〕在生长激素(GH)表达质粒pGH-L9中将trp启动子-GH基因的C-端切开,插入凝血因子Xa(激活态)的切割位点,再连上PTH基因,构建成的质粒pGHP-1在大肠杆菌中表达,融合蛋白产量可达50mg/L,Xa可以在相应位点内准确切除,得到PTH1-841.5~3mg/L,且无PTH其他片段混杂。挪威的Hφgest等〔16〕在PTH基因N-端连接葡萄球菌蛋白A的启动子及信号肽基因,所表达的融合蛋白能被信号肽高效地引导跨膜转运且导致信号肽被切除,培养基纯化后PTH1-84达90%以上,但混有少量其他PTH分子片段。
, 百拇医药
(二)氨基端碱基改造:加拿大的Sung等〔17〕证实PTH基因N-端1-5密码子含较弱的核蛋白体结合顺序,会阻扰翻译进行,使翻译在第8密码子开始,故而实际上基因工程产物为PTH1-84及PTH8-84混合物(2∶1),且产量很低(分别为0.2及0.1mg/L)。作者在保持N-端氨基酸顺序不变的前提下,将1-5位密码人工合成,使每个密码子第3碱基全部换成A,则产量大增,且产物为单组分PTH1-84,如改造后的pPTH-AA-Eco 1-5位密码子为TCA、GTA、TCA、GAA、ATA,表达后产量达20mg/L。认为mRNA氨基端与核糖体结合位点间会形成“发夹结构”(mRNA的二级结构),能障较大,若1-5位密码子中富含A,则“发夹结构”减弱,能障减少,PTH翻译加速〔18〕。
本文蒙南京医学院第一附属医院陈家伟教授审校,特致谢
参考文献
, http://www.100md.com
1 Vasicek TJ.McDevitt BE,Freeman MW,et al.Nucleotide sequences of the human parathyroid hormone gene.Proc Natl Acad Sci USA,1983,80:2127.
2 Wiren KM,Potts JT Jr,Kronenberg HM,et al.Importance of the propeptide sequence of human preproparathyroid hormone for signal sequence function.J Biol Chem,1988,263:19771.
3 Gardella TJ,Axelrod D,Rubin D,et al.Mutational analysis of the receptor-activating region of human parathyroid hormone.J Biol Chem,1991,266:1341.
, 百拇医药
4 Okazaki T,Zajac JD.Igarashi T,et al.Negative regulatory elements in the human parathyroid hormone gene.J Biol Chem,1991,266:21903.
5 Ahn TG,Antonarakis SE,Kronenberg HM,et al.Familial isolated hypoparthyroidism:a molecular genetic analysis of 8 families with 23 affected persons.Medicine (Baltimore),1986,65:73.
6 Arnold A,Horst SA,Gardella TJ,et al.Mutation of the signal peptide-encoding region of the preproparathyroid hormone gene in familial isolated hypoparathyroidism.J Clin Invest,1990,86:1084.
, http://www.100md.com
7 McElduff A,Wilkinson M,Lackmann M,et al.Familial hypoparathyroidism due to an abnormal parathyroid hormone molecule.Aust N Z J Med,1989,19:22.
8 Frideman E,Sakaguchi K,Bale AE,et al.Clonality of parathyroid tumors in familial multiple endocrine neoplasia type1. N Eng1 J Med,1989,321:213.
9 Thakker RV,Bouloux P,Wooding C,et al.Association of parathyroid tumors in multiple endocrine neoplasia type 1 with loss of alleles on chromosome 11. N Eng1 J Med,1989,321:218.
, 百拇医药
10 Arnold A,Kim HG,Gaz RD,et al.Molecular cloning and chromosomal mapping of DNA rearranged with the parathyroid hormone gene in a parathyroid adenoma.J Clin Invest 1989;83:2034.
11 Friedman E,Bale AE,Marx SJ,et al.Genetic abnormalities in sporadic adenomas.J Clin Endocrinol Metab,1990,71:293.
12 Rosenberg CL,Kim HG,Shows TB,et al.Arnold A:rearrangement and overexpression of D11S287E,a candidate oncogene on chromosome 11q13 in benign parathyroid tumors.Oncogene,1991,6:449.
, 百拇医药
13 Kendall CH,Roberts PA,Pringle JH,et al.The expression of parathyroid hormone messenger RNA in normal and abnormal parathyroid tissue,J Pathol,1991,165:111.
14 Wingender E,Bercz G,Blocker H,et al.Expression of human parathyroid hormone in Escherichia coli.J Biol Chen,1989,264:4367.
15 Gardella TJ,Rubin D,Abou-Samra AB,et al.Expression of human parathyroid hormone-(1-84) in Escherichia coli as a factor Xcleavable fusion protein.J Biol Chem,1990,265:15854.
, http://www.100md.com
16 Hφgset A,Blingsmo OR,Saether O,et al.Expression and characterization of a recombinent human parathyroid hormone secreted by Escherichia coli emplying the staphylococcal protein A promoter and signal sequence.J Biol Chem,1990,265:7338.
17 Sung WL,Luk CK,Zahab DM,et al.Internal ribosome-binding site directs expression of parathyroid hormone analogue (8-84) in Escherichia coli.Biochem Biophys Res COmmun,1991,181:481.
18 Sung WL,Zahab DM,Barbier JR,et al.Specific degenerate codons enhanced selective expression of human parathyroid hormone in Escherichia coli.J Biol Chem,1991,266:2831.
(收稿:1992-08-03 修回:1993-01-20), 百拇医药