甲状腺功能亢进与减退大鼠垂体生长激素细胞的免疫电镜研究
作者:罗国春 潘长玉 罗 毅 巴恩平
单位:100853 中国人民解放军总医院内分泌科
关键词:生长激素;甲状腺功能亢进;甲状腺功能减退;显微镜检查,电子
中华医学杂志930912 摘要 给雄性 Sprague Dawley 大鼠腹腔注射1-T4和他巴唑分别诱发甲状腺功能亢进(甲亢)、甲状腺功能减退(甲减);腹腔注射生理盐水作为对照。取垂体用免疫电镜观察垂体生长激素(GH)细胞。结果显示甲亢及甲减大鼠GH细胞数目明显减少,细胞中GH分泌颗粒及颗粒中胶体金粒均明显减少。结果表明,甲状腺激素不足可以引起GH生成减少,甲状腺激素过多同样亦可致GH生成减少。
甲状腺激素是调节垂体生长激素(GH)生成的重要因素。青春期前发病的甲状腺功能减退(甲减)患者表现有身材矮小,其主要原因之一是甲状腺激素不足导致垂体GH生成不足。我们曾经报道〔1〕,甲减患者GH对胰岛素-低血糖刺激的反应明显减低,其中多数患者的反应低于正常。血中GH水平由于受外周代谢因素的影响,可能不一定完全反映垂体GH的生成。因此,我们通过用免疫电镜的方法观察不同甲状腺功能状态的垂体GH细胞的征象,以进一步了解甲状腺激素对垂体GH的调节。
, 百拇医药
材料和方法
成年雄性 Sprague Dawley大鼠12只(体重184~238g)作为实验对象。4只连续腹腔注射1-T4(100μg/500μ)21日,诱发大鼠发生药物性甲状腺功能亢进(甲亢);4只连续腹腔注射他巴唑(0.08%500μl)21日,诱发大鼠发生药物性甲减;4只连续腹腔注射生理盐水(500μl)21日作为对照。
腹腔注射21日后,次日上午8时,给大鼠吸入乙醚,麻醉后迅速剪头处死,取垂体置3%戊二醛固定作免疫电镜检查,取血测定血浆游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、总甲状腺素(TT4)。FT3、FT4放免药盒由上海原子能研究所提供,TT4放免药盒由北京原子能研究所提供。
免疫电镜:垂体标本用1%四氧化锇固定,包埋后制在超薄切片,3%双氧水冲洗10分钟,生理盐水冲洗,5%BSA封闭10分钟,1∶150猴抗鼠 GH 抗体(美国 NIDDK 产品)过夜;PBS冲洗,5%BSA封闭40分钟,1∶40蛋白A胶体金(10nm,军事医学科学院产品)40分钟,PBS冲洗,3%戊二醛固定20分钟,醋酸双氧铀及柠檬酸铅双重染色,日立H7000电镜观察。
, 百拇医药
电镜观察:观察每个铜网格内胶体金粒阳性的GH细胞数目,计7个铜网;观察每个GH细胞含有的GH分泌颗粒,计20个GH细胞;观察每个GH分泌颗粒内胶体金粒数目,计100个GH分泌颗粒。
统计学处理:用两样本均数的t检验计算甲亢或甲减大鼠各项指标与对照大鼠比较的显著性差异。
结 果
腹腔注射前后的体重,甲亢组大鼠分别为214.0±6.9和216.3±7.7g(P>0.05);甲减组大鼠分别为215.0±12.4和307.5±10.9g(P<0.01);对照组大鼠分别为195.5±7.2和298.0±8.6g(P<0.01)。结果示甲亢大鼠由于高代谢消耗,体重无明显增加,甲减大鼠体重有明显增加,对照大鼠体重亦有明显增加。各组大鼠血浆FT3、FT4、TT4测定结果见表1。甲亢及甲减大鼠分别明显高于、低于对照大鼠,各项指标均无重叠。
, http://www.100md.com
表1 3组大鼠血浆FT3、FT4、TT4测定( ±S-x) 组别
±S-x) 组别
鼠数
FT3
FT4
FT4
(pmol/L)
(pmol/L)
(nmol/L)
对照组
, 百拇医药
4
1.96±0.22
2.42±0.29
70.9±2.8
甲亢组
4
4.93±0.52
10.19±0.97
113.2±3.0
甲减组
4
0.53±0.13
, 百拇医药 1.25±0.02
33.0±1.6
大鼠垂体免疫电镜观察结果见表2和图1~3。由表2可见,甲亢、甲减大鼠垂体GH细胞的数目明显少于对照大鼠(P均<0.01),GH细胞中GH分泌颗粒明显少于对照大鼠(P均<0.01),GH颗粒中胶体金粒的数目亦显著少于对照大鼠。结果提示甲亢和甲减均可以导致垂体GH细胞减少,GH生成下降。
表2 3组大鼠垂体GH细胞免疫电镜观察结果( ±S-x) 组别
±S-x) 组别
GH细胞数目(个/铜网)
n=7个铜网
G盼泌颗粒数目(个/每个GH细胞)n=20个GH细胞
, http://www.100md.com
GH颗粒中胶体金粒(个/颗粒)n=100颗粒
对照组
24.3±1.1
119.4±5.4
60.0±2.7
甲亢组
17.4±0.7
49.7±3.9
41.0±1.9
甲减组
16.6±0.6
41.2±3.4
, 百拇医药
37.8±1.9
由图1~3可见,甲亢、甲减大鼠垂体GH细胞中含胶体金粒的GH分泌颗粒明显较少,而对照大鼠垂体GH细胞中含胶体金的GH分泌颗粒明显较多。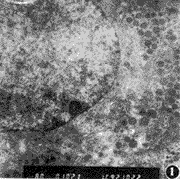

图1 对照大鼠垂体生长激素(GH)细胞,胞浆中GH分泌颗粒较多 ×8000
图2 甲亢大鼠垂体GH细胞,胞浆中GH分泌颗粒明显少于对照大鼠 ×9000
图2 甲减大鼠垂体GH细胞,胞浆中GH分泌颗粒明显少于对照大鼠 ×9000
, 百拇医药
讨 论
甲状腺激素水平与GH生成之间的关系,以往的报道主要是临床研究。通过测定血中GH水平和作刺激 GH 实验来估价垂体GH的合成和分泌,对甲减患者研究较多,对甲亢患者研究很少。研究发现,甲减患者血清 GH 水平降低,GH对刺激试验的反应减低〔1~3〕,用甲状膛激素替代治疗后,血清GH水平和GH对刺激试验的反应明显提高;但是,甲亢患者GH水平及对刺激试验的反应并不增高,反而减低〔4〕。用分子生物学技术研究发现与测定血清 GH 水平及 GH 对刺激的反应的结果相一致,甲减状态下 GH 基因表达减低,用甲状腺激素后 GH 基因表达增加〔5,6〕。
测定血清 GH 水平及刺激 GH 试验是通过血中 GH 的水平反映垂体 GH 的生成,由于血中 GH 水平受外周代谢等因素影响,加上甲状腺功能异常状态势必影响各种物质的代谢。因此,血中GH水平未必一定反映出垂体 GH 的生成,还应做垂体组织和形态学的观察。有关甲状腺功能异常对垂体 GH 生成的影响的形态学研究,曾有报道〔7〕垂体光镜检查发现,在甲减大鼠垂体嗜酸性细胞明显减少,嗜硷性细胞明显增多,提示垂体 GH 细胞数目减少,TSH 细胞数目增加,Horvanth等〔8〕最近报道用免疫组化和免疫电镜发现,在丙基硫氧嘧啶诱发的甲减大鼠,垂体GH细胞数目减少,细胞中GH分泌颗粒数目明显减少,在停用丙基硫氧嘧啶后,GH细胞及GH分泌颗料逐渐增加。本组免疫电镜观察发现:在药物诱发的甲减大鼠,垂体GH细胞及其GH分泌颗粒数目减少,GH颗粒中GH-胶体金粒减少;在药物诱发的甲亢大鼠,同样出现GH细胞及其GH分泌颗粒数目减少,GH颗粒中GH-胶体金粒减少的征象。
, http://www.100md.com
根据文献报道和我们的研究结果,甲状腺激素水平与垂体 GH 生成的关系如下:甲状腺激素不足减少垂体GH的生成,其依据为甲减状态下 GH 对刺激试验的反应明显减低〔1~3〕,垂体GH细胞及GH分泌颗粒明显减少;生理水平的甲状腺激素水平增加垂体GH的生成,其依据为甲状腺激素替代治疗可以使 GH 对刺激试验的反应明显回升〔1~3〕,甲减大鼠停用抗甲状腺药物后,垂体 GH 细胞及 GH 分泌颗粒回升〔8〕;甲状腺激素过多不仅不增加垂体 GH 的生成反而减少垂体 GH 的生成,其依据为甲亢状态下 GH 对刺激试验的反应明显减少〔4〕,以及垂体 GH 细胞及 GH 分泌颗粒明显减少。
最后值得提出的是:青春期前发病的甲减患者表现有身材矮小即生长迟缓,其和甲状腺激素减少引起 GH 生成不足有明显的关系。因此,用甲状腺激素替代治疗有重要意义。但是,替代剂量一定要适当,剂量不足或过多都可能减少垂体 GH 的生成,不利于身高的增长。
, 百拇医药
参考文献
1 罗国春,张 建,潘长玉.甲状腺功能减退对垂体生长激素储备的影响.中华内分泌代谢杂志,1988,4∶212.
2 Valcave R,Jordan V,Dieguez C,et al.Growth hormone responses to GRF 1-29 in patients with primary hypothyroidism before and during replacement therapy with thyroxine. Clin Endocrinol(Oxf),1986,24∶693.
3 Valcavi R,Dieguez C,Preece M,et al.Effect of thyroxine replacement therapy on plasma insulin-like growth factorl levels and growth hormone responses to growth hormone releasing factor in hypothyroid patients.Clin Endocrinol(Oxf),1987,27∶85.
, http://www.100md.com
4 Wilson J.Williams textbook of endocrinology.Philadelphia:Saunders,1985.747.
5 Lloyd RV,Jin L,SongJ,et al.Effects of propylthiouracil on growth hormone and prolactin messenger ribonucleic acids in the rat pituitary.Lab Invest,1990,62∶347.
6 Wood DF,Franklyn JA,Docherty K,et al.The effect of thyroid hormones on growth hormone gene expresion invivo in rats.J Endoctinol,1987,112∶459.
7 Noguchi T,Kudo M,Sugiski T,et al. An immunocytochemical and electron microscopic study of the hytmous anterior pituitary gland. J Endocrinol,1986,109∶163.
8 Horvath E,Lloyd RV,Kovacs K.Propylthiouracyl-in-duced hypothyroidism. Results in reversible transdifferentiation of somatotrophs into thyroidectomy cells.A morphologic study of the rat pituitary including immunoelectron microscopy. Lab Invest,1990,63∶511.
(收稿:1993-03-08 修回:1993-06.13)
, 百拇医药
单位:100853 中国人民解放军总医院内分泌科
关键词:生长激素;甲状腺功能亢进;甲状腺功能减退;显微镜检查,电子
中华医学杂志930912 摘要 给雄性 Sprague Dawley 大鼠腹腔注射1-T4和他巴唑分别诱发甲状腺功能亢进(甲亢)、甲状腺功能减退(甲减);腹腔注射生理盐水作为对照。取垂体用免疫电镜观察垂体生长激素(GH)细胞。结果显示甲亢及甲减大鼠GH细胞数目明显减少,细胞中GH分泌颗粒及颗粒中胶体金粒均明显减少。结果表明,甲状腺激素不足可以引起GH生成减少,甲状腺激素过多同样亦可致GH生成减少。
甲状腺激素是调节垂体生长激素(GH)生成的重要因素。青春期前发病的甲状腺功能减退(甲减)患者表现有身材矮小,其主要原因之一是甲状腺激素不足导致垂体GH生成不足。我们曾经报道〔1〕,甲减患者GH对胰岛素-低血糖刺激的反应明显减低,其中多数患者的反应低于正常。血中GH水平由于受外周代谢因素的影响,可能不一定完全反映垂体GH的生成。因此,我们通过用免疫电镜的方法观察不同甲状腺功能状态的垂体GH细胞的征象,以进一步了解甲状腺激素对垂体GH的调节。
, 百拇医药
材料和方法
成年雄性 Sprague Dawley大鼠12只(体重184~238g)作为实验对象。4只连续腹腔注射1-T4(100μg/500μ)21日,诱发大鼠发生药物性甲状腺功能亢进(甲亢);4只连续腹腔注射他巴唑(0.08%500μl)21日,诱发大鼠发生药物性甲减;4只连续腹腔注射生理盐水(500μl)21日作为对照。
腹腔注射21日后,次日上午8时,给大鼠吸入乙醚,麻醉后迅速剪头处死,取垂体置3%戊二醛固定作免疫电镜检查,取血测定血浆游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、总甲状腺素(TT4)。FT3、FT4放免药盒由上海原子能研究所提供,TT4放免药盒由北京原子能研究所提供。
免疫电镜:垂体标本用1%四氧化锇固定,包埋后制在超薄切片,3%双氧水冲洗10分钟,生理盐水冲洗,5%BSA封闭10分钟,1∶150猴抗鼠 GH 抗体(美国 NIDDK 产品)过夜;PBS冲洗,5%BSA封闭40分钟,1∶40蛋白A胶体金(10nm,军事医学科学院产品)40分钟,PBS冲洗,3%戊二醛固定20分钟,醋酸双氧铀及柠檬酸铅双重染色,日立H7000电镜观察。
, 百拇医药
电镜观察:观察每个铜网格内胶体金粒阳性的GH细胞数目,计7个铜网;观察每个GH细胞含有的GH分泌颗粒,计20个GH细胞;观察每个GH分泌颗粒内胶体金粒数目,计100个GH分泌颗粒。
统计学处理:用两样本均数的t检验计算甲亢或甲减大鼠各项指标与对照大鼠比较的显著性差异。
结 果
腹腔注射前后的体重,甲亢组大鼠分别为214.0±6.9和216.3±7.7g(P>0.05);甲减组大鼠分别为215.0±12.4和307.5±10.9g(P<0.01);对照组大鼠分别为195.5±7.2和298.0±8.6g(P<0.01)。结果示甲亢大鼠由于高代谢消耗,体重无明显增加,甲减大鼠体重有明显增加,对照大鼠体重亦有明显增加。各组大鼠血浆FT3、FT4、TT4测定结果见表1。甲亢及甲减大鼠分别明显高于、低于对照大鼠,各项指标均无重叠。
, http://www.100md.com
表1 3组大鼠血浆FT3、FT4、TT4测定(
 ±S-x) 组别
±S-x) 组别鼠数
FT3
FT4
FT4
(pmol/L)
(pmol/L)
(nmol/L)
对照组
, 百拇医药
4
1.96±0.22
2.42±0.29
70.9±2.8
甲亢组
4
4.93±0.52
10.19±0.97
113.2±3.0
甲减组
4
0.53±0.13
, 百拇医药 1.25±0.02
33.0±1.6
大鼠垂体免疫电镜观察结果见表2和图1~3。由表2可见,甲亢、甲减大鼠垂体GH细胞的数目明显少于对照大鼠(P均<0.01),GH细胞中GH分泌颗粒明显少于对照大鼠(P均<0.01),GH颗粒中胶体金粒的数目亦显著少于对照大鼠。结果提示甲亢和甲减均可以导致垂体GH细胞减少,GH生成下降。
表2 3组大鼠垂体GH细胞免疫电镜观察结果(
 ±S-x) 组别
±S-x) 组别GH细胞数目(个/铜网)
n=7个铜网
G盼泌颗粒数目(个/每个GH细胞)n=20个GH细胞
, http://www.100md.com
GH颗粒中胶体金粒(个/颗粒)n=100颗粒
对照组
24.3±1.1
119.4±5.4
60.0±2.7
甲亢组
17.4±0.7
49.7±3.9
41.0±1.9
甲减组
16.6±0.6
41.2±3.4
, 百拇医药
37.8±1.9
由图1~3可见,甲亢、甲减大鼠垂体GH细胞中含胶体金粒的GH分泌颗粒明显较少,而对照大鼠垂体GH细胞中含胶体金的GH分泌颗粒明显较多。


图1 对照大鼠垂体生长激素(GH)细胞,胞浆中GH分泌颗粒较多 ×8000
图2 甲亢大鼠垂体GH细胞,胞浆中GH分泌颗粒明显少于对照大鼠 ×9000

图2 甲减大鼠垂体GH细胞,胞浆中GH分泌颗粒明显少于对照大鼠 ×9000
, 百拇医药
讨 论
甲状腺激素水平与GH生成之间的关系,以往的报道主要是临床研究。通过测定血中GH水平和作刺激 GH 实验来估价垂体GH的合成和分泌,对甲减患者研究较多,对甲亢患者研究很少。研究发现,甲减患者血清 GH 水平降低,GH对刺激试验的反应减低〔1~3〕,用甲状膛激素替代治疗后,血清GH水平和GH对刺激试验的反应明显提高;但是,甲亢患者GH水平及对刺激试验的反应并不增高,反而减低〔4〕。用分子生物学技术研究发现与测定血清 GH 水平及 GH 对刺激的反应的结果相一致,甲减状态下 GH 基因表达减低,用甲状腺激素后 GH 基因表达增加〔5,6〕。
测定血清 GH 水平及刺激 GH 试验是通过血中 GH 的水平反映垂体 GH 的生成,由于血中 GH 水平受外周代谢等因素影响,加上甲状腺功能异常状态势必影响各种物质的代谢。因此,血中GH水平未必一定反映出垂体 GH 的生成,还应做垂体组织和形态学的观察。有关甲状腺功能异常对垂体 GH 生成的影响的形态学研究,曾有报道〔7〕垂体光镜检查发现,在甲减大鼠垂体嗜酸性细胞明显减少,嗜硷性细胞明显增多,提示垂体 GH 细胞数目减少,TSH 细胞数目增加,Horvanth等〔8〕最近报道用免疫组化和免疫电镜发现,在丙基硫氧嘧啶诱发的甲减大鼠,垂体GH细胞数目减少,细胞中GH分泌颗粒数目明显减少,在停用丙基硫氧嘧啶后,GH细胞及GH分泌颗料逐渐增加。本组免疫电镜观察发现:在药物诱发的甲减大鼠,垂体GH细胞及其GH分泌颗粒数目减少,GH颗粒中GH-胶体金粒减少;在药物诱发的甲亢大鼠,同样出现GH细胞及其GH分泌颗粒数目减少,GH颗粒中GH-胶体金粒减少的征象。
, http://www.100md.com
根据文献报道和我们的研究结果,甲状腺激素水平与垂体 GH 生成的关系如下:甲状腺激素不足减少垂体GH的生成,其依据为甲减状态下 GH 对刺激试验的反应明显减低〔1~3〕,垂体GH细胞及GH分泌颗粒明显减少;生理水平的甲状腺激素水平增加垂体GH的生成,其依据为甲状腺激素替代治疗可以使 GH 对刺激试验的反应明显回升〔1~3〕,甲减大鼠停用抗甲状腺药物后,垂体 GH 细胞及 GH 分泌颗粒回升〔8〕;甲状腺激素过多不仅不增加垂体 GH 的生成反而减少垂体 GH 的生成,其依据为甲亢状态下 GH 对刺激试验的反应明显减少〔4〕,以及垂体 GH 细胞及 GH 分泌颗粒明显减少。
最后值得提出的是:青春期前发病的甲减患者表现有身材矮小即生长迟缓,其和甲状腺激素减少引起 GH 生成不足有明显的关系。因此,用甲状腺激素替代治疗有重要意义。但是,替代剂量一定要适当,剂量不足或过多都可能减少垂体 GH 的生成,不利于身高的增长。
, 百拇医药
参考文献
1 罗国春,张 建,潘长玉.甲状腺功能减退对垂体生长激素储备的影响.中华内分泌代谢杂志,1988,4∶212.
2 Valcave R,Jordan V,Dieguez C,et al.Growth hormone responses to GRF 1-29 in patients with primary hypothyroidism before and during replacement therapy with thyroxine. Clin Endocrinol(Oxf),1986,24∶693.
3 Valcavi R,Dieguez C,Preece M,et al.Effect of thyroxine replacement therapy on plasma insulin-like growth factorl levels and growth hormone responses to growth hormone releasing factor in hypothyroid patients.Clin Endocrinol(Oxf),1987,27∶85.
, http://www.100md.com
4 Wilson J.Williams textbook of endocrinology.Philadelphia:Saunders,1985.747.
5 Lloyd RV,Jin L,SongJ,et al.Effects of propylthiouracil on growth hormone and prolactin messenger ribonucleic acids in the rat pituitary.Lab Invest,1990,62∶347.
6 Wood DF,Franklyn JA,Docherty K,et al.The effect of thyroid hormones on growth hormone gene expresion invivo in rats.J Endoctinol,1987,112∶459.
7 Noguchi T,Kudo M,Sugiski T,et al. An immunocytochemical and electron microscopic study of the hytmous anterior pituitary gland. J Endocrinol,1986,109∶163.
8 Horvath E,Lloyd RV,Kovacs K.Propylthiouracyl-in-duced hypothyroidism. Results in reversible transdifferentiation of somatotrophs into thyroidectomy cells.A morphologic study of the rat pituitary including immunoelectron microscopy. Lab Invest,1990,63∶511.
(收稿:1993-03-08 修回:1993-06.13)
, 百拇医药