糖尿病患者末梢血淋巴细胞T3受体的变化
作者:卢桂芝 高妍 夏铁安 段中平 李 华 马家珠 郑家玑 惠 岩 陈澜
单位:100034北京医科大学第一医院(卢桂芝为研究生)
关键词:糖尿病,非胰岛素依赖型;三碘甲状腺原氨酸;受体,内源性物质
中华医学杂志930902 摘要 应用放射配基结合法测定30例糖尿病正常T3患者及13例糖尿病伴低于T3患者的外周血淋巴细胞T3受体,并与20名正常人对照。结果显示:糖尿病患者血淋巴细胞T3受体的最大结合容量较正常对照组明显增加,低T3组增加更为显著;T3受体的结合容量与血清T3浓度呈负相关。但受体的亲和力不变,表明糖尿病患者血清T3降低后,可能通过增高T3受体的结合容量以代偿甲状腺功能。
, 百拇医药
糖尿病病程中常出现低T3综合征〔1〕,即血清三碘甲状腺原氨酸(T3)减低,反T3(rT3)增高,而促甲状腺激素(TSH)水平正常,临床无甲状腺功能低下表现。其发病机理、生物学意义及是否需要替代治疗等问题至今尚未阐明且有争议,作为T3作用的始动环节——T3受体有无改变,目前主要应用动物模型进行研究〔2~4〕。我们通过对糖尿病患者外周血淋巴细胞T3受体的测定,了解糖尿病低T3综合征的发病机理及其临床意义。
对象和方法
一、对象
1.正常对照组:为献血员和本院健康工作人员,男女和10名,平均年龄45岁(22~60岁),均为身体健康无糖尿病和甲状腺疾病,肝、肾功能正常者。
, 百拇医药
2.糖尿病组:共43例,男18例,女25例。平均年龄53.6岁(23~68岁)。糖尿病诊断根据1980年 WHO 标准,确诊为非胰岛素依赖型糖尿病(NIDDM)。本组患者空腹血糖均在 10mmol/L 以上,病程1~5的。无甲状腺疾病及其他并发症。43例患者又根据血清T3水平分为两组:(1)糖尿病T3正常组:血清知 T3 在1.08~3.08nmol/L,共30例,男14例,女16例,平均年龄53岁。(2)糖尿病伴低 T3 组:血清 T3<1.08nmol/L,共13例,男4例,女9例,平均年龄55岁。
二、方法
1.淋巴细胞 T3 受体的测定:(1)淋巴细胞的分离:采用聚蔗糖-泛影葡胺分层液密度梯度离心法。空腹取静脉血 20ml,肝素抗凝,立即以等量生理盐水稀释。每 5ml 稀释血辅加到 2ml 淋巴细胞分离液上,然后室温下 1 800r/ min 离心 25 分钟。吸取界面白膜层细胞,用无钙镁 Hanks 溶液洗涤 1次,加3ml NH4Cl-Tris 缓冲液,置 37℃ 水浴 10分钟,以破坏混入的少量红细胞。再用无钙镁 Hanks 溶液洗涤1次,将淋巴细胞计数板调整细胞浓度至5×106细胞/ml。(2)T3受体测定:采用体外放射配基结合分析法〔5〕。在其他实验条件相对固定的情况下,分别改变孵育温度、孵育液 pH、孵育时间、细胞数、125I-T3浓度、T3浓度及洗涤次数,观察淋巴细胞与125I-T3的特异结合情况。当孵育温度在37℃、pH7.4、时间为2小时、T3浓度为10-5mol/L、洗涤2次时,0.5×106细胞与125I-T3特异结合最高,为最佳反应条件。测定时在 3ml 聚丙烯试管中加入0.5×106淋巴细胞和不同浓度的 125I-T3(0.1~1.2nmol/L)。每个浓度分6管,其中1对复管为总结合管(TB),另1对复管加入非标记 T3 ,浓度为10-5mol/L,为非特异性结合管(NSB),第3对复管只加 125I-T3 ,测总放射性。最后用 Hanks 液补足到 1ml,37℃放置2小时,再置于0~4℃冰水浴 10分种以终止反应。取出试管,在 4℃ 2 500r/ min 离心 10分钟,沉淀细胞用 1.5ml Hanks 溶液洗涤 2次 。然后用γ计数仪计数。根据 125I-T3的比放射性、仪器计数效率将结合的 cpm 数换长成 fmol。最后,用 Scatchard 分析法作图,求出受体的最大结合容量(MBC)和解离常数(Kd)。为了检测本方法的重复性,我们还选择3名正常人和2例糖尿病患者,每人先后2天测定2名,经配对 t 检验表明2次测定之间无显著差异(p>0.05),说明重复性良好。
, 百拇医药
表1 正常人及患者血清甲状腺激素、TSH浓度( ±s) 组别
±s) 组别
例数
T3(nmol/L)
T4(nmol/L)
rT3(nmol/L)
FT3(pmol/L)
FT4(pmol/L)
FT4I
TSH(mU/L)
, 百拇医药
正常对照组
20
2.19±0.48
91±15
0.80±0.11
9.7±4.5
15±5
6.8±1.4
2.9±1.7
糖尿病T3正常组
30
1.63±0.24*
, http://www.100md.com
108±22
0.91±0.24(n=28)
5.9±2.6*(n=18)
14±8
(n=18)
8.1±1.9(n=26)
3.2±2.1
糖尿病伴低T3组
13
0.84±0.10*△
88±16
, http://www.100md.com
1.09±0.25*△(n=10)
4.9±2.8*(n=7)
18±12(n=7)
7.0±1.8(n=10)
3.4±1.6
注:T3lnmol/L=65.1lng/dl,T4lnmol/L=0.077μg/dl;
*与正常对照组比较,P<0.01,△与糖尿病T3正常组比较,P<0.01
2.血清甲状腺激素和 TSH 测定: T3 、T4、rT3、游离 T3(FT3) 、游离 T4(FT4) 、TSH均用放射免疫法测定,并计算游离 T4 指数 (FT4I) 。T3 和 rT3 的批内变异系数分别为4.0%和4.1%,批间变异系数分别为 7.5%和11.0%。血糖应用葡萄糖氧化酶法测定,批间变异系数为3%。
, 百拇医药
3.统计方法:差异比较用方差分析和秩和检验,相关分析用直线相关处理。
结 果
一、糖尿病患者血清甲状腺激素及 TSH 的变化(表1)
43例 NIDDM 患者血清 T3 和 FT3 均值比正常对照组显著降低。糖尿病伴低 T3 组比糖尿病 T3 正常组的血清 T3 更低(P<0.01)。糖尿病伴低 T3 组血清 rT3 比糖尿病 T3 正常组和正常对照组均升高(P<0.01)。血清 TSH、T4、FT4 及 FT4I各组间均无显著差异且在正常参考值范围。
二、糖尿病患者淋巴细胞 T3 受体的 MBC、Kd 值变化(表2)
, http://www.100md.com
表2 正常人及糖尿病患者淋巴细胞 T3 受体的 MBC、Kd值( ±s) 组别
±s) 组别
例数
MBC
(fmol/0.5×106细胞)
Kd(nmol/L)
正常对照组
20
28.7±5.3
1.8±0.4
糖尿病T3正常组
, 百拇医药
30
42.4±7.4**
2.0±0.3*
糖尿病伴低T3组
13
50.3±10.3**△
2.1±0.4*
* 与正常对照组比较,P>0.05,**与正常对照组比较,P<0.01,△与糖尿病 T3 正常组比较,P<0.01
全部糖尿病患者血淋巴细胞 T3 受体的 MBC 比正常对照组增高(P<0.01),其中糖尿病伴低 T3 组的 T3 受体 MBC 又明显高于糖尿病 T3 正常组,两组间有显著差异(P<0.01)。各组 Kd 间无显著差异(P>0.05)。各组的代表性淋巴细胞 T3 受体的 Scatchard 图举例见附图。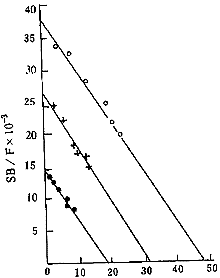
, http://www.100md.com
SB(fmol/0.5x×106细胞)
附图 正常人及糖尿病患者淋巴细胞 T3 受体 Scatchard 作图
三、相关分析
43 例糖尿病患者血清 T3 浓度与空腹血糖浓度呈负相关(r=-0.501,P<0.01);淋巴细胞 T3 受体的最大结合容量与血清 T3 浓度呈负相关(r=-0.409,P<0.01);其他参数之间均无明显相关关系。
讨 论
糖尿病时血清 T3 降低和 rT3 增高,可能是由于 5′-脱碘酶活性受到抑制,使 T4 脱碘代谢成 T3 减少以及 rT3 降解减慢〔1〕。本组结果尽管部分糖尿病患者血清 T3 在正常参考值范围内,但与正常对照组相比血清 T3 和 FT3 浓度均明显降低。糖尿病伴低 T3 组的血清 rT3 明显高于正常对照组,也显著高于糖尿病 T3 正常组。在血清 T3、 FT3 已减低时 T4、 FT4 仍在正常值范围,这些均支持低 T3 是糖尿病时损伤 5′-脱碘酶的结果。本组患者 T3 减低时 TSH 不增高是由于垂体细胞中的5′-脱碘酶活性极高,只要血清 T4 正常,即可在垂体内脱碘形成足够的 T3 以抑制 TSH 分泌,使之维持正常。
, http://www.100md.com
本组结果表明,糖尿病患者血清 T3 浓度与空腹血糖呈显著负相关。糖尿病 T3 正常组与糖尿病伴低 T3 组的血糖均值有显著差异(分别为 12.7±2.4及 17.5±5.6mmol/L,P<0.01),但两组患者的临床症状和体征没有明显差异,血清 T3 浓度的变化与病程和年龄没有明显的相关性。
糖尿病患者血清甲状腺激素浓度出现明显变化时,临床却不表现甲状腺功能的异常。这与机体内存在多种代偿机制有关。其中受体的改变可能起重要作用。本试验两组糖尿病患者血淋巴细胞 T3 受体的最大结合容量均比正常对照组明显增高;伴低 T3 组比糖尿病 T3 正常组更为明显,两者差异也有显著性,受体最大结合容量的增高与血清 T3 浓度呈明显负相关。因此,受体最大结合容量的增高可能由 T3 下降引起,其意义可能是机体在细胞水平对循环 T3 浓度降低的一种代偿机制, T3 受体的结合容量增高有利于 T3 在核内积蓄,以维护组织正常的代谢和功能,避免出现甲状腺功能减退〔5〕。
, 百拇医药
非糖尿病低 T3 综合征动物模型研究表明,如移植肿瘤的大鼠,其血中 TT4、F T4、TT3、FT3浓度均降低,而 TSH 正常,其肝脏 T3 核受体的量比对照组显著下降,但亲和力不变。注入 T3 后不影响受体浓度,但α-甘油磷酸脱氢酶(α-GPD)活性明显增高,苹果酸酶(ME)活性降低。认为可能受体后放大机理导致α-GPD 对于 T3 反应的增强,以维持血 T3 浓度降低时的甲状腺功能,甲状腺激素作用表达上存在局部细胞水平的调节〔4〕。因此,推测非甲状腺疾病伴低 T3 患者可能对 T3 反应增强,受体后放大机理可能对甲状腺功能的维持起一定作用〔4〕。
总之,糠尿病时甲状腺激素水平发生变化,当其血清 T3 减低时机体通过增加 T3 受体结合容量,维持正常甲状腺功能,此时甲状腺激素的替代治疗是不必要的。
, http://www.100md.com
参考文献
1 Williams GR,Neuberger JM,Franklyn JA,et al. Thyroid hormone receptor expression in the "sick euthyroid" syndrome. Lancet,1989,2∶1477.
2 Jolin T.Diabetes decreases liver and kidney nuclear 3,5,3′-triiodothyronine receptors in rats. Endocrinology,1987,120∶2144.
3 Hodin RA, Lazar MA, China WW. Differential and tissue-specific regulation of the multiple rat c-erbAmRNA species by thyroid hormone. J Clin Invest,1990,85∶101.
, 百拇医药
4 Tibaldi JM,Sahnoun N,Surks MI.Response of hepatic mitochondrial α-glycerophosphate dehydrogenase and malic enzyme to constant infusions of L-triiodothyronine in rats bearing the Walker 256 carcinoma. J Clin Invest,1984,74∶705.
5 K vetny J. Nuclear thyroxine and triiodothyronine receptors in human mononuclear cells diabetes mellitus. Diabetologia,1983,24∶428.
(收稿:1993-04-07 修回:1993-06.05), 百拇医药
单位:100034北京医科大学第一医院(卢桂芝为研究生)
关键词:糖尿病,非胰岛素依赖型;三碘甲状腺原氨酸;受体,内源性物质
中华医学杂志930902 摘要 应用放射配基结合法测定30例糖尿病正常T3患者及13例糖尿病伴低于T3患者的外周血淋巴细胞T3受体,并与20名正常人对照。结果显示:糖尿病患者血淋巴细胞T3受体的最大结合容量较正常对照组明显增加,低T3组增加更为显著;T3受体的结合容量与血清T3浓度呈负相关。但受体的亲和力不变,表明糖尿病患者血清T3降低后,可能通过增高T3受体的结合容量以代偿甲状腺功能。
, 百拇医药
糖尿病病程中常出现低T3综合征〔1〕,即血清三碘甲状腺原氨酸(T3)减低,反T3(rT3)增高,而促甲状腺激素(TSH)水平正常,临床无甲状腺功能低下表现。其发病机理、生物学意义及是否需要替代治疗等问题至今尚未阐明且有争议,作为T3作用的始动环节——T3受体有无改变,目前主要应用动物模型进行研究〔2~4〕。我们通过对糖尿病患者外周血淋巴细胞T3受体的测定,了解糖尿病低T3综合征的发病机理及其临床意义。
对象和方法
一、对象
1.正常对照组:为献血员和本院健康工作人员,男女和10名,平均年龄45岁(22~60岁),均为身体健康无糖尿病和甲状腺疾病,肝、肾功能正常者。
, 百拇医药
2.糖尿病组:共43例,男18例,女25例。平均年龄53.6岁(23~68岁)。糖尿病诊断根据1980年 WHO 标准,确诊为非胰岛素依赖型糖尿病(NIDDM)。本组患者空腹血糖均在 10mmol/L 以上,病程1~5的。无甲状腺疾病及其他并发症。43例患者又根据血清T3水平分为两组:(1)糖尿病T3正常组:血清知 T3 在1.08~3.08nmol/L,共30例,男14例,女16例,平均年龄53岁。(2)糖尿病伴低 T3 组:血清 T3<1.08nmol/L,共13例,男4例,女9例,平均年龄55岁。
二、方法
1.淋巴细胞 T3 受体的测定:(1)淋巴细胞的分离:采用聚蔗糖-泛影葡胺分层液密度梯度离心法。空腹取静脉血 20ml,肝素抗凝,立即以等量生理盐水稀释。每 5ml 稀释血辅加到 2ml 淋巴细胞分离液上,然后室温下 1 800r/ min 离心 25 分钟。吸取界面白膜层细胞,用无钙镁 Hanks 溶液洗涤 1次,加3ml NH4Cl-Tris 缓冲液,置 37℃ 水浴 10分钟,以破坏混入的少量红细胞。再用无钙镁 Hanks 溶液洗涤1次,将淋巴细胞计数板调整细胞浓度至5×106细胞/ml。(2)T3受体测定:采用体外放射配基结合分析法〔5〕。在其他实验条件相对固定的情况下,分别改变孵育温度、孵育液 pH、孵育时间、细胞数、125I-T3浓度、T3浓度及洗涤次数,观察淋巴细胞与125I-T3的特异结合情况。当孵育温度在37℃、pH7.4、时间为2小时、T3浓度为10-5mol/L、洗涤2次时,0.5×106细胞与125I-T3特异结合最高,为最佳反应条件。测定时在 3ml 聚丙烯试管中加入0.5×106淋巴细胞和不同浓度的 125I-T3(0.1~1.2nmol/L)。每个浓度分6管,其中1对复管为总结合管(TB),另1对复管加入非标记 T3 ,浓度为10-5mol/L,为非特异性结合管(NSB),第3对复管只加 125I-T3 ,测总放射性。最后用 Hanks 液补足到 1ml,37℃放置2小时,再置于0~4℃冰水浴 10分种以终止反应。取出试管,在 4℃ 2 500r/ min 离心 10分钟,沉淀细胞用 1.5ml Hanks 溶液洗涤 2次 。然后用γ计数仪计数。根据 125I-T3的比放射性、仪器计数效率将结合的 cpm 数换长成 fmol。最后,用 Scatchard 分析法作图,求出受体的最大结合容量(MBC)和解离常数(Kd)。为了检测本方法的重复性,我们还选择3名正常人和2例糖尿病患者,每人先后2天测定2名,经配对 t 检验表明2次测定之间无显著差异(p>0.05),说明重复性良好。
, 百拇医药
表1 正常人及患者血清甲状腺激素、TSH浓度(
 ±s) 组别
±s) 组别例数
T3(nmol/L)
T4(nmol/L)
rT3(nmol/L)
FT3(pmol/L)
FT4(pmol/L)
FT4I
TSH(mU/L)
, 百拇医药
正常对照组
20
2.19±0.48
91±15
0.80±0.11
9.7±4.5
15±5
6.8±1.4
2.9±1.7
糖尿病T3正常组
30
1.63±0.24*
, http://www.100md.com
108±22
0.91±0.24(n=28)
5.9±2.6*(n=18)
14±8
(n=18)
8.1±1.9(n=26)
3.2±2.1
糖尿病伴低T3组
13
0.84±0.10*△
88±16
, http://www.100md.com
1.09±0.25*△(n=10)
4.9±2.8*(n=7)
18±12(n=7)
7.0±1.8(n=10)
3.4±1.6
注:T3lnmol/L=65.1lng/dl,T4lnmol/L=0.077μg/dl;
*与正常对照组比较,P<0.01,△与糖尿病T3正常组比较,P<0.01
2.血清甲状腺激素和 TSH 测定: T3 、T4、rT3、游离 T3(FT3) 、游离 T4(FT4) 、TSH均用放射免疫法测定,并计算游离 T4 指数 (FT4I) 。T3 和 rT3 的批内变异系数分别为4.0%和4.1%,批间变异系数分别为 7.5%和11.0%。血糖应用葡萄糖氧化酶法测定,批间变异系数为3%。
, 百拇医药
3.统计方法:差异比较用方差分析和秩和检验,相关分析用直线相关处理。
结 果
一、糖尿病患者血清甲状腺激素及 TSH 的变化(表1)
43例 NIDDM 患者血清 T3 和 FT3 均值比正常对照组显著降低。糖尿病伴低 T3 组比糖尿病 T3 正常组的血清 T3 更低(P<0.01)。糖尿病伴低 T3 组血清 rT3 比糖尿病 T3 正常组和正常对照组均升高(P<0.01)。血清 TSH、T4、FT4 及 FT4I各组间均无显著差异且在正常参考值范围。
二、糖尿病患者淋巴细胞 T3 受体的 MBC、Kd 值变化(表2)
, http://www.100md.com
表2 正常人及糖尿病患者淋巴细胞 T3 受体的 MBC、Kd值(
 ±s) 组别
±s) 组别例数
MBC
(fmol/0.5×106细胞)
Kd(nmol/L)
正常对照组
20
28.7±5.3
1.8±0.4
糖尿病T3正常组
, 百拇医药
30
42.4±7.4**
2.0±0.3*
糖尿病伴低T3组
13
50.3±10.3**△
2.1±0.4*
* 与正常对照组比较,P>0.05,**与正常对照组比较,P<0.01,△与糖尿病 T3 正常组比较,P<0.01
全部糖尿病患者血淋巴细胞 T3 受体的 MBC 比正常对照组增高(P<0.01),其中糖尿病伴低 T3 组的 T3 受体 MBC 又明显高于糖尿病 T3 正常组,两组间有显著差异(P<0.01)。各组 Kd 间无显著差异(P>0.05)。各组的代表性淋巴细胞 T3 受体的 Scatchard 图举例见附图。

, http://www.100md.com
SB(fmol/0.5x×106细胞)
附图 正常人及糖尿病患者淋巴细胞 T3 受体 Scatchard 作图
三、相关分析
43 例糖尿病患者血清 T3 浓度与空腹血糖浓度呈负相关(r=-0.501,P<0.01);淋巴细胞 T3 受体的最大结合容量与血清 T3 浓度呈负相关(r=-0.409,P<0.01);其他参数之间均无明显相关关系。
讨 论
糖尿病时血清 T3 降低和 rT3 增高,可能是由于 5′-脱碘酶活性受到抑制,使 T4 脱碘代谢成 T3 减少以及 rT3 降解减慢〔1〕。本组结果尽管部分糖尿病患者血清 T3 在正常参考值范围内,但与正常对照组相比血清 T3 和 FT3 浓度均明显降低。糖尿病伴低 T3 组的血清 rT3 明显高于正常对照组,也显著高于糖尿病 T3 正常组。在血清 T3、 FT3 已减低时 T4、 FT4 仍在正常值范围,这些均支持低 T3 是糖尿病时损伤 5′-脱碘酶的结果。本组患者 T3 减低时 TSH 不增高是由于垂体细胞中的5′-脱碘酶活性极高,只要血清 T4 正常,即可在垂体内脱碘形成足够的 T3 以抑制 TSH 分泌,使之维持正常。
, http://www.100md.com
本组结果表明,糖尿病患者血清 T3 浓度与空腹血糖呈显著负相关。糖尿病 T3 正常组与糖尿病伴低 T3 组的血糖均值有显著差异(分别为 12.7±2.4及 17.5±5.6mmol/L,P<0.01),但两组患者的临床症状和体征没有明显差异,血清 T3 浓度的变化与病程和年龄没有明显的相关性。
糖尿病患者血清甲状腺激素浓度出现明显变化时,临床却不表现甲状腺功能的异常。这与机体内存在多种代偿机制有关。其中受体的改变可能起重要作用。本试验两组糖尿病患者血淋巴细胞 T3 受体的最大结合容量均比正常对照组明显增高;伴低 T3 组比糖尿病 T3 正常组更为明显,两者差异也有显著性,受体最大结合容量的增高与血清 T3 浓度呈明显负相关。因此,受体最大结合容量的增高可能由 T3 下降引起,其意义可能是机体在细胞水平对循环 T3 浓度降低的一种代偿机制, T3 受体的结合容量增高有利于 T3 在核内积蓄,以维护组织正常的代谢和功能,避免出现甲状腺功能减退〔5〕。
, 百拇医药
非糖尿病低 T3 综合征动物模型研究表明,如移植肿瘤的大鼠,其血中 TT4、F T4、TT3、FT3浓度均降低,而 TSH 正常,其肝脏 T3 核受体的量比对照组显著下降,但亲和力不变。注入 T3 后不影响受体浓度,但α-甘油磷酸脱氢酶(α-GPD)活性明显增高,苹果酸酶(ME)活性降低。认为可能受体后放大机理导致α-GPD 对于 T3 反应的增强,以维持血 T3 浓度降低时的甲状腺功能,甲状腺激素作用表达上存在局部细胞水平的调节〔4〕。因此,推测非甲状腺疾病伴低 T3 患者可能对 T3 反应增强,受体后放大机理可能对甲状腺功能的维持起一定作用〔4〕。
总之,糠尿病时甲状腺激素水平发生变化,当其血清 T3 减低时机体通过增加 T3 受体结合容量,维持正常甲状腺功能,此时甲状腺激素的替代治疗是不必要的。
, http://www.100md.com
参考文献
1 Williams GR,Neuberger JM,Franklyn JA,et al. Thyroid hormone receptor expression in the "sick euthyroid" syndrome. Lancet,1989,2∶1477.
2 Jolin T.Diabetes decreases liver and kidney nuclear 3,5,3′-triiodothyronine receptors in rats. Endocrinology,1987,120∶2144.
3 Hodin RA, Lazar MA, China WW. Differential and tissue-specific regulation of the multiple rat c-erbAmRNA species by thyroid hormone. J Clin Invest,1990,85∶101.
, 百拇医药
4 Tibaldi JM,Sahnoun N,Surks MI.Response of hepatic mitochondrial α-glycerophosphate dehydrogenase and malic enzyme to constant infusions of L-triiodothyronine in rats bearing the Walker 256 carcinoma. J Clin Invest,1984,74∶705.
5 K vetny J. Nuclear thyroxine and triiodothyronine receptors in human mononuclear cells diabetes mellitus. Diabetologia,1983,24∶428.
(收稿:1993-04-07 修回:1993-06.05), 百拇医药