铝对兔骨毒性作用的研究
作者:黄国伟 徐格晟 张万起 任大林 陈 杰 齐全乐
单位:300070天津医学院营养与食品卫生教研室(黄国伟、徐格晟、张万起、任大林、陈 杰),内分泌研究所(齐全光)
关键词:铝;骨和骨组织;毒理学
中华医学杂志931014 摘要 通过兔动物实验研究了摄入铝对风骼的毒性作用。结果表明,随铝摄入量增加,骨铝蓄积显著,血清铝及甲状旁腺素(PTH)水平增加,并呈正相关(P〈0.01);骨钙、磷增加,血清钙明显下降(P〈0.05)。病理检查脱钙骨对照组与实验组均未见明显异常;骨组织形态计量学显示高、低铝组实验动物的类骨质有增加的趋势,高铝组矿化障碍,同时低铝组骨组织形成有增加的趋势。
许多学者提出Alzheimer型老年性痴呆、透析性脑病、透析性骨病、部分骨营养不良均可能与铝的毒性有关[1]。我们通过动物实验探讨了摄入铝对骨的毒性作用及其机制。
, 百拇医药
材料与方法
一、实验动物与饲养条件
日本大耳雄性白兔,2~3月龄,初始体重1.6±0.25kg,单笼喂养,自由进食及饮水。
二、剂量与分组
按体重随机分为3组,每组7只。Ⅰ组为对照组食用基础饲料;Ⅱ组为低铝组,在基础饲料中掺入2%分析纯硫酸铝钾;Ⅲ组为高铝组,在基础饲料中掺入8%分析纯硫酸铝钾。
三、研究方法
实验兔喂养32周,每周记录进食量2次,称体重1次。在实验开始及结束前,分别经兔耳缘静脉取血,测定血清铝及其它生化指标。在实验结束前2周服用四环素0.5g每日2次共3天,然后停药10天,于第11天再给四环素0.5g每日2次3天,停药3天后再取标本,行不脱钙骨荧光显微镜检查。在第32周末以气栓方式处死,称量胫骨计算胫骨重与体重比值。取一侧胫骨做病理检查,取另一侧胫骨用无离子水冲净置于平皿中80℃烘干,以测定铝及其它元素。
, 百拇医药
四、观察指标及测定方法
1.样品的前处理:精确称取1g左右的骨及饲料于石英坩锅中,然后置于马福炉中灰化200℃小时,550℃12小时,灰化后加入1%HNO3浸泡测定;血清用1%HNO3稀释后直接测定。
2.指标及方法:血清、骨、饲料中铝采用石墨炉子吸收光谱法测定,仪器为日立Z-8000原子吸收分光光度计,回收率为95%~113%,变异系数小于6.1%[2];骨钙、镁及血清钙、镁、锌、铜采用等离子发射光谱法测定,仪器为美国Leeman公司的ICP-AES,回收率为95%~106%,变异系数小于5%;骨磷及血清磷采用钼酸铵法测定,回收率为96%~107%,变异系数小于4%;血清甲状旁腺素(PTH)采用放免测定法,仪器为YSJ-192液闪计数器,回收率为99%~110%,变异系数为8.6%;血清碱性磷酸酶(ALP)采用酶速率法,仪器为荷兰ISP-M半自动生化分析仪。
, 百拇医药
由中国预防医学科学院环境监测所提供牛血清的铝参考值为37μg/L(GBW 09131),本研究测定值为35.3μg/L;由中国科学院上海原子核研究所提供人发样铝标准含量为13.3±2.3mg/kg(GBW 09101),本研究测定值为11.9mg/kg。
五、骨病理学检查
1.方法:脱钙骨采用HE染色进行一般病理学检查。不脱钙骨8μm骨切片经甲苯胺蓝染色后用普通光镜观察,20μm骨切片不染色用荧光显微镜观察。在普通光镜和荧光显微镜下,用MOP-Videoplan半自动图象分析仪直接测量胫骨干骺端小梁骨组织的形态计量学指标[3,4]。
2.骨组织形态计量学指标:(1)类骨质体密度(Vvos):指骨小梁体积占全部松质骨体积的百分比;(2)类骨质表面百分比(OSf):指类骨质表面长度占全部骨小梁表面长度的百分比;(3)平均类骨质宽度(MOSW):指类骨质靠近矿化骨的表面到髓腔表面的平均距离;(4)矿化沉积率(M):两条四环素标记线之间的平均距离除以两次标记间隔的天数;(5)类骨质体积占骨小梁体积的百分比(TOA/TOB);(6)骨小梁体密度(Vv):指骨小梁体积占全部松质骨体积的百分比。
, 百拇医药
六、数据处理
采用IBM PC/XT 286型计算机处理。统计方法采用t检验、F检验及单相关分析。
结 果
一、各组兔的体重及铝摄入量
实验前后各组兔的体重及体重增长差异均无显著性(P〉0.05)。从表1可见,各组兔的饲料中实测铝含量及平均铝摄入量差异均有极显著意义(P〈0.01)。
表1 各组兔饲料中实测铝含量及铝摄入量(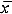 ±S) 组别
±S) 组别
n
饲料中实测铝含量(mg/kg)
, http://www.100md.com
平均铝摄入量(mg.kg-1/d)
Ⅰ
7
560±128
25±6
Ⅱ
7
1675±62
76±4
Ⅲ
7
5883±610
, 百拇医药
236±18
二、兔血清铝、钙、磷、镁、ALP及PTH的含量
实验前兔血清铝含量各组之间差异无显著性(P〉0.05);实验后血清铝含量随铝摄入量而增加,且各组之间差异有极显著意义(P〈0.01)(表2)。
表2 实验前后各组兔血清铝含量(μg/L,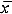 ±S,n=7) 组别
±S,n=7) 组别
实验前
实验后
P值
Ⅰ
53.9±9.3
, 百拇医药
74±31
>0.05
Ⅱ
56.3±4.7
94±16
<0.01
Ⅲ
57.9±2.7
237±65
<0.01
* n=6
实验前血清钙、磷及实验后血清磷各组之间差异均无显著意义(P〉0.05);实验后血清钙Ⅱ、Ⅲ组低于Ⅰ组,并且差异有极显著意义(P〈0.01),而Ⅱ、Ⅲ组之间差异无显著意义(P〉0.05);实验前后比较,各组血清磷差异均无显著意义(P〉0.05);血清钙Ⅰ组实验后高于实验前,Ⅱ组实验后低于实验前,差异有显著意义(P〈0.05),Ⅲ组实验前后则差异无显著意义(P〉0.05)(表3)。
, 百拇医药
表3 实验前后各组兔血清中钙、磷的含量(mmol/L,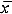 +s) 组别
+s) 组别
实验前
实验后
n
血清钙
血清磷
n
血清钙
血清磷
Ⅰ
7
3.42±0.19
, http://www.100md.com
2.2±0.4
7
3.84±0.38
1.86±0.35
Ⅱ
6
3.57±0.30
2.3±0.6
7
3.04±0.21
1.76±0.26
Ⅲ
6
, 百拇医药
3.60±0.16
2.2±0.4
7
3.29±0.56
2.01±0.46
血清中镁及ALP活性各组之间差异均无显著性(P〉0.05);血清中PTH的含量Ⅱ、Ⅲ组高于Ⅰ组,差异有显著意义(P〈0.05)(表4)。
表4 实验后各组兔血清镁、ALP活性及PTH含量含量(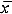 ±S) 组别
±S) 组别
镁
ALP
, 百拇医药
PTH
n
mmol/L
n
μmol.s-1/L
n
pg/L
Ⅰ
7
0.72±0.10
5
0.32v0.08
, 百拇医药 5
19±6
Ⅱ
6
0.69±0.08
7
0.28±0.07
4
32±10
Ⅲ
7
0.77±0.12
5
, 百拇医药
0.25±0.12
4
45±9
三、兔胫骨的重量及骨组织中铝、钙、镁、磷的含量
兔胫骨的绝对重量与相对重量各组之间差异均无显著性(P〉0.05)。骨铝含量随铝摄入量的增加而增加,并且Ⅰ(47±9mg/kg)、Ⅱ(72±8mg/kg)、Ⅲ(106±20mg/kg)组之间差异有显著意义(P〈0.05);骨钙、磷Ⅱ(分别为280±28及112±17mg/kg)、Ⅲ组(分别为285±32及111±21mg/kg)高于Ⅰ组(分别为242±29及80±26mg/kg),差异有显著意义()〈0.05),而Ⅱ、Ⅲ组之间差异无显著意义(P〉0.05);骨镁各组之间差异无显著意义(P〉0.05)。
四、骨组织病理检查结果
, 百拇医药
脱钙骨进行的病理学检查各组均未见明显的病理变化。由表5可见,Ⅱ组的类骨质体密度(Vvos)、骨小梁体密度(Vv)明显高于Ⅰ、Ⅲ组(P〈0.05),其它指标也反映此组动物类骨质增加,但与Ⅰ组比较差异不显著;Ⅲ组平均矿化沉积率(M)最低,但由于个体差异大,与对照组比较差异无显著意义,其它反映类骨质的指标也有略高于Ⅰ组的趋势,其中只有类骨质体密度(Vvos)显著高于Ⅰ组(P〈0.05)
表5 骨组织形态计量学结果(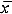 +s) 组别
+s) 组别
n
Vvos(%)
OSf(%)
Vv(%)
TOA/TOB(%)
, http://www.100md.com
MOSW(μm)
M(μm/d)
Ⅰ
4
0.25±0.25
2.4±1.8
29.0±4.6
0.9±0.8
7.1±1.2
1.3±0.2
Ⅱ
7
0.81±0.40
, http://www.100md.com
5.3±2.6
39.2±7.8
2.1±1.0
8.8±2.1
1.3±0.3
Ⅲ
5
0.37±0.10
3.7±0.9
24.0±2.7
1.5±0.3
7.3±0.9
, http://www.100md.com
0.8±0.8
五、单相关分析结果见表6
表6 单相关分析结果 Y
X
r
P
血清铝
铝摄入量
0.869
<0.01
骨铝
铝摄入量
0.864
, 百拇医药
<0.01
血清钙
铝摄入量
-0.441
<0.05
血清PTH
铝摄入量
0.773
<0.01
血清磷
铝摄入量
0.426
<0.05
, http://www.100md.com
骨钙
血清钙
-0.373
>0.05
骨磷
血清磷
-0.607
<0.01
血清PTH
血清钙
-0.649
<0.01
骨钙
, 百拇医药
血清PTH
0.807
<0.01
骨钙
MOSW
0.582
<0.05
骨磷
MOSW
0.497
<0.05
骨铝
M
, 百拇医药
-0.418
>0.05
讨 论
由于兔是对铝毒性较敏感的动物之一,而且铝在兔组织蓄积及产生的毒性相似于人的铝中毒[5,6],故本研究采用兔作为研究对象。本研究结果表明,随铝摄入量增加,骨铝蓄积显著,血清铝含量及PTH水平增加,并存在正相关关系(P〈0.01);骨钙、磷增加,血清钙含量明显下降(P〈0.05),并且血清钙与铝摄入量存在负相关(P〈0.05)。血清钙的降低可能是铝摄入量的增加而影响钙的吸收所致,同时产生PTH代偿性增加。病理检查用脱钙HE染色在光学显微镜下观察,实验组与对照组比较未见明显异常,而且各组血清碱性磷酸酶的活性无显著性差别,说明本研究剂量铝在骨组织中的蓄积不影响骨细胞。但从骨组织形态计量学测定中发现高、低铝组实验动物的类骨质体密度、类骨质表面百分比、平均类骨质宽度、类骨质占骨小梁体积百分比均较对照组高,只是高、低铝组类骨质体密度的增高差异有显著意义(P〈0.05)。基本上可反映高、低铝组实验兔有类骨质增加的趋势。这与文献[7]报道铝主要导致骨软化的危害是一致的。铝所导致的骨软化主要通过铝抑制矿化和对成骨细胞的毒作用两个方面来产生,这两种作用可以同时发生,互不排斥,并且骨铝含量与骨软化之间呈正相关[1,8]。本研究低铝组动物矿化沉积率与对照组相似,高铝组在5只动物中有2只动物矿化沉积率等于零,高铝组矿化沉积率低于对照和低铝组,但由于个体间差异大,此沉积率的下降差异无显著意义。总的看来,低铝组的类骨质增加可能主要是由于骨基质合成加速而矿化减少,高铝组动物类骨质增加主要是由于矿化缺乏所致。铝致动物骨骼病变除骨样组织增加外,也同时存在骨的形成增加,这在低铝组表现尤为显著,如低铝组的骨小梁体密度明显高于对照组(P〈0.05),并有骨钙、磷的增多,这些反映骨质形成增加,但在高铝组这种作用则不明显,铝的这种对骨骼作用的双重性,Galceran等[9]也有报道。本实验出现的骨钙升高,文献[10]也有报道,其原因还不清楚,可能是铝抑制磷酸钙沉积,造成钙的堆积。总之,骨铝含量与铝摄入量呈正相关,铝对骨骼的危害主要是类骨质增多,矿化作用障碍,此外一定剂量的铝在一定时间内也同时有骨组织形成增加的趋势。
, 百拇医药
本课题为卫生部科学基金资助项目
参考文献
1 Lione A. Aluminium toxicology and the aluminium-containing medication. Pharmacol Ther, 1985, 29:255.
2 任大林,徐格晟,黄国伟,等.石墨炉子原子吸收法测定组织样品中的铝的改进.天津医学院学报,1991,4:4.
3 邱明才,李松岭,孙贵连.不脱钙骨甲苯胺蓝染色切片的制备.中华病理学杂志,1987,16:10.
4 Baron R. Processing of undecalcified bone spcimens for bone histomophometry. In: Recker RR ed. Bone histomorphometry. Florida: CPC Press, 1983, 13-35.
, http://www.100md.com
5 Yokel RA. Toxicity of gestational aluminum exposure to the maternal rabbit and offspring. Toxicol Appl Pharmacol, 1985,79:121.
6 Alfrey AC. Aluminium. In: Mertz W ed. Trace elements in human and animal nutrition. Vol 2.5th ed. New York: Academic Press, 1986.399-413.
7 Greger JL. Aluminium and Tin. World Rev Nutr Diet, 1987,54:255.
8 Godman WG. Bone disease and aluminum: pathogenic consideration. Am J Kidney Dis,1985,6:330.
9 Galceran T, Finch J, Bergfeld M, et al. Biological effects of aluminum on normal dogs: studies on the isolated perfosed bone: Endocrinology, 1987,121:406.
10 黄国伟,徐格晟.铝的小鼠毒性试验初步研究.中华预防医学杂志,1991,25:217.
(收稿:1993-01-29 修回:1993-06-07), 百拇医药
单位:300070天津医学院营养与食品卫生教研室(黄国伟、徐格晟、张万起、任大林、陈 杰),内分泌研究所(齐全光)
关键词:铝;骨和骨组织;毒理学
中华医学杂志931014 摘要 通过兔动物实验研究了摄入铝对风骼的毒性作用。结果表明,随铝摄入量增加,骨铝蓄积显著,血清铝及甲状旁腺素(PTH)水平增加,并呈正相关(P〈0.01);骨钙、磷增加,血清钙明显下降(P〈0.05)。病理检查脱钙骨对照组与实验组均未见明显异常;骨组织形态计量学显示高、低铝组实验动物的类骨质有增加的趋势,高铝组矿化障碍,同时低铝组骨组织形成有增加的趋势。
许多学者提出Alzheimer型老年性痴呆、透析性脑病、透析性骨病、部分骨营养不良均可能与铝的毒性有关[1]。我们通过动物实验探讨了摄入铝对骨的毒性作用及其机制。
, 百拇医药
材料与方法
一、实验动物与饲养条件
日本大耳雄性白兔,2~3月龄,初始体重1.6±0.25kg,单笼喂养,自由进食及饮水。
二、剂量与分组
按体重随机分为3组,每组7只。Ⅰ组为对照组食用基础饲料;Ⅱ组为低铝组,在基础饲料中掺入2%分析纯硫酸铝钾;Ⅲ组为高铝组,在基础饲料中掺入8%分析纯硫酸铝钾。
三、研究方法
实验兔喂养32周,每周记录进食量2次,称体重1次。在实验开始及结束前,分别经兔耳缘静脉取血,测定血清铝及其它生化指标。在实验结束前2周服用四环素0.5g每日2次共3天,然后停药10天,于第11天再给四环素0.5g每日2次3天,停药3天后再取标本,行不脱钙骨荧光显微镜检查。在第32周末以气栓方式处死,称量胫骨计算胫骨重与体重比值。取一侧胫骨做病理检查,取另一侧胫骨用无离子水冲净置于平皿中80℃烘干,以测定铝及其它元素。
, 百拇医药
四、观察指标及测定方法
1.样品的前处理:精确称取1g左右的骨及饲料于石英坩锅中,然后置于马福炉中灰化200℃小时,550℃12小时,灰化后加入1%HNO3浸泡测定;血清用1%HNO3稀释后直接测定。
2.指标及方法:血清、骨、饲料中铝采用石墨炉子吸收光谱法测定,仪器为日立Z-8000原子吸收分光光度计,回收率为95%~113%,变异系数小于6.1%[2];骨钙、镁及血清钙、镁、锌、铜采用等离子发射光谱法测定,仪器为美国Leeman公司的ICP-AES,回收率为95%~106%,变异系数小于5%;骨磷及血清磷采用钼酸铵法测定,回收率为96%~107%,变异系数小于4%;血清甲状旁腺素(PTH)采用放免测定法,仪器为YSJ-192液闪计数器,回收率为99%~110%,变异系数为8.6%;血清碱性磷酸酶(ALP)采用酶速率法,仪器为荷兰ISP-M半自动生化分析仪。
, 百拇医药
由中国预防医学科学院环境监测所提供牛血清的铝参考值为37μg/L(GBW 09131),本研究测定值为35.3μg/L;由中国科学院上海原子核研究所提供人发样铝标准含量为13.3±2.3mg/kg(GBW 09101),本研究测定值为11.9mg/kg。
五、骨病理学检查
1.方法:脱钙骨采用HE染色进行一般病理学检查。不脱钙骨8μm骨切片经甲苯胺蓝染色后用普通光镜观察,20μm骨切片不染色用荧光显微镜观察。在普通光镜和荧光显微镜下,用MOP-Videoplan半自动图象分析仪直接测量胫骨干骺端小梁骨组织的形态计量学指标[3,4]。
2.骨组织形态计量学指标:(1)类骨质体密度(Vvos):指骨小梁体积占全部松质骨体积的百分比;(2)类骨质表面百分比(OSf):指类骨质表面长度占全部骨小梁表面长度的百分比;(3)平均类骨质宽度(MOSW):指类骨质靠近矿化骨的表面到髓腔表面的平均距离;(4)矿化沉积率(M):两条四环素标记线之间的平均距离除以两次标记间隔的天数;(5)类骨质体积占骨小梁体积的百分比(TOA/TOB);(6)骨小梁体密度(Vv):指骨小梁体积占全部松质骨体积的百分比。
, 百拇医药
六、数据处理
采用IBM PC/XT 286型计算机处理。统计方法采用t检验、F检验及单相关分析。
结 果
一、各组兔的体重及铝摄入量
实验前后各组兔的体重及体重增长差异均无显著性(P〉0.05)。从表1可见,各组兔的饲料中实测铝含量及平均铝摄入量差异均有极显著意义(P〈0.01)。
表1 各组兔饲料中实测铝含量及铝摄入量(
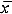 ±S) 组别
±S) 组别n
饲料中实测铝含量(mg/kg)
, http://www.100md.com
平均铝摄入量(mg.kg-1/d)
Ⅰ
7
560±128
25±6
Ⅱ
7
1675±62
76±4
Ⅲ
7
5883±610
, 百拇医药
236±18
二、兔血清铝、钙、磷、镁、ALP及PTH的含量
实验前兔血清铝含量各组之间差异无显著性(P〉0.05);实验后血清铝含量随铝摄入量而增加,且各组之间差异有极显著意义(P〈0.01)(表2)。
表2 实验前后各组兔血清铝含量(μg/L,
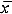 ±S,n=7) 组别
±S,n=7) 组别实验前
实验后
P值
Ⅰ
53.9±9.3
, 百拇医药
74±31
>0.05
Ⅱ
56.3±4.7
94±16
<0.01
Ⅲ
57.9±2.7
237±65
<0.01
* n=6
实验前血清钙、磷及实验后血清磷各组之间差异均无显著意义(P〉0.05);实验后血清钙Ⅱ、Ⅲ组低于Ⅰ组,并且差异有极显著意义(P〈0.01),而Ⅱ、Ⅲ组之间差异无显著意义(P〉0.05);实验前后比较,各组血清磷差异均无显著意义(P〉0.05);血清钙Ⅰ组实验后高于实验前,Ⅱ组实验后低于实验前,差异有显著意义(P〈0.05),Ⅲ组实验前后则差异无显著意义(P〉0.05)(表3)。
, 百拇医药
表3 实验前后各组兔血清中钙、磷的含量(mmol/L,
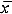 +s) 组别
+s) 组别实验前
实验后
n
血清钙
血清磷
n
血清钙
血清磷
Ⅰ
7
3.42±0.19
, http://www.100md.com
2.2±0.4
7
3.84±0.38
1.86±0.35
Ⅱ
6
3.57±0.30
2.3±0.6
7
3.04±0.21
1.76±0.26
Ⅲ
6
, 百拇医药
3.60±0.16
2.2±0.4
7
3.29±0.56
2.01±0.46
血清中镁及ALP活性各组之间差异均无显著性(P〉0.05);血清中PTH的含量Ⅱ、Ⅲ组高于Ⅰ组,差异有显著意义(P〈0.05)(表4)。
表4 实验后各组兔血清镁、ALP活性及PTH含量含量(
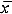 ±S) 组别
±S) 组别镁
ALP
, 百拇医药
PTH
n
mmol/L
n
μmol.s-1/L
n
pg/L
Ⅰ
7
0.72±0.10
5
0.32v0.08
, 百拇医药 5
19±6
Ⅱ
6
0.69±0.08
7
0.28±0.07
4
32±10
Ⅲ
7
0.77±0.12
5
, 百拇医药
0.25±0.12
4
45±9
三、兔胫骨的重量及骨组织中铝、钙、镁、磷的含量
兔胫骨的绝对重量与相对重量各组之间差异均无显著性(P〉0.05)。骨铝含量随铝摄入量的增加而增加,并且Ⅰ(47±9mg/kg)、Ⅱ(72±8mg/kg)、Ⅲ(106±20mg/kg)组之间差异有显著意义(P〈0.05);骨钙、磷Ⅱ(分别为280±28及112±17mg/kg)、Ⅲ组(分别为285±32及111±21mg/kg)高于Ⅰ组(分别为242±29及80±26mg/kg),差异有显著意义()〈0.05),而Ⅱ、Ⅲ组之间差异无显著意义(P〉0.05);骨镁各组之间差异无显著意义(P〉0.05)。
四、骨组织病理检查结果
, 百拇医药
脱钙骨进行的病理学检查各组均未见明显的病理变化。由表5可见,Ⅱ组的类骨质体密度(Vvos)、骨小梁体密度(Vv)明显高于Ⅰ、Ⅲ组(P〈0.05),其它指标也反映此组动物类骨质增加,但与Ⅰ组比较差异不显著;Ⅲ组平均矿化沉积率(M)最低,但由于个体差异大,与对照组比较差异无显著意义,其它反映类骨质的指标也有略高于Ⅰ组的趋势,其中只有类骨质体密度(Vvos)显著高于Ⅰ组(P〈0.05)
表5 骨组织形态计量学结果(
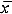 +s) 组别
+s) 组别n
Vvos(%)
OSf(%)
Vv(%)
TOA/TOB(%)
, http://www.100md.com
MOSW(μm)
M(μm/d)
Ⅰ
4
0.25±0.25
2.4±1.8
29.0±4.6
0.9±0.8
7.1±1.2
1.3±0.2
Ⅱ
7
0.81±0.40
, http://www.100md.com
5.3±2.6
39.2±7.8
2.1±1.0
8.8±2.1
1.3±0.3
Ⅲ
5
0.37±0.10
3.7±0.9
24.0±2.7
1.5±0.3
7.3±0.9
, http://www.100md.com
0.8±0.8
五、单相关分析结果见表6
表6 单相关分析结果 Y
X
r
P
血清铝
铝摄入量
0.869
<0.01
骨铝
铝摄入量
0.864
, 百拇医药
<0.01
血清钙
铝摄入量
-0.441
<0.05
血清PTH
铝摄入量
0.773
<0.01
血清磷
铝摄入量
0.426
<0.05
, http://www.100md.com
骨钙
血清钙
-0.373
>0.05
骨磷
血清磷
-0.607
<0.01
血清PTH
血清钙
-0.649
<0.01
骨钙
, 百拇医药
血清PTH
0.807
<0.01
骨钙
MOSW
0.582
<0.05
骨磷
MOSW
0.497
<0.05
骨铝
M
, 百拇医药
-0.418
>0.05
讨 论
由于兔是对铝毒性较敏感的动物之一,而且铝在兔组织蓄积及产生的毒性相似于人的铝中毒[5,6],故本研究采用兔作为研究对象。本研究结果表明,随铝摄入量增加,骨铝蓄积显著,血清铝含量及PTH水平增加,并存在正相关关系(P〈0.01);骨钙、磷增加,血清钙含量明显下降(P〈0.05),并且血清钙与铝摄入量存在负相关(P〈0.05)。血清钙的降低可能是铝摄入量的增加而影响钙的吸收所致,同时产生PTH代偿性增加。病理检查用脱钙HE染色在光学显微镜下观察,实验组与对照组比较未见明显异常,而且各组血清碱性磷酸酶的活性无显著性差别,说明本研究剂量铝在骨组织中的蓄积不影响骨细胞。但从骨组织形态计量学测定中发现高、低铝组实验动物的类骨质体密度、类骨质表面百分比、平均类骨质宽度、类骨质占骨小梁体积百分比均较对照组高,只是高、低铝组类骨质体密度的增高差异有显著意义(P〈0.05)。基本上可反映高、低铝组实验兔有类骨质增加的趋势。这与文献[7]报道铝主要导致骨软化的危害是一致的。铝所导致的骨软化主要通过铝抑制矿化和对成骨细胞的毒作用两个方面来产生,这两种作用可以同时发生,互不排斥,并且骨铝含量与骨软化之间呈正相关[1,8]。本研究低铝组动物矿化沉积率与对照组相似,高铝组在5只动物中有2只动物矿化沉积率等于零,高铝组矿化沉积率低于对照和低铝组,但由于个体间差异大,此沉积率的下降差异无显著意义。总的看来,低铝组的类骨质增加可能主要是由于骨基质合成加速而矿化减少,高铝组动物类骨质增加主要是由于矿化缺乏所致。铝致动物骨骼病变除骨样组织增加外,也同时存在骨的形成增加,这在低铝组表现尤为显著,如低铝组的骨小梁体密度明显高于对照组(P〈0.05),并有骨钙、磷的增多,这些反映骨质形成增加,但在高铝组这种作用则不明显,铝的这种对骨骼作用的双重性,Galceran等[9]也有报道。本实验出现的骨钙升高,文献[10]也有报道,其原因还不清楚,可能是铝抑制磷酸钙沉积,造成钙的堆积。总之,骨铝含量与铝摄入量呈正相关,铝对骨骼的危害主要是类骨质增多,矿化作用障碍,此外一定剂量的铝在一定时间内也同时有骨组织形成增加的趋势。
, 百拇医药
本课题为卫生部科学基金资助项目
参考文献
1 Lione A. Aluminium toxicology and the aluminium-containing medication. Pharmacol Ther, 1985, 29:255.
2 任大林,徐格晟,黄国伟,等.石墨炉子原子吸收法测定组织样品中的铝的改进.天津医学院学报,1991,4:4.
3 邱明才,李松岭,孙贵连.不脱钙骨甲苯胺蓝染色切片的制备.中华病理学杂志,1987,16:10.
4 Baron R. Processing of undecalcified bone spcimens for bone histomophometry. In: Recker RR ed. Bone histomorphometry. Florida: CPC Press, 1983, 13-35.
, http://www.100md.com
5 Yokel RA. Toxicity of gestational aluminum exposure to the maternal rabbit and offspring. Toxicol Appl Pharmacol, 1985,79:121.
6 Alfrey AC. Aluminium. In: Mertz W ed. Trace elements in human and animal nutrition. Vol 2.5th ed. New York: Academic Press, 1986.399-413.
7 Greger JL. Aluminium and Tin. World Rev Nutr Diet, 1987,54:255.
8 Godman WG. Bone disease and aluminum: pathogenic consideration. Am J Kidney Dis,1985,6:330.
9 Galceran T, Finch J, Bergfeld M, et al. Biological effects of aluminum on normal dogs: studies on the isolated perfosed bone: Endocrinology, 1987,121:406.
10 黄国伟,徐格晟.铝的小鼠毒性试验初步研究.中华预防医学杂志,1991,25:217.
(收稿:1993-01-29 修回:1993-06-07), 百拇医药