聚合酶链反应检测病原真菌及新生隐球菌的实验研究
作者:顾菊林 廖万清 柴建华
单位:200003 上海 ,第二军医大学长征医院(顾菊林、廖万清);复旦大学遗传学研究所(柴建华)
关键词:真菌病;隐球菌,新型
中华传染病杂980211 【摘要】 目的 使临床系统性真菌病的诊断提高到分子水平。方法 首先应用一对外侧的基于rDNA的真菌通用引物进行PCR扩增,此后应用新生隐球菌种特异性内侧引物对首轮扩增产物进行第二轮扩增鉴定。结果 应用外侧引物对能对代表8属17种的25株医学重要真菌进行扩增,而对所有细菌和人DNA均为扩增阴性,内侧引物对仅对新生隐球菌获得扩增。应用两轮PCR扩增(通用PCR和随后的种特异性PCR)方法从获得临床标本到鉴定病原菌仅需8小时。结论 这种依据PCR的检测和鉴定系统为临床快速诊断系统性真菌病提供了一种全新的实验方法并可望应用于临床。
Experimental study on detection of pathogenic fungi and cryptococcus neoformans by polymerase chain reaction Gu Julin, Liao Wanqing, Chai Jianhua. Changzheng Hospital, Second Military Medical University, Shanghai 200003
, 百拇医药
【Abstract】 Objective The objective of the study was to develop the diagnosis of systemic mycoses to the sphere of molecular biology. Methods With the nested-PCR methodology, a method for detecting fungal pathogens in clinical specimens was developed. The complete strategy consists of PCR amplification with the external fungal universal primers for rDNA and amplicon identification by the second cycle PCR amplification with the cryptococcus neoformans species-specific primer pair. Results The external universal primers were capable of amplifying DNA from 25 strains representing 17 species (8 genera) of medically important fungi. Neither human nor a varity of pathogenic bacteria gave an amplified product. The internal species-specific primers amplified DNA only from Cryptococcus neoformans. The use of these two PCRs in tandem allows the detection (universal PCR) and identification (species-specific PCR) of a fungal pathogen within 8h from clinical specimens. Conclusion This PCR-based detection and identification system provides a rapid laboratory method for the diagnosis of systemic mycoses and shows its potential for clinical applications.
, 百拇医药
【Key words】 Mycoses Cryptococcus neoformans
医学上重要真菌传统上主要依据形态学和生理学等表型特征进行鉴定,但这些方法往往费时费力。由于近年来在AIDS、血液系统肿瘤以及移植等患者中由机会性真菌感染所致的发病率和死亡率呈日益上升的趋势,因而迫切要求发展鉴定病原真菌的新方法。对真菌菌种菌株进行遗传鉴定的分子方法为鉴定和检测病原菌提供了简便、快速和准确的方法。我们将聚合酶链反应技术用于病原真菌及新生隐球菌的检测,现将结果报告如下。
材料和方法
一、材料
(一) 菌株 白念珠菌ATCC76615、067,类星型念珠菌C1,克柔念珠菌R5,高里念珠菌D10,热带念珠菌D9,乳酒念珠菌D12,光滑念珠菌C2,新生隐球菌D48、RV45981、RV59939、RV52642、RV45977,罗伦特隐球菌C3,黄曲霉C4,烟曲霉C5,产黄青霉C6,酿酒酵母C7,裴氏瓶霉C8,皮炎瓶霉C9,蓝色犁头霉030、057,少根根霉023、056由本院真菌室提供;脑膜炎奈瑟菌,结核分枝杆菌,大肠埃希菌,金黄色葡萄球菌,肺炎球菌,α-溶血性链球菌,β-溶血性链球菌由第二军医大学微生物学教研室赠送。
, 百拇医药
(二) 主要试剂和仪器 Novozyme 234 (Novo Biolabs公司),Lyticase (Sigma),Taq DNA聚合酶(GIBCO BRL),PCR仪(PT-100,MJ Research)。
二、方法
(一) 菌株和细胞系DNA的制备 真菌DNA制备采用高盐法[1]。细菌和人白细胞DNA的制备按文献进行[2]。
(二) 临床标本的预处理 参照Buchman等[3]介绍的方法并作适当修改。
(三) PCR扩增 参照文献[4,5],我们在5.8 rDNA的附近选择了两对套式PCR引物。外侧的引物对ITS1-ITS4为预期的真菌通用引物对,序列为:ITS1 5′-TCCGTAGGTGAACCTGCGG-3′,ITS4 5′-TCCTCCGCTTATTGATATGC-3′。内侧的引物对CN1-CN2设计为新生隐球菌种特异性引物对,序列为:CN1为5′-ATCACCTTCCCACTA-
, http://www.100md.com
ACACAT T-3′,CN2为5′-GAAGGGCATGCCT-
GTTTGAGAG-3′。首先使用外侧引物对进行PCR扩增(ITS-PCR),作为套式PCR的第一轮反应。第二轮:以第一轮PCR的反应产物为模板用内侧引物对CN1-CN2进行第二轮扩增(CN-PCR)。
结果
一、ITS-PCR检测真菌DNA
所有用于本项研究的代表8个真菌菌属、17个真菌菌种的24株真菌DNA均扩增出单个的PCR产物,各菌种的PCR产物大小存在明显的多态性,绝大多数PCR产物大小为500~650bp。7株细菌菌株DNA和4份人白细胞DNA则为扩增阴性。
二、ITS-PCR检测模拟临床血标本的敏感性
, 百拇医药
将在YEPD中生长的白念球菌ATCC76615连续稀释在健康人血中,模拟临床血标本进行PCR扩增。结果经PCR扩增最低可检出10CFU的真菌细胞(附图),在不同日期重复实验,获得PCR检出水平约在5~10CFU范围内。
三、新生隐球菌种特异性引物的鉴定
5株不同血清型的新生隐球菌菌株DNA均扩增产生136bp的片断,与预期产物长度相符。而其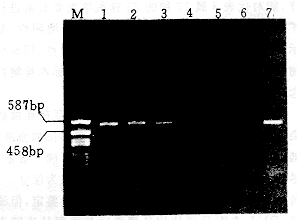 泳道1-4:白念珠菌CFU依次为103,102,10,1。泳道5,模拟标本中无白念珠菌;泳道6,无模板DNA(双蒸水)。泳道7为阳性对照,白念珠菌DNA。泳道M为核苷酸分子量标记pGEM-3Zf(+)/Hae Ⅲ。
泳道1-4:白念珠菌CFU依次为103,102,10,1。泳道5,模拟标本中无白念珠菌;泳道6,无模板DNA(双蒸水)。泳道7为阳性对照,白念珠菌DNA。泳道M为核苷酸分子量标记pGEM-3Zf(+)/Hae Ⅲ。
附图 ITS-PCR检测模拟临床血标本的敏感性
, 百拇医药
它种的真菌和细菌以及人白细胞DNA均为扩增阴性。模拟临床标本的新生隐球菌检测,经CN-PCR扩增最低可检出1~5CFU的新生隐球菌。
四、临床标本的检测
对22例我室保藏的临床脑脊液及非脑脊液标本应用上述PCR方法进行了回顾性研究。结果表明,所有真菌镜检或培养阳性的10例标本ITS-PCR检测阳性;另有1例真菌培养阴性标本应用ITS-PCR亦获得了扩增。新生隐球菌种特异性CN-PCR检测结果表明,上述11例ITS-PCR扩增阳性的标本中仅有4例CN-PCR扩增阳性,而这4例标本此前经培养鉴定为新生隐球菌,其余18例新生隐球菌镜检或培养阴性的标本均未获得扩增。
讨论
过去几年,PCR技术已广泛用于感染性疾病的诊断。在病原真菌的分子诊断方面,已经建立起检测各种病原真菌包括白念珠菌、烟曲霉菌等的PCR方法[6]。早先建立的PCR诊断系统其设计的引物往往仅对单个的目的菌种进行扩增,随着目前临床病原菌感染率的增加和感染真菌菌种的增多,这种单纯的种特异性PCR扩增系统由于鉴定效率低下限制了它们在临床实验室的常规应用。
, 百拇医药
本研究我们采用另一种引物设计的策略,即第一步选择一组较大组群的微生物进行扩增,此后使用一种或更多种种特异性探针(或引物)鉴别目标菌种。实验采用的ITS引物设计扩增rDNA的基因间隔区,该段DNA序列在种系发生上较为保守,能对代表8属17种的25株医学重要真菌进行扩增,而对所有细菌和人DNA均为扩增阴性,显示ITS-PCR方法具有高度的真菌特异性,ITS引物可做为真菌的通用引物。模拟临床血标本检测白念珠菌的敏感性为10CFU。
ITS-PCR为临床上及时判别是否存在真菌感染提供了可能。如果在正常机体无菌部位如血液、脑脊液等出现ITS-PCR阳性,那么就可确立诊断。尽管ITS扩增的该段DNA在进化上较为保守,且尚有其它医学重要真菌的相关序列有待鉴定,但该段rDNA含有足够的信息用于区分重要的病原真菌。对不同真菌的该段rDNA进行测序,进行比较分析,可以设计不同种(或属)的特异性引物(或探针)。基于此,我们应用设计的新生隐球菌种特异的内侧引物进行第二轮扩增鉴定。结果除新生隐球菌能扩增出特异性片段外,其它非新生隐球菌菌株或细胞系皆为扩增阴性。模拟临床标本的敏感性试验表明该PCR方法可检出1~5CFU的新生隐球菌,显示出极高的敏感性[2]。应用两轮PCR扩增(通用PCR和随后的种特异性PCR)方法从获得临床标本到鉴定病原菌仅需8小时。采用这种方法,即首先采用ITS真菌通用引物检测病原真菌,随即通过第二轮的种特异性扩增较单纯的种特异性扩增方法更为快速、有效。
, 百拇医药
参考文献
1 Chartier FL, Keer JT, Sutcliffe MJ, et al. Construction of a mouse yeast artificial chromosome library in a recombination-deficient strain of yeast. Nature Genetics, 1992,1:132-136.
2 顾菊林,廖万清,柴建华.聚合酶链反应快速诊断隐球菌性脑膜炎.中华皮肤科杂志,1996,29:319-321.
3 Buchman TG, Rossier M, Merz WG, et al. Detection of surgical pathogens by in vitro DNA amplification. Surgery, 1990,108:338-347.
, 百拇医药
4 Mitchell TG, Freedman EZ, White TJ, et al. Unique oligonucleotide primers in PCR for identification of Cyptococcus neoformans. J Clin Microbiol,1994,32:253-255.
5 White TJ,Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, White TJ,eds. PCR protocols. A guide to methods and applications. Academic Press, San Diego, Calif, 1990.315-322.
6 Mitchell TG,Sandin RL,Bowman BH,et al. Molecular mycology: DNA probes and applications of PCR technology. J Med Vet Mycol,1994,32:suppl 1,351-366., 百拇医药
单位:200003 上海 ,第二军医大学长征医院(顾菊林、廖万清);复旦大学遗传学研究所(柴建华)
关键词:真菌病;隐球菌,新型
中华传染病杂980211 【摘要】 目的 使临床系统性真菌病的诊断提高到分子水平。方法 首先应用一对外侧的基于rDNA的真菌通用引物进行PCR扩增,此后应用新生隐球菌种特异性内侧引物对首轮扩增产物进行第二轮扩增鉴定。结果 应用外侧引物对能对代表8属17种的25株医学重要真菌进行扩增,而对所有细菌和人DNA均为扩增阴性,内侧引物对仅对新生隐球菌获得扩增。应用两轮PCR扩增(通用PCR和随后的种特异性PCR)方法从获得临床标本到鉴定病原菌仅需8小时。结论 这种依据PCR的检测和鉴定系统为临床快速诊断系统性真菌病提供了一种全新的实验方法并可望应用于临床。
Experimental study on detection of pathogenic fungi and cryptococcus neoformans by polymerase chain reaction Gu Julin, Liao Wanqing, Chai Jianhua. Changzheng Hospital, Second Military Medical University, Shanghai 200003
, 百拇医药
【Abstract】 Objective The objective of the study was to develop the diagnosis of systemic mycoses to the sphere of molecular biology. Methods With the nested-PCR methodology, a method for detecting fungal pathogens in clinical specimens was developed. The complete strategy consists of PCR amplification with the external fungal universal primers for rDNA and amplicon identification by the second cycle PCR amplification with the cryptococcus neoformans species-specific primer pair. Results The external universal primers were capable of amplifying DNA from 25 strains representing 17 species (8 genera) of medically important fungi. Neither human nor a varity of pathogenic bacteria gave an amplified product. The internal species-specific primers amplified DNA only from Cryptococcus neoformans. The use of these two PCRs in tandem allows the detection (universal PCR) and identification (species-specific PCR) of a fungal pathogen within 8h from clinical specimens. Conclusion This PCR-based detection and identification system provides a rapid laboratory method for the diagnosis of systemic mycoses and shows its potential for clinical applications.
, 百拇医药
【Key words】 Mycoses Cryptococcus neoformans
医学上重要真菌传统上主要依据形态学和生理学等表型特征进行鉴定,但这些方法往往费时费力。由于近年来在AIDS、血液系统肿瘤以及移植等患者中由机会性真菌感染所致的发病率和死亡率呈日益上升的趋势,因而迫切要求发展鉴定病原真菌的新方法。对真菌菌种菌株进行遗传鉴定的分子方法为鉴定和检测病原菌提供了简便、快速和准确的方法。我们将聚合酶链反应技术用于病原真菌及新生隐球菌的检测,现将结果报告如下。
材料和方法
一、材料
(一) 菌株 白念珠菌ATCC76615、067,类星型念珠菌C1,克柔念珠菌R5,高里念珠菌D10,热带念珠菌D9,乳酒念珠菌D12,光滑念珠菌C2,新生隐球菌D48、RV45981、RV59939、RV52642、RV45977,罗伦特隐球菌C3,黄曲霉C4,烟曲霉C5,产黄青霉C6,酿酒酵母C7,裴氏瓶霉C8,皮炎瓶霉C9,蓝色犁头霉030、057,少根根霉023、056由本院真菌室提供;脑膜炎奈瑟菌,结核分枝杆菌,大肠埃希菌,金黄色葡萄球菌,肺炎球菌,α-溶血性链球菌,β-溶血性链球菌由第二军医大学微生物学教研室赠送。
, 百拇医药
(二) 主要试剂和仪器 Novozyme 234 (Novo Biolabs公司),Lyticase (Sigma),Taq DNA聚合酶(GIBCO BRL),PCR仪(PT-100,MJ Research)。
二、方法
(一) 菌株和细胞系DNA的制备 真菌DNA制备采用高盐法[1]。细菌和人白细胞DNA的制备按文献进行[2]。
(二) 临床标本的预处理 参照Buchman等[3]介绍的方法并作适当修改。
(三) PCR扩增 参照文献[4,5],我们在5.8 rDNA的附近选择了两对套式PCR引物。外侧的引物对ITS1-ITS4为预期的真菌通用引物对,序列为:ITS1 5′-TCCGTAGGTGAACCTGCGG-3′,ITS4 5′-TCCTCCGCTTATTGATATGC-3′。内侧的引物对CN1-CN2设计为新生隐球菌种特异性引物对,序列为:CN1为5′-ATCACCTTCCCACTA-
, http://www.100md.com
ACACAT T-3′,CN2为5′-GAAGGGCATGCCT-
GTTTGAGAG-3′。首先使用外侧引物对进行PCR扩增(ITS-PCR),作为套式PCR的第一轮反应。第二轮:以第一轮PCR的反应产物为模板用内侧引物对CN1-CN2进行第二轮扩增(CN-PCR)。
结果
一、ITS-PCR检测真菌DNA
所有用于本项研究的代表8个真菌菌属、17个真菌菌种的24株真菌DNA均扩增出单个的PCR产物,各菌种的PCR产物大小存在明显的多态性,绝大多数PCR产物大小为500~650bp。7株细菌菌株DNA和4份人白细胞DNA则为扩增阴性。
二、ITS-PCR检测模拟临床血标本的敏感性
, 百拇医药
将在YEPD中生长的白念球菌ATCC76615连续稀释在健康人血中,模拟临床血标本进行PCR扩增。结果经PCR扩增最低可检出10CFU的真菌细胞(附图),在不同日期重复实验,获得PCR检出水平约在5~10CFU范围内。
三、新生隐球菌种特异性引物的鉴定
5株不同血清型的新生隐球菌菌株DNA均扩增产生136bp的片断,与预期产物长度相符。而其
 泳道1-4:白念珠菌CFU依次为103,102,10,1。泳道5,模拟标本中无白念珠菌;泳道6,无模板DNA(双蒸水)。泳道7为阳性对照,白念珠菌DNA。泳道M为核苷酸分子量标记pGEM-3Zf(+)/Hae Ⅲ。
泳道1-4:白念珠菌CFU依次为103,102,10,1。泳道5,模拟标本中无白念珠菌;泳道6,无模板DNA(双蒸水)。泳道7为阳性对照,白念珠菌DNA。泳道M为核苷酸分子量标记pGEM-3Zf(+)/Hae Ⅲ。附图 ITS-PCR检测模拟临床血标本的敏感性
, 百拇医药
它种的真菌和细菌以及人白细胞DNA均为扩增阴性。模拟临床标本的新生隐球菌检测,经CN-PCR扩增最低可检出1~5CFU的新生隐球菌。
四、临床标本的检测
对22例我室保藏的临床脑脊液及非脑脊液标本应用上述PCR方法进行了回顾性研究。结果表明,所有真菌镜检或培养阳性的10例标本ITS-PCR检测阳性;另有1例真菌培养阴性标本应用ITS-PCR亦获得了扩增。新生隐球菌种特异性CN-PCR检测结果表明,上述11例ITS-PCR扩增阳性的标本中仅有4例CN-PCR扩增阳性,而这4例标本此前经培养鉴定为新生隐球菌,其余18例新生隐球菌镜检或培养阴性的标本均未获得扩增。
讨论
过去几年,PCR技术已广泛用于感染性疾病的诊断。在病原真菌的分子诊断方面,已经建立起检测各种病原真菌包括白念珠菌、烟曲霉菌等的PCR方法[6]。早先建立的PCR诊断系统其设计的引物往往仅对单个的目的菌种进行扩增,随着目前临床病原菌感染率的增加和感染真菌菌种的增多,这种单纯的种特异性PCR扩增系统由于鉴定效率低下限制了它们在临床实验室的常规应用。
, 百拇医药
本研究我们采用另一种引物设计的策略,即第一步选择一组较大组群的微生物进行扩增,此后使用一种或更多种种特异性探针(或引物)鉴别目标菌种。实验采用的ITS引物设计扩增rDNA的基因间隔区,该段DNA序列在种系发生上较为保守,能对代表8属17种的25株医学重要真菌进行扩增,而对所有细菌和人DNA均为扩增阴性,显示ITS-PCR方法具有高度的真菌特异性,ITS引物可做为真菌的通用引物。模拟临床血标本检测白念珠菌的敏感性为10CFU。
ITS-PCR为临床上及时判别是否存在真菌感染提供了可能。如果在正常机体无菌部位如血液、脑脊液等出现ITS-PCR阳性,那么就可确立诊断。尽管ITS扩增的该段DNA在进化上较为保守,且尚有其它医学重要真菌的相关序列有待鉴定,但该段rDNA含有足够的信息用于区分重要的病原真菌。对不同真菌的该段rDNA进行测序,进行比较分析,可以设计不同种(或属)的特异性引物(或探针)。基于此,我们应用设计的新生隐球菌种特异的内侧引物进行第二轮扩增鉴定。结果除新生隐球菌能扩增出特异性片段外,其它非新生隐球菌菌株或细胞系皆为扩增阴性。模拟临床标本的敏感性试验表明该PCR方法可检出1~5CFU的新生隐球菌,显示出极高的敏感性[2]。应用两轮PCR扩增(通用PCR和随后的种特异性PCR)方法从获得临床标本到鉴定病原菌仅需8小时。采用这种方法,即首先采用ITS真菌通用引物检测病原真菌,随即通过第二轮的种特异性扩增较单纯的种特异性扩增方法更为快速、有效。
, 百拇医药
参考文献
1 Chartier FL, Keer JT, Sutcliffe MJ, et al. Construction of a mouse yeast artificial chromosome library in a recombination-deficient strain of yeast. Nature Genetics, 1992,1:132-136.
2 顾菊林,廖万清,柴建华.聚合酶链反应快速诊断隐球菌性脑膜炎.中华皮肤科杂志,1996,29:319-321.
3 Buchman TG, Rossier M, Merz WG, et al. Detection of surgical pathogens by in vitro DNA amplification. Surgery, 1990,108:338-347.
, 百拇医药
4 Mitchell TG, Freedman EZ, White TJ, et al. Unique oligonucleotide primers in PCR for identification of Cyptococcus neoformans. J Clin Microbiol,1994,32:253-255.
5 White TJ,Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, White TJ,eds. PCR protocols. A guide to methods and applications. Academic Press, San Diego, Calif, 1990.315-322.
6 Mitchell TG,Sandin RL,Bowman BH,et al. Molecular mycology: DNA probes and applications of PCR technology. J Med Vet Mycol,1994,32:suppl 1,351-366., 百拇医药