快速简便筛检乙型肝炎病毒C基因启动子变异的方法及应用
作者:陈金军 侯金林 王战会 汪能平 梁炽森 章廉 骆抗先
单位:510515 广州,第一军医大学南方医院
关键词:肝炎病毒,乙型;变异;多态性,限制性片段长度
中华传染病杂980205 【摘要】 目的 明确中国乙型肝炎病毒(HBV)C基因启动子(BCP)区段变异特点及其可能的临床意义。方法 应用错配聚合酶链反应限制性片段长度多态性(PCR-RFLP)方法,结合核苷酸序列分析,检测143例HBsAg阳性的HBV慢性感染者中X基因/BCP区的核苷酸(nt)1762碱基由A→T和1764碱基由G→A变异。结果 在114份HBV DNA阳性血清中,37例感染BCP变异株,其中31例为慢性肝炎病例,6例为慢性HBV无症状感染者(AsI);其中41例HBeAg阳性AsI中仅2例检出,18例HBeAg阴性AsI中也有4例检出。HBeAg阳性的65例中,13例有BCP区变异,而HBeAg阴性的49例中,24例有BCP区变异(P<0.01)。结论 错配PCR-RFLP检测这一对点突变,具有快速、简便、适用的优点;HBV毒株BCP变异可能与肝病变活动有一定关系。
, 百拇医药
Detection of core promoter sequence mutations of hepatitis B virus by a rapid and simple method Chen Jinjun, Hou Jinlin, Wang Zhanhui, et al. Department of Infectious Diseases, Nanfang Hospital, The First Military Medical University, Guangzhou 510515
【Abstract】 Objective In order to explore the clinical significance and epidemiological characteristics of the variant, we investigated the prevalence of the core promoter variant in 114 Chinese HBV isolates. Methods Mismatched PCR combined with a restriction tragment length polymorphism assay was used in the study. Results The combined mutation of nucleotides(nt)1762 and 1764 in the core promoter from A to T and G to A was detected in 37 individuals, 31 of which suffered with advanced liver diseases and the other 6 were asymptomatic carriers. On the other hand, 13 of 65 HBeAg-positive patients or asymptomatic carriers and 24 of 49 HBeAg-negative cases were found infected with the mutant, respectively. The incidence of core promoter mutant was lower in HBeAg-positive asymptomatic carriers or patients suffered with hepatitis B than those HBeAg negative ones. Conclusion This method for rapid and simple detection of the combined mutation in core promoter should be useful for evaluation of change of core promoter variant population during the course of HBV infection. This study suggest that the core promoter mutations might result in decreased HBeAg synthesis and lead to persistent infection of HBV.
, 百拇医药
【Key words】 Hepatitis B virus Mutation Polymorphism, restriction fragment length
近年已发现HBV/X基因存在多种变异,包括单个核苷酸(nt)点突变、插入和缺失变异等[1~3],但这些变异对病毒和宿主的影响目前尚未阐明。在X基因区存在调控HBV复制的调节序列,包括BCP、C基因上游调节序列以及与之重叠的增强子Ⅱ,如X基因变异涉及上述调节序列将影响HBV复制及病毒抗原表达。
重叠于X基因的BCP区,有3个AT丰富区,其中第1、2个AT丰富区,调控HBV前C基因组mRNA转录,第3个AT丰富区,调控HBV前基因组mRNA转录。BCP区变异多发生在第2个AT丰富区,因此推测可能BCP变异将在转录水平影响HBeAg前体表达,导致血清HBeAg缺失,却不影响HBV前基因组mRNA转录。
最近的研究发现,BCP区nt1762碱基由A→T和1764碱基由G→A变异,可能是另一类HBV感染后HBeAg缺失的原因[3],在本研究中我们设计错配聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)成功地检测BCP区这一联合定向点突变,现初步报告如下。
, http://www.100md.com
对象与方法
一、病例和血清标本
HBsAg阳性HBV感染者143例,均为1995年2月至1996年12月在我院传染病科门诊或病房就诊和治疗的患者。其中男109例,女34例,年龄7~76岁。诊断标准按1995年第五届全国传染病寄生虫病学术会议通过的方案。包括:慢性HBV无症状感染者88例,均肝功能正常,HBsAg阳性时间超过半年以上,其中HBeAg阳性者41例;慢性乙型肝炎38例,其中HBeAg阳性者17例,均经肝活检证实;活动性肝硬化患者17例,其中7例HBeAg阳性。12例A/G比值<1,有不同程度的血清丙氨酸转移酶升高。
二、方法
(一)引物 PCR及序列测定的引物序列
见表1。
, http://www.100md.com
表1 PCR和序列分析引物的资料 名称
核苷酸序列
位置
P7 sense
5′-TCCTCTGCCGATCCATACTG
1254~1273
P8 sense
5′-TCTGCCGATCCATACTGCGG
1257~1276
P9 sense
5′-CAAGGTCTTGCATAAGAGGACT
, 百拇医药
1643~1664
P10 antisense
5′-ATGGTGCTGGTGAACACACC
1815~1796
P11 antisense
5′-CTACAGCCTCCTAGTACAATGA
1786~1765
BC1 antisense
5′-GGAAAGAAGTCAGAAAGGCAA
1774~1755
, http://www.100md.com
(二) 血清HBV标志物检测 HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc-IgM均用酶免疫法。
(三) 血清HBV DNA的抽提[4] 血清和蒸馏水各50μl混匀稀释后,加入100μl裂解液(25mmol/L醋酸铵、2.5mmol/L EDTA、1%SDS、2mg/ml蛋白酶K)和10μg/ml tRNA载体,68℃消化2小时后常规苯酚和氯仿法抽提。
(四) PCR扩增[5] 首先用P9和BC1引物扩增得到X基因下游和前C基因片段,再用错配引物P11与P9扩增144个bp的BCP片段,在此基础上进行PCR-RFLP分析。
(五) PCR-RFLP检测BCP变异 在HBV变异研究中,错配PCR的目的就是要在PCR扩增片段中引进一个限制性内切酶识别序列,从而改变目的DNA的酶切图谱,区别变异株与非变异株[6~8]。按HBV的X基因变异部位核苷酸序列,BCP区nt1762碱基由A→T和1764碱基由G→A双定向点变异常见。设计反义错配引物P11,将点突变附近的一个碱基(nt1767)由A→T,则可在BCP变异株中引进一个Bc1 I(T↑GATCA)酶切位点。正链引物用P9。
, http://www.100md.com
取错配PCR扩增的HBV/BCP片段7μl,Bc1 I酶5~10单位(Promega,Madison,WI),反应体积15μl,50℃酶切2小时。用测序证实的BCP野株和变异株做对照。酶切结果判定:酶切出120bp带,为突变毒株感染;同时有144bp和120bp带说明同时有野毒株和突变毒株感染;酶切后仍仅有144bp带,为单纯野毒株感染。
(六)DNA序列分析 方法见参考文献[5],用引物P7和P10各50pmol扩增得到HBV的X基因片段,测序用P9引物。Promega公司的fmol试剂盒,γ32P-dATP购于北京亚辉公司。
结果
一、变异株和野株的酶切产物琼脂糖凝胶电泳结果
经测序证实的14份血清,其中5例的HBV BCP区有nt1762A→T、1764G→A点突变,用PCR-RFLP分析(附图):酶切出120bp带,为突变毒株感染(1A和1B),2例同时有144bp和120bp带说明同时有野毒株和突变毒株感染(2A和2B);7例酶切后仍仅有144bp带,为单纯野毒株感染(3A和3B),与用测序得到的结果完全一致。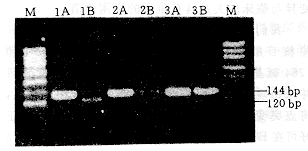
, http://www.100md.com
M:分子量标志物,A:酶切前,B:酶切后
附图 变异株和野株的酶切产物琼脂糖凝胶电泳分析图
二、PCR与酶切反应的最佳条件
我们对PCR和酶切反应的最佳条件进行了探索性研究。由于错配引物在3′端附近有一个碱基与HBV标准序列不配对,我们开始推测可能会影响PCR效果,但发现在PCR前5个循环用较低的复性温度,和全程PCR均用同一复性温度55℃,对结果并无影响。经过优化后的Bc1 I酶切条件:最佳温度为50℃,错配PCR扩增的HBV/BCP片段7μl,Bc1I酶5单位,反应体积15μl,酶切1小时。
三、PCR-RFLP检测114例血清HDV DNA阳性者C基因启动子变异结果
见表2。
, 百拇医药
表2 错配PCR-RFLP检测HBV C基因启动子变异 组 别
总例数
HBV DNA(+)
例数
HBeAg(+)
HBeAg(-)
例数
变异
例数
变异
无症状感染者
88
, http://www.100md.com
59
41
2
18
4
慢性肝病患者
55
55
24
11
31
20
慢性乙型肝炎
, http://www.100md.com 38
38
17
6
21
13
活动性肝硬化
17
17
7
5
10
7
合计
, http://www.100md.com
143
114
65
13(20%)*
49
24(49%)*
P<0.01
其中55例慢性肝病患者中有31例感染BCP区变异株,而59例AsI中仅6例为BCP区变异株感染(P<0.01)。
讨论
最近研究发现:HBV的BCP变异可能影响HBV前C基因组mRNA转录,是HBV感染后HBeAg缺失的原因之一[1,9,10],但目前无法进行较大量临床标本分析,也无中国HBV毒株这一区段变异特点的报告,主要是由于DNA序列分析价昂,费时,技术难度较大,不适于大量临床标本分析。我们设计的PCR-RFLP可用于较大数量筛检BCP变异株,与序列分析结合,对于研究这一热点变异与临床的关系具有重要的实用价值。
, 百拇医药
我们用计算机分析了HBV的X基因变异部位核苷酸序列,BCP区nt1762碱基由A→T和1764碱基由G→A双定向点变异常见,但变异后并未出现新的酶切位点,设计反义错配引物P11,将点突变附近的一个碱基(nt1767)由A→T,则正好可在BCP变异株中引进一个Bc1 I酶切位点。经序列分析证实,结果可靠。在临床和流行病学研究中,可用于较大范围调查该变异株的流行情况和干扰素等药物治疗对其的影响。与光密度扫描计算机图像分析技术结合,可进行野株和变异毒株的相对定量分析,用于监测治疗中野株和变异毒株的动态消长。
通过调查不同肝组织病变和不同HBeAg血清状态的HBV毒株BCP区变异情况,发现nt1762和1764联合点突变在HBeAg阴性慢性肝炎病例较常见,可能由于这一变异影响HBV前C基因组mRNA转录的结果。我们的结果提示这一变异与肝病变活动和感染慢性化有一定关系。在对其中部分病例的回顾性研究中发现:随着炎症活动和感染持续,BCP变异株出现并表现为优势积累,同时发生了HBeAg向抗-HBe的转换。在日本的研究发现这一毒株与重型肝炎的发生发展有一定关系[10]。本研究发现中国HBV毒株BCP区变异较普遍,提示在我国BCP变异是另一HBeAg缺失的原因。这一变异的确切意义需结合对这些病例前C区A83变异的调查进行进一步分析。
, http://www.100md.com
本课题为国家自然科学基金和军队医药卫生基金联合资助项目
参考文献
1 Tanaka S, Yoshiba M, Iino S, et al. A common-source outbreak of fulminant hepatitis B in hemodialysis patients induced by core promoter mutant. Kidney International,1995,48:1972-1978.
2 Lakus T, Rakela J, Nowicki MJ, et al. Hepatitis B virus core promoter sequence analysis in fulminant and chronic hepatitis B. Gastroenterology,1995,109:1618-1623.
, 百拇医药
3 Lakus T, Rakela J, Tong MJ, et al. Naturally occurring hepatitis B mutants with deletions in the core promoter region. J Hepatology,1994,20:837-841.
4 Hou JL, Karayiannis P, Waters J, et al. A uniqe insertion in the S gene of Chinese HBsAg negative hepatitis B virus carriers. Hepatology,1995,21:273-278.
5 侯金林,骆抗先,章廉,等.HBeAg阴性重症肝衰竭病人前C基因信号酶位点变异.中华内科杂志,1995,34:735-738.
6 骆抗先,杨洁,李秀惠,等.前C区A83变异在乙型肝炎病毒感染者中的分布.中华医学杂志,1994,74:478-481.
, 百拇医药
7 Seibel P, Degoul F, Romero N, et al. Identification of point mutations by misparing PCR as exemplified in Merrf disease. Biochem Biophys Res Commun,1990,173:561-565.
8 Lin FH, Lin R. A comparison of single nucleotide primer extension with misparing PCR-RFLP in detecting a point mutation. Biochem Biophys Res Commun,1992,189:1202-1209.
9 Lau JYN, Wright TL. Molecular virology and pathogenesis of hepatitis B. Lancet,1993,342:1335-1338.
10 Sato S, Suzuki K, Akakane Y, et al. Hepatitis B virus strains with mutations in the core promoter in patients with fulminant hepatitis. Annals of Internal Medicine, 1995,122:241-248., http://www.100md.com
单位:510515 广州,第一军医大学南方医院
关键词:肝炎病毒,乙型;变异;多态性,限制性片段长度
中华传染病杂980205 【摘要】 目的 明确中国乙型肝炎病毒(HBV)C基因启动子(BCP)区段变异特点及其可能的临床意义。方法 应用错配聚合酶链反应限制性片段长度多态性(PCR-RFLP)方法,结合核苷酸序列分析,检测143例HBsAg阳性的HBV慢性感染者中X基因/BCP区的核苷酸(nt)1762碱基由A→T和1764碱基由G→A变异。结果 在114份HBV DNA阳性血清中,37例感染BCP变异株,其中31例为慢性肝炎病例,6例为慢性HBV无症状感染者(AsI);其中41例HBeAg阳性AsI中仅2例检出,18例HBeAg阴性AsI中也有4例检出。HBeAg阳性的65例中,13例有BCP区变异,而HBeAg阴性的49例中,24例有BCP区变异(P<0.01)。结论 错配PCR-RFLP检测这一对点突变,具有快速、简便、适用的优点;HBV毒株BCP变异可能与肝病变活动有一定关系。
, 百拇医药
Detection of core promoter sequence mutations of hepatitis B virus by a rapid and simple method Chen Jinjun, Hou Jinlin, Wang Zhanhui, et al. Department of Infectious Diseases, Nanfang Hospital, The First Military Medical University, Guangzhou 510515
【Abstract】 Objective In order to explore the clinical significance and epidemiological characteristics of the variant, we investigated the prevalence of the core promoter variant in 114 Chinese HBV isolates. Methods Mismatched PCR combined with a restriction tragment length polymorphism assay was used in the study. Results The combined mutation of nucleotides(nt)1762 and 1764 in the core promoter from A to T and G to A was detected in 37 individuals, 31 of which suffered with advanced liver diseases and the other 6 were asymptomatic carriers. On the other hand, 13 of 65 HBeAg-positive patients or asymptomatic carriers and 24 of 49 HBeAg-negative cases were found infected with the mutant, respectively. The incidence of core promoter mutant was lower in HBeAg-positive asymptomatic carriers or patients suffered with hepatitis B than those HBeAg negative ones. Conclusion This method for rapid and simple detection of the combined mutation in core promoter should be useful for evaluation of change of core promoter variant population during the course of HBV infection. This study suggest that the core promoter mutations might result in decreased HBeAg synthesis and lead to persistent infection of HBV.
, 百拇医药
【Key words】 Hepatitis B virus Mutation Polymorphism, restriction fragment length
近年已发现HBV/X基因存在多种变异,包括单个核苷酸(nt)点突变、插入和缺失变异等[1~3],但这些变异对病毒和宿主的影响目前尚未阐明。在X基因区存在调控HBV复制的调节序列,包括BCP、C基因上游调节序列以及与之重叠的增强子Ⅱ,如X基因变异涉及上述调节序列将影响HBV复制及病毒抗原表达。
重叠于X基因的BCP区,有3个AT丰富区,其中第1、2个AT丰富区,调控HBV前C基因组mRNA转录,第3个AT丰富区,调控HBV前基因组mRNA转录。BCP区变异多发生在第2个AT丰富区,因此推测可能BCP变异将在转录水平影响HBeAg前体表达,导致血清HBeAg缺失,却不影响HBV前基因组mRNA转录。
最近的研究发现,BCP区nt1762碱基由A→T和1764碱基由G→A变异,可能是另一类HBV感染后HBeAg缺失的原因[3],在本研究中我们设计错配聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)成功地检测BCP区这一联合定向点突变,现初步报告如下。
, http://www.100md.com
对象与方法
一、病例和血清标本
HBsAg阳性HBV感染者143例,均为1995年2月至1996年12月在我院传染病科门诊或病房就诊和治疗的患者。其中男109例,女34例,年龄7~76岁。诊断标准按1995年第五届全国传染病寄生虫病学术会议通过的方案。包括:慢性HBV无症状感染者88例,均肝功能正常,HBsAg阳性时间超过半年以上,其中HBeAg阳性者41例;慢性乙型肝炎38例,其中HBeAg阳性者17例,均经肝活检证实;活动性肝硬化患者17例,其中7例HBeAg阳性。12例A/G比值<1,有不同程度的血清丙氨酸转移酶升高。
二、方法
(一)引物 PCR及序列测定的引物序列
见表1。
, http://www.100md.com
表1 PCR和序列分析引物的资料 名称
核苷酸序列
位置
P7 sense
5′-TCCTCTGCCGATCCATACTG
1254~1273
P8 sense
5′-TCTGCCGATCCATACTGCGG
1257~1276
P9 sense
5′-CAAGGTCTTGCATAAGAGGACT
, 百拇医药
1643~1664
P10 antisense
5′-ATGGTGCTGGTGAACACACC
1815~1796
P11 antisense
5′-CTACAGCCTCCTAGTACAATGA
1786~1765
BC1 antisense
5′-GGAAAGAAGTCAGAAAGGCAA
1774~1755
, http://www.100md.com
(二) 血清HBV标志物检测 HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc-IgM均用酶免疫法。
(三) 血清HBV DNA的抽提[4] 血清和蒸馏水各50μl混匀稀释后,加入100μl裂解液(25mmol/L醋酸铵、2.5mmol/L EDTA、1%SDS、2mg/ml蛋白酶K)和10μg/ml tRNA载体,68℃消化2小时后常规苯酚和氯仿法抽提。
(四) PCR扩增[5] 首先用P9和BC1引物扩增得到X基因下游和前C基因片段,再用错配引物P11与P9扩增144个bp的BCP片段,在此基础上进行PCR-RFLP分析。
(五) PCR-RFLP检测BCP变异 在HBV变异研究中,错配PCR的目的就是要在PCR扩增片段中引进一个限制性内切酶识别序列,从而改变目的DNA的酶切图谱,区别变异株与非变异株[6~8]。按HBV的X基因变异部位核苷酸序列,BCP区nt1762碱基由A→T和1764碱基由G→A双定向点变异常见。设计反义错配引物P11,将点突变附近的一个碱基(nt1767)由A→T,则可在BCP变异株中引进一个Bc1 I(T↑GATCA)酶切位点。正链引物用P9。
, http://www.100md.com
取错配PCR扩增的HBV/BCP片段7μl,Bc1 I酶5~10单位(Promega,Madison,WI),反应体积15μl,50℃酶切2小时。用测序证实的BCP野株和变异株做对照。酶切结果判定:酶切出120bp带,为突变毒株感染;同时有144bp和120bp带说明同时有野毒株和突变毒株感染;酶切后仍仅有144bp带,为单纯野毒株感染。
(六)DNA序列分析 方法见参考文献[5],用引物P7和P10各50pmol扩增得到HBV的X基因片段,测序用P9引物。Promega公司的fmol试剂盒,γ32P-dATP购于北京亚辉公司。
结果
一、变异株和野株的酶切产物琼脂糖凝胶电泳结果
经测序证实的14份血清,其中5例的HBV BCP区有nt1762A→T、1764G→A点突变,用PCR-RFLP分析(附图):酶切出120bp带,为突变毒株感染(1A和1B),2例同时有144bp和120bp带说明同时有野毒株和突变毒株感染(2A和2B);7例酶切后仍仅有144bp带,为单纯野毒株感染(3A和3B),与用测序得到的结果完全一致。

, http://www.100md.com
M:分子量标志物,A:酶切前,B:酶切后
附图 变异株和野株的酶切产物琼脂糖凝胶电泳分析图
二、PCR与酶切反应的最佳条件
我们对PCR和酶切反应的最佳条件进行了探索性研究。由于错配引物在3′端附近有一个碱基与HBV标准序列不配对,我们开始推测可能会影响PCR效果,但发现在PCR前5个循环用较低的复性温度,和全程PCR均用同一复性温度55℃,对结果并无影响。经过优化后的Bc1 I酶切条件:最佳温度为50℃,错配PCR扩增的HBV/BCP片段7μl,Bc1I酶5单位,反应体积15μl,酶切1小时。
三、PCR-RFLP检测114例血清HDV DNA阳性者C基因启动子变异结果
见表2。
, 百拇医药
表2 错配PCR-RFLP检测HBV C基因启动子变异 组 别
总例数
HBV DNA(+)
例数
HBeAg(+)
HBeAg(-)
例数
变异
例数
变异
无症状感染者
88
, http://www.100md.com
59
41
2
18
4
慢性肝病患者
55
55
24
11
31
20
慢性乙型肝炎
, http://www.100md.com 38
38
17
6
21
13
活动性肝硬化
17
17
7
5
10
7
合计
, http://www.100md.com
143
114
65
13(20%)*
49
24(49%)*
P<0.01
其中55例慢性肝病患者中有31例感染BCP区变异株,而59例AsI中仅6例为BCP区变异株感染(P<0.01)。
讨论
最近研究发现:HBV的BCP变异可能影响HBV前C基因组mRNA转录,是HBV感染后HBeAg缺失的原因之一[1,9,10],但目前无法进行较大量临床标本分析,也无中国HBV毒株这一区段变异特点的报告,主要是由于DNA序列分析价昂,费时,技术难度较大,不适于大量临床标本分析。我们设计的PCR-RFLP可用于较大数量筛检BCP变异株,与序列分析结合,对于研究这一热点变异与临床的关系具有重要的实用价值。
, 百拇医药
我们用计算机分析了HBV的X基因变异部位核苷酸序列,BCP区nt1762碱基由A→T和1764碱基由G→A双定向点变异常见,但变异后并未出现新的酶切位点,设计反义错配引物P11,将点突变附近的一个碱基(nt1767)由A→T,则正好可在BCP变异株中引进一个Bc1 I酶切位点。经序列分析证实,结果可靠。在临床和流行病学研究中,可用于较大范围调查该变异株的流行情况和干扰素等药物治疗对其的影响。与光密度扫描计算机图像分析技术结合,可进行野株和变异毒株的相对定量分析,用于监测治疗中野株和变异毒株的动态消长。
通过调查不同肝组织病变和不同HBeAg血清状态的HBV毒株BCP区变异情况,发现nt1762和1764联合点突变在HBeAg阴性慢性肝炎病例较常见,可能由于这一变异影响HBV前C基因组mRNA转录的结果。我们的结果提示这一变异与肝病变活动和感染慢性化有一定关系。在对其中部分病例的回顾性研究中发现:随着炎症活动和感染持续,BCP变异株出现并表现为优势积累,同时发生了HBeAg向抗-HBe的转换。在日本的研究发现这一毒株与重型肝炎的发生发展有一定关系[10]。本研究发现中国HBV毒株BCP区变异较普遍,提示在我国BCP变异是另一HBeAg缺失的原因。这一变异的确切意义需结合对这些病例前C区A83变异的调查进行进一步分析。
, http://www.100md.com
本课题为国家自然科学基金和军队医药卫生基金联合资助项目
参考文献
1 Tanaka S, Yoshiba M, Iino S, et al. A common-source outbreak of fulminant hepatitis B in hemodialysis patients induced by core promoter mutant. Kidney International,1995,48:1972-1978.
2 Lakus T, Rakela J, Nowicki MJ, et al. Hepatitis B virus core promoter sequence analysis in fulminant and chronic hepatitis B. Gastroenterology,1995,109:1618-1623.
, 百拇医药
3 Lakus T, Rakela J, Tong MJ, et al. Naturally occurring hepatitis B mutants with deletions in the core promoter region. J Hepatology,1994,20:837-841.
4 Hou JL, Karayiannis P, Waters J, et al. A uniqe insertion in the S gene of Chinese HBsAg negative hepatitis B virus carriers. Hepatology,1995,21:273-278.
5 侯金林,骆抗先,章廉,等.HBeAg阴性重症肝衰竭病人前C基因信号酶位点变异.中华内科杂志,1995,34:735-738.
6 骆抗先,杨洁,李秀惠,等.前C区A83变异在乙型肝炎病毒感染者中的分布.中华医学杂志,1994,74:478-481.
, 百拇医药
7 Seibel P, Degoul F, Romero N, et al. Identification of point mutations by misparing PCR as exemplified in Merrf disease. Biochem Biophys Res Commun,1990,173:561-565.
8 Lin FH, Lin R. A comparison of single nucleotide primer extension with misparing PCR-RFLP in detecting a point mutation. Biochem Biophys Res Commun,1992,189:1202-1209.
9 Lau JYN, Wright TL. Molecular virology and pathogenesis of hepatitis B. Lancet,1993,342:1335-1338.
10 Sato S, Suzuki K, Akakane Y, et al. Hepatitis B virus strains with mutations in the core promoter in patients with fulminant hepatitis. Annals of Internal Medicine, 1995,122:241-248., http://www.100md.com