肌腱细胞类胰岛素生长因子-1受体密度分析△
作者:杨志明1 项 舟1 邹立群2 彭文珍3 魏大鹏3
单位:1 华西医科大学附属第一医院骨科(四川成都,610041);2 肿瘤生物治疗中心;3 华西医科大学基础医学院
关键词:类胰岛素生长因子-1;受体密度;肌腱细胞;流式细胞仪
摘 要 为了了解类胰岛素生长因子摘 要 为了了解类胰岛素生长因子-1(IGF-1)受体在不同代次体外培养的肌腱细胞的分布,同时观察同一肌腱细胞周期中不同亚时相的IGF-1受体数目的差别,采用免疫组化和流式细胞仪分析法,对体外培养的原代、第6代和第13代肌腱细胞的IGF-1受体密度进行了分析,并以第6代肌腱细胞为对象,进行了同一细胞周期不同亚时相的IGF-1受体数目差别分析。结果表明,IGF-1受体在体外培养的原代、第6代和第13代肌腱细胞的密度大体相同,而在同一细胞周期中分裂前期及分裂期(G2M期)的受体数目比DNA合成前期(G1期)的受体数目多(P<0.01)。提示,在肌腱细胞培养的传代过程中和在同一细胞周期的不同亚时相,肌腱细胞均维持一个相对稳定的IGF-1受体密度。为组织工程人工肌腱的构建和肌腱细胞生长的调控提供了理论基础。
, http://www.100md.com
ANALYSIS OF THE DENSITY OF INSULIN-LIKE GROWTH FACTOR-1 RECEPTOR ON TENDON CELL/Yang Zhiming, Xiang Zhou, Zou liqun et al. Department of Orthopedic Surgery, First University Hospital, West China University of Medical Sciences, Chengdu, P.R. China 610041
Abstract For the purpose of understanding the distribution of insulin-like growth factor-1(IGF-1) receptor on the tendon cell, the continuous cultured tendon cell line was studied by following experiments.With the methods of immunohistochemical study and flow cytometric study, the density of IGF-1 receptor of the primary, 6th and 13th generation of tendon cell was analyzed. The results showed that there was no difference of the receptor density among those generations. However, in the cell cycle, the numbers of IGF-1 receptor in G2M phase tendon cells were more than that in G1 phase cells(P<0.01). These works provided sufficient evident which suggested there were stable density of IGF-1 receptor on the tendon cell though out the life span of tendon cell. This may build some foundation in growth control of tendon cell by growth factor in the research of tendon tissue engineering.
, http://www.100md.com
Key words Insulin-like growth factor-1 Receptor density Tendon cell Flow cytometric study
在肌腱细胞的培养中,我们发现从原代细胞传代到第13代,肌腱细胞的增殖能力就变得十分低下,这种增殖能力的低下又能通过增加外源性类胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)得到部分补偿[1]。这一效应的产生除了外源性加入IGF-1因子外,细胞对该因子的响应是促成该效应的另一个重要方面。许多对IGF-1因子进行深入研究的报道都指出,IGF-1的效应是通过模受体-配体模式产生的[2,3],即对IGF-1产生生物效应的细胞都应该有IGF-1受体。因此,肌腱细胞也具有这一受体。那么,IGF-1受体在肌腱细胞的分布如何,不同代次细胞之间受体密度有无改变,是否与肌腱细胞经多次传代后的繁殖能力低下有关?为了回答这些问题,我们采用免疫组化与流式细胞技术定量分析等方法,对不同代次培养的肌腱细胞的IGF-1受体进行了分析。
, http://www.100md.com
1 材料与方法
1.1 材料来源
肌腱取自水囊引产的5月龄胎儿四肢。F-12培养基系Sigma公司产品。新生小牛血清(FBS)系华西医科大学分子生物学研究室产品,经灭活过滤除菌及去支原体处理。IGF-1系Boehringer Mannheim Biochemica 产品。IGF-1受体的鼠单克隆抗体(IGF-1 Rα)系Santa Cruz Biotechnology,Inc.产品。
1.2 肌腱细胞的培养
按Handerson[4]分步酶消化法分离人胚腱细胞。首先在手术放大镜下剪除肌腱外膜组织,Hank's液洗涤3次,用0.25%胰蛋白酶及0.1%胶原酶将整段肌腱在37℃消化20分钟,再次用Hank's液洗涤3次。将余下的腱段剪成1 mm3~2 mm3碎块,再用上述浓度的胰蛋白酶及胶原酶混合液在37℃消化1小时,用新生小牛血清终止消化后过滤去除碎块,滤液4 000 r/min离心10分钟。弃上清液。用培养液洗一次。再用培养液悬浮细胞,经细胞计数,将细胞密度调至1×105个/ml,接种于培养瓶中培养。培养液由F-12培养基加10%新生小牛血清,青霉素、链霉素各100 U/ml,抗坏血酸50 μg/ml组成。在原代培养的人胚腱细胞贴壁并融合成单层细胞后,进行传代培养。培养条件为37℃恒温,5% CO2浓度,饱和温度。
, 百拇医药
1.3 免疫组化检测
将不同代次的肌腱细胞培养于经处理的盖玻片上,倒置显微镜观察生长良好后,用丙酮、甲醇液固定10分钟。取已固定的细胞片,浸入0.75% H2O2 -PBS,37℃,30分钟,以阻断内源性过氧化物酶。滴加25%小牛血清,置于湿盒内,37℃保温30分钟,以消除非特异性染色。弃去血清。滴加25%小牛血清-PBS配制的1∶100的IGF-1 Rα,4℃下过夜。滴加生物素化马抗鼠IgG,37℃,30分钟。滴加ABC复合剂,37℃,30分钟。将新鲜配制的DAB(由ABC Immuno-Detects试剂盒提供)溶液加到切片上,在室温下置暗处10分钟后于显微镜下观察显色。显色完成后浸入PBS中终止显色。逐级脱水,透明,用中性树脂封片。
每例均以省略一抗作空白对照。
1.4 抗体饱和试验
, http://www.100md.com
将对数生长期的单层培养肌腱细胞制成细胞悬液,移入离心管中。4 000 r/min离心5分钟,弃上清液,留0.5 ml细胞悬液,用振荡器使细胞分散。分别取1×106个细胞加入6个试管中并按等倍稀释浓度加入第一抗体IGF-1 Rα,4℃孵育30分钟。PBS洗涤后加入荧光标记的第二抗体,4℃孵育30分钟。用COULTER EPICS ELITE ESP型流式细胞仪(日本产)检测,每个样本采集1×104个细胞,用Elite分析软件进行分析[5]。
1.5 IGF-1受体密度分析
将原代、第6代及第13代肌腱细胞依照上述方法制成悬液,按饱和浓度加入IGF-1 Rα,4℃孵育30分钟。PBS洗涤两次后加入荧光标记的二抗,4℃孵育30分钟后按上述方法用流式细胞仪检测分析[5]。
1.6 细胞周期不同亚时相IGF-1受体的检测
, http://www.100md.com
取第6代肌腱细胞培养如前述。按上述步骤作一抗结合及荧光染色。用含1%皂角素的PBS洗涤、离心两次。弃去上清液,加入1.5 ml碘化丙啶(PI,50 μg/ml)及RNA酶A 2 μl(20 mg/ml),室温放置30分钟。用流式细胞仪检测,每个样本采集1×104个细胞,用Elite分析软件进行分析[5]。
本实验结果由三次独立的重复实验得出。
2 结果
2.1 免疫组化检测
原代、第6代及第13代肌腱细胞IGF-1受体的免疫组化检测结果见图1a~c。从图1可见,原代、第6代及第13代肌腱细胞均有阳性信号。表明不同代次的肌腱细胞均有IGF-1受体存在。
2.2 不同代次肌腱细胞IGF-1受体密度分析
, http://www.100md.com
等倍稀释的IGF-1 Rα与肌腱细胞作用后,经流式细胞仪检测的结果见图2。结果显示,使肌腱细胞受体抗原位点达到饱和的抗体稀释浓度为1∶200,实际应用为1∶100,以保证抗体过量,从而使每代细胞受体的抗原位点饱和。
原代、第6代及第13代肌腱细胞受体密度的检测结果见图3。结果表明,原代、第6代及第13代肌腱细胞IGF-1的平均荧光强度无明显差别。可见,不同代次肌腱细胞的IGF-1受体密度无明显变化。
2.3 肌腱细胞不同亚时相IGF-1受体数目变化
肌腱细胞DNA合成前期(G1期)、分裂前期及分裂期(G2M期)IGF-1受体的相对量以平均荧光强度表示,检测结果见图4。结果显示G1期IGF-1受体平均荧光强度为3.25±0.31,G2M期为6.54±0.17,经t检验有显著性差异(P<0.01)。表明,在细胞周期中,G2M期细胞表面IGF-1受体密度比G1期细胞表面的IGF-1受体密度高。
, 百拇医药
图1 原代、第6代及第13代肌腱细胞(IGF-1 Rα染色,ABC ×250)
a 原代 b 第6代 c 第13代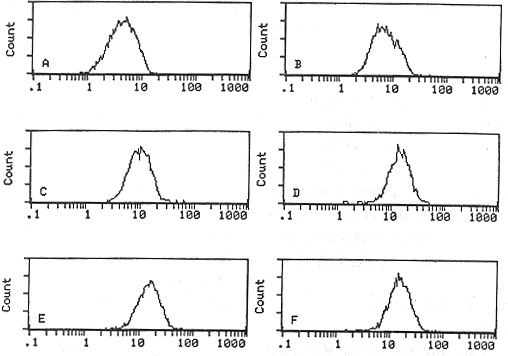
图2 IGF-1受体饱和实验结果(流式细胞仪检测)
A:1∶1 600 B:1∶800 C:1∶400 D:1∶200 E:1∶100 F:1∶50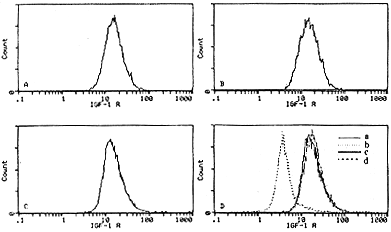
图3 不同代次肌腱细胞的IGF-1受体平均荧光强度及其比较(流式细胞仪检测)
, http://www.100md.com
A 原代肌腱细胞 B 第6代肌腱细胞 C 第13代肌腱细胞 D 上述三种细胞受体密度的比较,a,b,c 峰值重叠,表明三种细胞受体密度无显著差异(d峰为空白对照)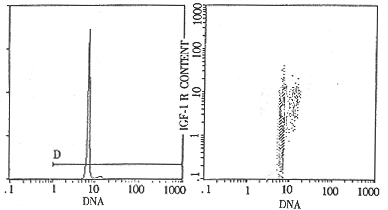
图4 肌腱细胞各亚时相受体相对数目流式细胞仪分析图
3 讨论
肌腱缺损和肌腱粘连是导致手部创伤后功能障碍的一个重要原因,也是手部创伤与功能重建领域的一个亟待解决的重要课题。随着创伤与功能重建这一领域的发展和创新,对肌腱的修复已从单一的自体肌腱转移或移植发展到了采用包括自体、异体、异种和人造肌腱等多种供体和材料修复。随着对肌腱组织、细胞及亚细胞结构和功能认识的深入及材料科学的发展,采用组织培养技术和材料技术相结合的新兴技术——组织工程技术,将活的肌腱细胞与人造可吸收材料复合培养,形成新型活性人工肌腱将成为现实。
, 百拇医药
我们在肌腱细胞培养成功的基础上[6],初步进行了肌腱细胞与碳纤维复合, 并植入动物体内的实验研究[7]。发现构建新型活性人工肌腱最大的难题是肌腱细胞生长缓慢,且经13次传代后, 其增殖能力变得十分低下, 显然不适应组织工程的需要。 通过研究,我们发现IGF-1对肌腱细胞的增殖有明显的促进作用[1],而且这一作用是通过IGF-1-受体系统的激活得以实现的。 说明IGF-1-受体系统在细胞的增殖过程中有着十分重要的作用。 许多对IGF-1因子进行深入研究的报道指出,IGF-1的效应是通过模受体-配体模式产生的[2,3]。在受体-配体型生物效应模式中, 这一体系的两方面因素都会影响细胞的生物效应。在同一浓度配体的作用下,不同细胞可由于受体密度的不同,产生非常大,甚至是有和无的巨大生物效应差别。要研究为什么不同代次的肌腱细胞,IGF-1的促生长作用有差异,就必须了解其受体密度的情况。
为准确估计肌腱细胞受体的量,必须用超量的抗体, 使所有IGF-1受体的抗原决定簇都与其特异抗体IGF-1 Rα结合,通过带FITC荧光的第二抗体与IGF-1 Rα的特异结合,将IGF-1受体的数目转化成流式细胞仪可以准确定量测知的荧光强度。通过等倍稀释的IGF-1 Rα与等量肌腱细胞作用,可以测知使细胞群体表面受体全部结合的饱和浓度。所以,在饱和抗体浓度条件下便可测得一定数量细胞群体的IGF-1受体密度,以平均荧光强度表示。流式细胞仪通常在每一细胞群体中采集1×104个细胞作为样本分析,这样不同细胞的受体密度差别就可直接由流式细胞仪所记录的描记线上反映,也可由经过流式细胞仪的电脑分析软件所得出的平均荧光强度的值来反映。在记录曲线上,荧光峰值越靠右,表明该细胞群体的平均荧光强度越强,细胞的受体密度越大。 经传统的免疫组化法证实,原代、第6代及第13代肌腱细胞的膜系统上均具有IGF-1受体。为了精确定量受体,我们又采用了流式细胞定量分析法对不同代次肌腱细胞的受体密度进行定量分析,借以比较其受体密度的差别。 经流式细胞定量分析,不同代次肌腱细胞IGF-1受体的荧光强度无明显差别。表明,IGF-1受体在各代次细胞膜系统中的密度大体相同。因此可以认为,IGF-1作用于第13代细胞产生的促生长作用低于原代和第6代肌腱细胞,不是由于受体密度降低所造成,并且第13代肌腱细胞增殖能力低下[1]与IGF-1受体密度无关。
, 百拇医药
在细胞周期中,G1期是上一个增殖周期完成有丝分裂后到DNA合成期前这一段时期,是细胞质复制的主要阶段;G2期发生在DNA合成后和本次细胞分裂之前;M期是细胞有丝分裂期,细胞经过此期后分裂为两个子细胞[8]。G2M期的特点是细胞表面上仍是一个细胞, 但DNA含量加倍,并且经过G1期细胞质的复制,细胞体积增大,膜面积也相应增大,为细胞分裂为两个子代细胞作了物质上的充分准备。 在检测中,因为肌腱细胞G1期、G2M期在同一细胞群体中所占百分比不同,所以测得的各亚时相的平均荧光强度不能直接用于分析,必须各自乘以该亚时相所占百分比,从而得到各亚时相受体数目的相对量才能进行比较。流式细胞仪的电脑分析软件可对这一过程自动进行分析,因此可以直观地在记录的描记线上看到IGF-1受体在细胞周期各亚时相的相对量,也可由电脑分析出各亚时相受体的相对数目,仍以平均荧光强度表示。 本实验结果,G2M期的IGF-1受体数目增加说明该受体也随着细胞整个物质量的增加而增加,从而保证了该受体在一定膜面积上的数目的稳定,为IGF-1-受体系统在细胞生命过程中持续稳定地发挥其生理功能打下了物质基础。
, 百拇医药
总之, 无论是在肌腱细胞培养群体的生命期(life span of cell culture)还是在每个细胞周期的亚时相,IGF-1受体总维持着其相对密度。这一现象表明,IGF-1-受体系统的功能在肌腱细胞的生命活动中始终扮演着十分重要的角色。
4 参考文献
1 项 舟,杨志明,魏大鹏等.类胰岛素生长因子-1促腱细胞生长的实验研究.中华手外科杂志,1997;13(3):183
2 Rechier MM, Nissley SP. The nature and regulation of the receptors for insulin-like growth factors. Annu Rev Physiol 1985; 47: 425
3 Froesch ER, Schmid C, Schwander J et al. Actions of insulin-like growth factors. Annu Rev Physiol 1985; 47: 443
, 百拇医药
4 Handerson G. Attachment and extracellular matrix differences between tendon and synovial fibroblastic cells. In Vitro, 1983;19(2):127
5 宋平根,李素文主编.流式细胞术的原理和应用.北京:北京师范大学出版社,1992:52~56,130~131,141~142
6 蔚 凡,杨志明,彭文珍.人胚腱细胞体外培养及生物特性研究.中国修复重建外科杂志,1995;9(3):161
7 张前法,杨志明,彭文珍.兔肌腱细胞和成纤维细胞与人工材料体外联合培养的形态学观察.中国修复重建外科杂志,1997;11(2):103
8 鄂 征主编.组织培养和分子细胞学技术.北京:北京出版社,1995:20~21
△ 国家自然科学基金资助项目
(收稿:1998-01-30), 百拇医药
单位:1 华西医科大学附属第一医院骨科(四川成都,610041);2 肿瘤生物治疗中心;3 华西医科大学基础医学院
关键词:类胰岛素生长因子-1;受体密度;肌腱细胞;流式细胞仪
摘 要 为了了解类胰岛素生长因子摘 要 为了了解类胰岛素生长因子-1(IGF-1)受体在不同代次体外培养的肌腱细胞的分布,同时观察同一肌腱细胞周期中不同亚时相的IGF-1受体数目的差别,采用免疫组化和流式细胞仪分析法,对体外培养的原代、第6代和第13代肌腱细胞的IGF-1受体密度进行了分析,并以第6代肌腱细胞为对象,进行了同一细胞周期不同亚时相的IGF-1受体数目差别分析。结果表明,IGF-1受体在体外培养的原代、第6代和第13代肌腱细胞的密度大体相同,而在同一细胞周期中分裂前期及分裂期(G2M期)的受体数目比DNA合成前期(G1期)的受体数目多(P<0.01)。提示,在肌腱细胞培养的传代过程中和在同一细胞周期的不同亚时相,肌腱细胞均维持一个相对稳定的IGF-1受体密度。为组织工程人工肌腱的构建和肌腱细胞生长的调控提供了理论基础。
, http://www.100md.com
ANALYSIS OF THE DENSITY OF INSULIN-LIKE GROWTH FACTOR-1 RECEPTOR ON TENDON CELL/Yang Zhiming, Xiang Zhou, Zou liqun et al. Department of Orthopedic Surgery, First University Hospital, West China University of Medical Sciences, Chengdu, P.R. China 610041
Abstract For the purpose of understanding the distribution of insulin-like growth factor-1(IGF-1) receptor on the tendon cell, the continuous cultured tendon cell line was studied by following experiments.With the methods of immunohistochemical study and flow cytometric study, the density of IGF-1 receptor of the primary, 6th and 13th generation of tendon cell was analyzed. The results showed that there was no difference of the receptor density among those generations. However, in the cell cycle, the numbers of IGF-1 receptor in G2M phase tendon cells were more than that in G1 phase cells(P<0.01). These works provided sufficient evident which suggested there were stable density of IGF-1 receptor on the tendon cell though out the life span of tendon cell. This may build some foundation in growth control of tendon cell by growth factor in the research of tendon tissue engineering.
, http://www.100md.com
Key words Insulin-like growth factor-1 Receptor density Tendon cell Flow cytometric study
在肌腱细胞的培养中,我们发现从原代细胞传代到第13代,肌腱细胞的增殖能力就变得十分低下,这种增殖能力的低下又能通过增加外源性类胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)得到部分补偿[1]。这一效应的产生除了外源性加入IGF-1因子外,细胞对该因子的响应是促成该效应的另一个重要方面。许多对IGF-1因子进行深入研究的报道都指出,IGF-1的效应是通过模受体-配体模式产生的[2,3],即对IGF-1产生生物效应的细胞都应该有IGF-1受体。因此,肌腱细胞也具有这一受体。那么,IGF-1受体在肌腱细胞的分布如何,不同代次细胞之间受体密度有无改变,是否与肌腱细胞经多次传代后的繁殖能力低下有关?为了回答这些问题,我们采用免疫组化与流式细胞技术定量分析等方法,对不同代次培养的肌腱细胞的IGF-1受体进行了分析。
, http://www.100md.com
1 材料与方法
1.1 材料来源
肌腱取自水囊引产的5月龄胎儿四肢。F-12培养基系Sigma公司产品。新生小牛血清(FBS)系华西医科大学分子生物学研究室产品,经灭活过滤除菌及去支原体处理。IGF-1系Boehringer Mannheim Biochemica 产品。IGF-1受体的鼠单克隆抗体(IGF-1 Rα)系Santa Cruz Biotechnology,Inc.产品。
1.2 肌腱细胞的培养
按Handerson[4]分步酶消化法分离人胚腱细胞。首先在手术放大镜下剪除肌腱外膜组织,Hank's液洗涤3次,用0.25%胰蛋白酶及0.1%胶原酶将整段肌腱在37℃消化20分钟,再次用Hank's液洗涤3次。将余下的腱段剪成1 mm3~2 mm3碎块,再用上述浓度的胰蛋白酶及胶原酶混合液在37℃消化1小时,用新生小牛血清终止消化后过滤去除碎块,滤液4 000 r/min离心10分钟。弃上清液。用培养液洗一次。再用培养液悬浮细胞,经细胞计数,将细胞密度调至1×105个/ml,接种于培养瓶中培养。培养液由F-12培养基加10%新生小牛血清,青霉素、链霉素各100 U/ml,抗坏血酸50 μg/ml组成。在原代培养的人胚腱细胞贴壁并融合成单层细胞后,进行传代培养。培养条件为37℃恒温,5% CO2浓度,饱和温度。
, 百拇医药
1.3 免疫组化检测
将不同代次的肌腱细胞培养于经处理的盖玻片上,倒置显微镜观察生长良好后,用丙酮、甲醇液固定10分钟。取已固定的细胞片,浸入0.75% H2O2 -PBS,37℃,30分钟,以阻断内源性过氧化物酶。滴加25%小牛血清,置于湿盒内,37℃保温30分钟,以消除非特异性染色。弃去血清。滴加25%小牛血清-PBS配制的1∶100的IGF-1 Rα,4℃下过夜。滴加生物素化马抗鼠IgG,37℃,30分钟。滴加ABC复合剂,37℃,30分钟。将新鲜配制的DAB(由ABC Immuno-Detects试剂盒提供)溶液加到切片上,在室温下置暗处10分钟后于显微镜下观察显色。显色完成后浸入PBS中终止显色。逐级脱水,透明,用中性树脂封片。
每例均以省略一抗作空白对照。
1.4 抗体饱和试验
, http://www.100md.com
将对数生长期的单层培养肌腱细胞制成细胞悬液,移入离心管中。4 000 r/min离心5分钟,弃上清液,留0.5 ml细胞悬液,用振荡器使细胞分散。分别取1×106个细胞加入6个试管中并按等倍稀释浓度加入第一抗体IGF-1 Rα,4℃孵育30分钟。PBS洗涤后加入荧光标记的第二抗体,4℃孵育30分钟。用COULTER EPICS ELITE ESP型流式细胞仪(日本产)检测,每个样本采集1×104个细胞,用Elite分析软件进行分析[5]。
1.5 IGF-1受体密度分析
将原代、第6代及第13代肌腱细胞依照上述方法制成悬液,按饱和浓度加入IGF-1 Rα,4℃孵育30分钟。PBS洗涤两次后加入荧光标记的二抗,4℃孵育30分钟后按上述方法用流式细胞仪检测分析[5]。
1.6 细胞周期不同亚时相IGF-1受体的检测
, http://www.100md.com
取第6代肌腱细胞培养如前述。按上述步骤作一抗结合及荧光染色。用含1%皂角素的PBS洗涤、离心两次。弃去上清液,加入1.5 ml碘化丙啶(PI,50 μg/ml)及RNA酶A 2 μl(20 mg/ml),室温放置30分钟。用流式细胞仪检测,每个样本采集1×104个细胞,用Elite分析软件进行分析[5]。
本实验结果由三次独立的重复实验得出。
2 结果
2.1 免疫组化检测
原代、第6代及第13代肌腱细胞IGF-1受体的免疫组化检测结果见图1a~c。从图1可见,原代、第6代及第13代肌腱细胞均有阳性信号。表明不同代次的肌腱细胞均有IGF-1受体存在。
2.2 不同代次肌腱细胞IGF-1受体密度分析
, http://www.100md.com
等倍稀释的IGF-1 Rα与肌腱细胞作用后,经流式细胞仪检测的结果见图2。结果显示,使肌腱细胞受体抗原位点达到饱和的抗体稀释浓度为1∶200,实际应用为1∶100,以保证抗体过量,从而使每代细胞受体的抗原位点饱和。
原代、第6代及第13代肌腱细胞受体密度的检测结果见图3。结果表明,原代、第6代及第13代肌腱细胞IGF-1的平均荧光强度无明显差别。可见,不同代次肌腱细胞的IGF-1受体密度无明显变化。
2.3 肌腱细胞不同亚时相IGF-1受体数目变化
肌腱细胞DNA合成前期(G1期)、分裂前期及分裂期(G2M期)IGF-1受体的相对量以平均荧光强度表示,检测结果见图4。结果显示G1期IGF-1受体平均荧光强度为3.25±0.31,G2M期为6.54±0.17,经t检验有显著性差异(P<0.01)。表明,在细胞周期中,G2M期细胞表面IGF-1受体密度比G1期细胞表面的IGF-1受体密度高。

, 百拇医药
图1 原代、第6代及第13代肌腱细胞(IGF-1 Rα染色,ABC ×250)
a 原代 b 第6代 c 第13代

图2 IGF-1受体饱和实验结果(流式细胞仪检测)
A:1∶1 600 B:1∶800 C:1∶400 D:1∶200 E:1∶100 F:1∶50

图3 不同代次肌腱细胞的IGF-1受体平均荧光强度及其比较(流式细胞仪检测)
, http://www.100md.com
A 原代肌腱细胞 B 第6代肌腱细胞 C 第13代肌腱细胞 D 上述三种细胞受体密度的比较,a,b,c 峰值重叠,表明三种细胞受体密度无显著差异(d峰为空白对照)

图4 肌腱细胞各亚时相受体相对数目流式细胞仪分析图
3 讨论
肌腱缺损和肌腱粘连是导致手部创伤后功能障碍的一个重要原因,也是手部创伤与功能重建领域的一个亟待解决的重要课题。随着创伤与功能重建这一领域的发展和创新,对肌腱的修复已从单一的自体肌腱转移或移植发展到了采用包括自体、异体、异种和人造肌腱等多种供体和材料修复。随着对肌腱组织、细胞及亚细胞结构和功能认识的深入及材料科学的发展,采用组织培养技术和材料技术相结合的新兴技术——组织工程技术,将活的肌腱细胞与人造可吸收材料复合培养,形成新型活性人工肌腱将成为现实。
, 百拇医药
我们在肌腱细胞培养成功的基础上[6],初步进行了肌腱细胞与碳纤维复合, 并植入动物体内的实验研究[7]。发现构建新型活性人工肌腱最大的难题是肌腱细胞生长缓慢,且经13次传代后, 其增殖能力变得十分低下, 显然不适应组织工程的需要。 通过研究,我们发现IGF-1对肌腱细胞的增殖有明显的促进作用[1],而且这一作用是通过IGF-1-受体系统的激活得以实现的。 说明IGF-1-受体系统在细胞的增殖过程中有着十分重要的作用。 许多对IGF-1因子进行深入研究的报道指出,IGF-1的效应是通过模受体-配体模式产生的[2,3]。在受体-配体型生物效应模式中, 这一体系的两方面因素都会影响细胞的生物效应。在同一浓度配体的作用下,不同细胞可由于受体密度的不同,产生非常大,甚至是有和无的巨大生物效应差别。要研究为什么不同代次的肌腱细胞,IGF-1的促生长作用有差异,就必须了解其受体密度的情况。
为准确估计肌腱细胞受体的量,必须用超量的抗体, 使所有IGF-1受体的抗原决定簇都与其特异抗体IGF-1 Rα结合,通过带FITC荧光的第二抗体与IGF-1 Rα的特异结合,将IGF-1受体的数目转化成流式细胞仪可以准确定量测知的荧光强度。通过等倍稀释的IGF-1 Rα与等量肌腱细胞作用,可以测知使细胞群体表面受体全部结合的饱和浓度。所以,在饱和抗体浓度条件下便可测得一定数量细胞群体的IGF-1受体密度,以平均荧光强度表示。流式细胞仪通常在每一细胞群体中采集1×104个细胞作为样本分析,这样不同细胞的受体密度差别就可直接由流式细胞仪所记录的描记线上反映,也可由经过流式细胞仪的电脑分析软件所得出的平均荧光强度的值来反映。在记录曲线上,荧光峰值越靠右,表明该细胞群体的平均荧光强度越强,细胞的受体密度越大。 经传统的免疫组化法证实,原代、第6代及第13代肌腱细胞的膜系统上均具有IGF-1受体。为了精确定量受体,我们又采用了流式细胞定量分析法对不同代次肌腱细胞的受体密度进行定量分析,借以比较其受体密度的差别。 经流式细胞定量分析,不同代次肌腱细胞IGF-1受体的荧光强度无明显差别。表明,IGF-1受体在各代次细胞膜系统中的密度大体相同。因此可以认为,IGF-1作用于第13代细胞产生的促生长作用低于原代和第6代肌腱细胞,不是由于受体密度降低所造成,并且第13代肌腱细胞增殖能力低下[1]与IGF-1受体密度无关。
, 百拇医药
在细胞周期中,G1期是上一个增殖周期完成有丝分裂后到DNA合成期前这一段时期,是细胞质复制的主要阶段;G2期发生在DNA合成后和本次细胞分裂之前;M期是细胞有丝分裂期,细胞经过此期后分裂为两个子细胞[8]。G2M期的特点是细胞表面上仍是一个细胞, 但DNA含量加倍,并且经过G1期细胞质的复制,细胞体积增大,膜面积也相应增大,为细胞分裂为两个子代细胞作了物质上的充分准备。 在检测中,因为肌腱细胞G1期、G2M期在同一细胞群体中所占百分比不同,所以测得的各亚时相的平均荧光强度不能直接用于分析,必须各自乘以该亚时相所占百分比,从而得到各亚时相受体数目的相对量才能进行比较。流式细胞仪的电脑分析软件可对这一过程自动进行分析,因此可以直观地在记录的描记线上看到IGF-1受体在细胞周期各亚时相的相对量,也可由电脑分析出各亚时相受体的相对数目,仍以平均荧光强度表示。 本实验结果,G2M期的IGF-1受体数目增加说明该受体也随着细胞整个物质量的增加而增加,从而保证了该受体在一定膜面积上的数目的稳定,为IGF-1-受体系统在细胞生命过程中持续稳定地发挥其生理功能打下了物质基础。
, 百拇医药
总之, 无论是在肌腱细胞培养群体的生命期(life span of cell culture)还是在每个细胞周期的亚时相,IGF-1受体总维持着其相对密度。这一现象表明,IGF-1-受体系统的功能在肌腱细胞的生命活动中始终扮演着十分重要的角色。
4 参考文献
1 项 舟,杨志明,魏大鹏等.类胰岛素生长因子-1促腱细胞生长的实验研究.中华手外科杂志,1997;13(3):183
2 Rechier MM, Nissley SP. The nature and regulation of the receptors for insulin-like growth factors. Annu Rev Physiol 1985; 47: 425
3 Froesch ER, Schmid C, Schwander J et al. Actions of insulin-like growth factors. Annu Rev Physiol 1985; 47: 443
, 百拇医药
4 Handerson G. Attachment and extracellular matrix differences between tendon and synovial fibroblastic cells. In Vitro, 1983;19(2):127
5 宋平根,李素文主编.流式细胞术的原理和应用.北京:北京师范大学出版社,1992:52~56,130~131,141~142
6 蔚 凡,杨志明,彭文珍.人胚腱细胞体外培养及生物特性研究.中国修复重建外科杂志,1995;9(3):161
7 张前法,杨志明,彭文珍.兔肌腱细胞和成纤维细胞与人工材料体外联合培养的形态学观察.中国修复重建外科杂志,1997;11(2):103
8 鄂 征主编.组织培养和分子细胞学技术.北京:北京出版社,1995:20~21
△ 国家自然科学基金资助项目
(收稿:1998-01-30), 百拇医药