脊神经节损伤的组织形态学与电生理改变
作者:周 跃1 廖维宏2 梅芳瑞1 刘正津3
单位:1 第三军医大学附属新桥医院骨科(重庆,400037);2 第三军医大学附属野战外科研究所;3 第三军医大学解剖学教研室
关键词:脊神经节;超微结构;脊髓诱发电位;利多卡因
中国修复重建外科杂志980306 摘 要 脊神经节(DRG)损伤常引起感觉及运动功能障碍,为了探索DRG不同损伤方式和不同损伤时间的脊髓诱发电位(SEP)和DRG组织形态学改变,用52只家兔,分别制成机械压迫、炎性损伤模型,以及2%利多卡因加2.5%醋酸氢化泼尼松局部治疗,并与未损伤组作对比研究。结果表明,DRG血管内皮细胞连接间隙增宽是机械性损伤导致血管通透性增加的主要原因,而血管内皮细胞连接间隙增宽,以及血管内皮细胞吞饮小泡转运功能增强,是炎性损伤导致血管通透性增加的主要原因。认为,2%利多卡因加2.5%醋酸氢化泼尼松局部浸润能显著减轻DRG炎性损伤。
, 百拇医药
HISTOLOGICAL AND ELECTROPHYSIOLOGIC CHANGES OF INJURY OF DORSAL ROOT GANGLIA/Zhou Yue, Liao Weihong, Mei Fangrui et al. Department of Orthopedic Surgery, Second Affiliated Hospital, Third Military Medical University, Chongqing, P. R. China 400037
Abstract Injury of dorsal root ganglia (DRG) may cause sensory and motor dysfunction. In order to investigate the changes of somato-sensory evoked potential (SEP) and histological characteristics of DRG in different causes and different periods of injury, fifty-two rabbits were chosed to build the models. The rabbits were divided into 4 groups: Control group (n=4); mechanical compressing group (n=16); inflammatory injury group (n=16); and treatment group (2% lidocaine with hydroprednisone was administered locally, n=16). After one to eight weeks, SEP was determined and samples of DRG were obtained to observe the histological and ultrastructural changes every week. The result showed that the gap junction of microvascular endothelium in DRG had been destroyed by the mechanical compression was the major cause of the vessel permeability increasing. The increasing of endothelial pinocytic vesicles transportation and widening of endothelial gap junction were the main causes of inflammatory irritation of DRG. The local infiltration with 2% lidocaine and hydroprednisone could obviously ameliorate inflammatory injury in DRG.
, 百拇医药
Key words Dorsal root ganglia Somato-sensory evoked potential Ultrastructure Lodocaine
因椎间盘突出、椎管狭窄和脊柱退行性改变所造成的脊神经根(spinal nerve root, SNR)和脊神经节(dorsal root ganglia, DRG)损伤,常常引起感觉和运动功能障碍,以及神经行为异常。DRG是机体内外环境与脊髓连接的纽带,具有传输和调节机体的各种感觉,接受和传递各种伤害性感受的功能。我们研究的目的是探讨DRG不同损伤方式和不同损伤时间组织形态学和损伤前后脊髓诱发电位(somatosensory evoked potential, SEP)的变化规律及特点。
1 材料与方法
1.1 动物及分组
健康家兔52只,雌雄不拘。随机分为:A组(正常对照组,n=4),B组(机械性压迫组,n=16),C组(炎性损伤组,n=16),D组(治疗组,n=16)。
, http://www.100md.com
1.2 模型复制
3%戊巴比妥钠(0.5 ml/kg~1 ml/kg)耳静脉麻醉,常规消毒铺无菌巾。腰骶部后正中切口,咬除L5~7棘突和椎板。手术显微镜下仔细显露双侧DRG5,和DRG6。左侧为损伤侧,右侧为非损伤侧。B组采用2枚微型手术血管夹,夹宽2 mm,张开距3 mm,压力0.441 N,分别压迫左侧DRG5和DRG6。
C组采用4/0铬制肠线,剪成长0.5 cm,取4条~6条,沿左侧DRG5和DRG6周围纵轴排列放置,并用无菌手术骨蜡固定,1层~2层明胶海绵覆盖在硬脊膜表面,缝合伤口,送动物室饲养。D组采用与C组相同的损伤模型,但当模型制作完毕后,直视下在DRG旁侧分别放置1根无菌医用2FX聚乙烯肝素内衬导管,并将导管固定。术后1周~8周,每周经导管推注2%利多卡因0.5 ml加2.5%醋酸氢化泼尼松注射液0.5 ml,2次/周。A组除局部不放置铬制肠线外,其手术显露和术后处理均与C组相同,A组为正常对照组,而B组、C组和D组右侧的DRG5和DRG6为自身对照组。
, http://www.100md.com
1.3 观测指标
1.3.1 SEP测定 采用双银丝(间距4 mm)刺激保护电极,经手术将电极固定在实验侧胫神经上。记录电极采用双银球记录电极(直径0.6 mm,间距4 mm),放置在实验侧DRG的传入神经进入脊髓背角平面的硬脊膜外。参考电极放置在实验侧皮下。温热石蜡油保护好脊髓和DRG。刺激用恒流电采用宽度0.2 ms~0.5 ms的方波脉冲,刺激强度为受刺激神经所支配肌肉出现轻微抽动。刺激频率为4 Hz,叠加次数50次,分析时间20 ms。采用WD-4 000神经电位诊断仪测定。A组的测定值作为各组术前正常值,B组、C组和D组分别在术后1,2,4及8周各取4只家兔测定SEP的变化。
1.3.2 DRG组织学观察
常规光镜切片 术后开胸,升主动脉插管灌注0.9%生理盐水和4%多聚甲醛液(0.1 mol/L,pH7.4,4℃)1 500 ml~2 000 ml,2小时后取标本置入相同固定液再固定24小时,修整,石蜡包埋,常规切片和HE染色、Van Giesson氏染色、Toluidine blue氏染色,Olympus生物显微镜下观察。
, http://www.100md.com
常规电镜标本 灌注固定后取标本,在解剖显微镜下将标本修剪成1 mm3的组织小块。再置入2%锇酸(OsO4)中固定,系列丙酮脱水,环氧树酯包埋,超薄切片,醋酸铀-枸橼酸铅双层染色,JEM-200型日立电子显微镜观察。
1.3.3 统计学处理 实验结果的数据统计均在486/DX266型微机上,采用Microsoft Excel 5.0的统计程序,行样本单因素和多因素方差分析,显著性t检验。
2 结果
2.1 SEP测定结果
2.1.1 DRG机械性压迫损伤 正常家兔脊髓SEP由两个向下的正波和两个向上的负波构成,分别定义为P1、P2、N1和N2波。研究表明,A组N1波平均潜伏期为(1.36±0.27) ms,P1波的平均潜伏期为(2.23±0.32) ms。当B组DRG机械性压迫期间,SEP的潜伏期(N1和P1)明显延长(P<0.05),与A组相比,其潜伏期延长率分别为64.3%和60.7%(附表)。
, 百拇医药
2.1.2 DRG炎性损伤 术后1周,潜伏期无显著变化,术后2周~4周SEP的潜伏期(N1和P1)明显缩短(P<0.05),术后8周延长(图1,2)。
2.1.3 治疗组 术后与术前比较,各时相SEP改变无显著差异(P>0.05)。与C组比较,D组术后1周~2周的P1潜伏期明显延长(P<0.05),见图1,2。
2.2 DRG损伤后的组织学变化
2.2.1 DRG机械性压迫损伤 术后1周~2周,DRG神经内膜间隙明显充血、水肿和出血(图3),伴部分神经细胞肿胀、坏死和脱髓鞘样改变。术后4周~8周DRG充血、出血和水肿明显减轻,而以神经纤维的脱髓鞘样改变和纤维细胞增生为主。电镜改变(图4)与DRG炎性损伤组基本相同,但改变的程度和范围相对较轻。
2.2.2 DRG炎性损伤组 肉眼观察:术后1周~2周,DRG明显充血水肿,其体积较对侧增大近1/2。术后4周DRG与周围组织相互粘连,其充血和水肿
, 百拇医药
附表 B组、C组及D组不同时期的SEP变化比较(ms, ±s) 组别
±s) 组别
潜伏期
术后1周
术后2周
术后4周
术后8周
B
N1
3.23±0.25△★
3.04±0.32△★
, http://www.100md.com
3.17±0.28△★
2.35±0.31
P1
4.01±0.33△★
3.95±0.24△★
2.90±0.21
3.08±0.36
C
N1
1.02±0.19
0.68±0.06△
, 百拇医药
0.71±0.10△
1.96±0.22
P1
0.95±0.08△
0.76±0.04△
1.84±0.16
3.03±0.26
D
N1
2.01±0.16
1.95±0.17
, 百拇医药
2.25±0.13
2.04±0.11
P1
2.89±0.20★
3.01±0.32★
2.77±0.23
2.46±0.22
注:1.正常组平均潜伏期:N1=1.36±0.27,P1=2.23±0.32; 2.其它组与正常组比较:△ P值<0.05; 3.其它组与炎性损伤组比较:★ P<0.05
, 百拇医药
图1 B组、C组及D组N1波平均潜伏期变化
图2 B组、C组及D组P1波平均潜伏期变化
等炎性反应仍然明显。术后8周DRG与周围组织粘连,局部纤维瘢痕形成,压迫DRG和SNR,DRG和神经根外膜也明显增厚呈纤维化样改变。光镜观察:术后1周~2周,DRG内膜间质增宽呈明显充血和水肿,微血管扩张,大量炎性细胞浸润,神经细胞尼氏小体颜色变浅,呈颗粒状改变,部分神经细胞染色不均,核固缩,部分髓鞘呈空泡样改变。术后4周~8周,除上述病理改变外,大直径髓鞘纤维数量明显减少,而小直径无髓鞘纤维数量相对增多,同时可见神经外膜和神经内膜的纤维化样改变,胶原纤维明显增多,并包绕在神经细胞周围(图5),大量有髓神经纤维呈脱髓鞘样改变,较多神经细胞染色不均、变性。电镜观察:髓鞘纤维改变显著,髓鞘板层结构呈点状松散,板层结构排列疏松、紊乱和肿胀,并挤压轴突,轴突呈不规则样改变,轴浆内细胞器密集。部分血管内皮细胞肿胀,胞浆内出现大量的吞饮小泡,血管腔膜面的质膜上出现大量的“凹腔”和“膜孔”样结构,内皮连接间隙增宽,提示这些血管的通透性显著增加。部分雪旺细胞肿胀,胞浆内出现许多清亮的泡状小体,显示分泌功能增强。神经细胞内线粒体明显肿胀,嵴排列紊乱和消失,呈空泡样改变(图6)。同时核周粗面内质网减少,胞核呈颗粒样改变,溶酶体多见,游离核糖体增多。胞浆内含有较多的呈空泡样改变的粗面内质网、滑面内质网和扩张的高尔基扁平囊泡。细胞核膜出现“裂隙”样改变。治疗组的病理变化规律虽然与炎性损伤组的改变基本相似,但改变的程度显著减轻、范围显著缩小,尤其是早期炎性反应和后期纤维化改变明显减轻。
, http://www.100md.com
图3 DRG机械性压迫1周,神经内膜间隙明显充血、水肿和出血,部分神经细胞肿胀和变性(HE ×200)
图4 DRG机械性压迫2周,雪旺细胞肿胀,挤压轴突(↑),轴突部分区域收缩,脱离髓鞘(MF)。神经细胞内线粒体(M)肿胀(TEM ×30 000)
图5 DRG炎性损伤4周,神经外膜和内膜纤维化样改变,胶原纤维明显增多,并包绕在神经细胞周围(Van Giesson ×200)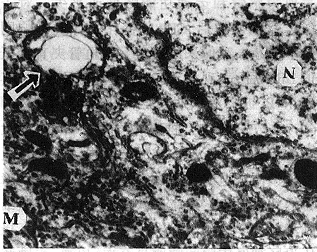
图6 DRG炎性损伤1周,神经细胞内线粒体(M)明显肿胀,嵴排列紊乱和消失,呈空泡样改变(↑),胞核(N)呈颗粒样改变(TEM ×15 000)
, 百拇医药
3 讨论
3.1 机械性压迫对DRG结构和功能的影响
腰腿痛是工业化国家面临的主要健康问题之一。流行病学调查表明,80%成年人或早或晚,或轻或重都将受到腰腿痛的困扰,约20%腰腿痛患者为此而丧失工作能力[1]。自从本世纪初Sack等[2]首先报道1例因腰椎板肥厚机械性压迫马尾神经根而导致根性疼痛以来,有关各种腰椎退行性改变,如椎间盘突出、椎管狭窄和腰骶椎不稳所造成的SNR和DRG损伤,导致神经感觉和运动功能障碍,以及神经行为异常改变,如患肢感觉过敏、麻木和放射性疼痛等,给患者生活和工作带来极大痛苦和危害,同时也成为临床医生研究和治疗的重点。DRG是机体内外环境与脊髓连结的纽带,传输和调节机体的各种感觉,并接受和传递各种伤害性感受。由于DRG细胞对各种刺激高度敏感,DRG外膜上又分布有大量伤害性感受器[3],刺激后可产生自发性异位放电和反射性神经冲动[4]。因此,DRG的损伤可导致与腰腿痛相关的神经病理生理反应,但其损伤机制尚不完全清楚,以往的研究曾观察到直接压迫SNR[5]或马尾神经[6,7],可导致神经传导功能障碍,主要表现为神经潜伏期延长和神经传导速度降低,主要临床表现为感觉和运动功能降低或丧失。对于DRG直接压迫后,SEP的变化规律及影响则尚不清楚。我们采用微型手术血管夹直接压迫DRG后,表现为SEP潜伏期明显延长,其N1和P1波的潜伏期较正常时延长64.3%和60.7%(P<0.05),神经传导功能降低,感觉减退或丧失。压迫造成的神经损害主要是通过机械性压迫的直接力学效应和神经血供障碍的间接生物学效应所致。压迫早期神经细胞和神经轴突已出现明显的病理改变,直接压迫区神经内膜间隙明显充血、出血、水肿和血管内皮细胞肿胀,间隙明显增宽等病理改变,同时部分神经细胞和神经纤维变性。结果表明,压迫导致的神经功能改变,主要与压迫造成DRG的神经细胞和神经纤维的直接损伤,以及微循环损害,血管通透性增加,组织充血和水肿相关。
, http://www.100md.com
3.2 炎性损伤对DRG组织结构和功能的影响
椎管狭窄或椎间盘脱出造成的神经根或神经节损伤,不但与压迫物的机械性损伤有关,而且与局部炎性反应释放的神经源性和非神经源性的炎性细胞介质的损伤相关[8],两者相互作用,互为因果。来源于退行性改变的椎间盘、神经根和神经节周围局部炎性反应组织所释放的内源性化学物质,具有炎性刺激和炎性损伤作用[9,10],而且还可增加伤害性感受器对其它致炎和致痛物质的敏感性。我们采用DRG的炎性损伤模型,探讨DRG炎性损伤过程中的组织结构和功能改变。研究表明:①损伤后第1周,SEP的P1波潜伏期较正常组显著缩短。此阶段组织改变主要为明显充血、水肿,大量的炎性细胞浸润,神经细胞和神经纤维出现轻微变性,伤后2周~4周SEP的N1和P1波潜伏期均显著缩短(P<0.05)。其改变可能与炎性刺激造成神经细胞兴奋性增高,轴突转运和传导功能增强相关。②损伤后第8周,SEP的潜伏期逐渐延长到伤前水平,组织学改变主要以神经细胞变性坏死,大量有髓纤维脱髓鞘样改变,以及明显的纤维组织增生,神经纤维化样改变为特征。上述组织结构改变造成神经功能降低,神经传导功能损害。机械性压迫产生的生物力学效应,炎性损伤造成的大量炎性介质和毒素释放,在病理生理变化中起重要作用。我们实验治疗组的结果表明,2%利多卡因加2.5%醋酸氢化泼尼松DRG局部浸润麻醉,不但可以显著增加DRG的血供,同时通过醋酸氢化泼尼松的抗炎作用,显著减轻了DRG的炎性反应和纤维化样瘢痕形成。这一研究结果具有临床应用价值。
, http://www.100md.com
4 参考文献
1 Sminonds M, Kumar S. The basis of low back pain. Neuro Orthopedits, 1992;13:1
2 Sack B, Fraeukel J. Progressive andylotic rigidity of pain. J Neru Ment Dis, 1990;27:1
3 Olmarker K, Byrod G, Cornefjord M et al. Effects of methylprednisolone on nucleus pulposus-induced nerve root injury. Spine, 1994;19(16):1803
4 Wall PD, Devor M. Sensory afferent impulses originate from dorsal root ganglia as well as from the periphery in normal and nerve injured rats. Pain, 1983;17:321
, http://www.100md.com
5 Lind B, Massie J, Lincoln T et al. The effects of induced hypertension and acute graded compression on impulse progagation in the spinal nerve roots of the pig. Spine, 1993;18(11):1550
6 Terade K, Larson BJ, Owen JH et al. The effect of nerve root lesioning on various somatosensory evoked potentials in the hog. Spine, 1993;18(8):1090
7 Kim NH, Yang IH, Song IK. Electrodiagnostic and histologic changes of graded caudal compression on cauda equinal in dog. Spine, 1994;19(9):1054
, http://www.100md.com
8 Kang JD, Grorgesou HI, Mcintyre-larkin L et al. Herniated lumbar intervertebral discs spontaneously produce matrix metalloproteinases, nitric oxide, interleukin-6, and prostaglandin E. Spine, 1996,21(3):271
9 Oimarker K, Rydevik B, Nordborg C. Autologous nucleus pulposus induces neurophysiologic and histologic changes in porcine cauda equina nerve roots. Spine, 1993;18(11):1425
10 Takahashi H, Surgyro T, Okazima Y et al. Inflammatory cytokines in the herniated disc of the lumbar spine. Spine, 1996;21(2):218
(收稿:1997-08-12), 百拇医药
单位:1 第三军医大学附属新桥医院骨科(重庆,400037);2 第三军医大学附属野战外科研究所;3 第三军医大学解剖学教研室
关键词:脊神经节;超微结构;脊髓诱发电位;利多卡因
中国修复重建外科杂志980306 摘 要 脊神经节(DRG)损伤常引起感觉及运动功能障碍,为了探索DRG不同损伤方式和不同损伤时间的脊髓诱发电位(SEP)和DRG组织形态学改变,用52只家兔,分别制成机械压迫、炎性损伤模型,以及2%利多卡因加2.5%醋酸氢化泼尼松局部治疗,并与未损伤组作对比研究。结果表明,DRG血管内皮细胞连接间隙增宽是机械性损伤导致血管通透性增加的主要原因,而血管内皮细胞连接间隙增宽,以及血管内皮细胞吞饮小泡转运功能增强,是炎性损伤导致血管通透性增加的主要原因。认为,2%利多卡因加2.5%醋酸氢化泼尼松局部浸润能显著减轻DRG炎性损伤。
, 百拇医药
HISTOLOGICAL AND ELECTROPHYSIOLOGIC CHANGES OF INJURY OF DORSAL ROOT GANGLIA/Zhou Yue, Liao Weihong, Mei Fangrui et al. Department of Orthopedic Surgery, Second Affiliated Hospital, Third Military Medical University, Chongqing, P. R. China 400037
Abstract Injury of dorsal root ganglia (DRG) may cause sensory and motor dysfunction. In order to investigate the changes of somato-sensory evoked potential (SEP) and histological characteristics of DRG in different causes and different periods of injury, fifty-two rabbits were chosed to build the models. The rabbits were divided into 4 groups: Control group (n=4); mechanical compressing group (n=16); inflammatory injury group (n=16); and treatment group (2% lidocaine with hydroprednisone was administered locally, n=16). After one to eight weeks, SEP was determined and samples of DRG were obtained to observe the histological and ultrastructural changes every week. The result showed that the gap junction of microvascular endothelium in DRG had been destroyed by the mechanical compression was the major cause of the vessel permeability increasing. The increasing of endothelial pinocytic vesicles transportation and widening of endothelial gap junction were the main causes of inflammatory irritation of DRG. The local infiltration with 2% lidocaine and hydroprednisone could obviously ameliorate inflammatory injury in DRG.
, 百拇医药
Key words Dorsal root ganglia Somato-sensory evoked potential Ultrastructure Lodocaine
因椎间盘突出、椎管狭窄和脊柱退行性改变所造成的脊神经根(spinal nerve root, SNR)和脊神经节(dorsal root ganglia, DRG)损伤,常常引起感觉和运动功能障碍,以及神经行为异常。DRG是机体内外环境与脊髓连接的纽带,具有传输和调节机体的各种感觉,接受和传递各种伤害性感受的功能。我们研究的目的是探讨DRG不同损伤方式和不同损伤时间组织形态学和损伤前后脊髓诱发电位(somatosensory evoked potential, SEP)的变化规律及特点。
1 材料与方法
1.1 动物及分组
健康家兔52只,雌雄不拘。随机分为:A组(正常对照组,n=4),B组(机械性压迫组,n=16),C组(炎性损伤组,n=16),D组(治疗组,n=16)。
, http://www.100md.com
1.2 模型复制
3%戊巴比妥钠(0.5 ml/kg~1 ml/kg)耳静脉麻醉,常规消毒铺无菌巾。腰骶部后正中切口,咬除L5~7棘突和椎板。手术显微镜下仔细显露双侧DRG5,和DRG6。左侧为损伤侧,右侧为非损伤侧。B组采用2枚微型手术血管夹,夹宽2 mm,张开距3 mm,压力0.441 N,分别压迫左侧DRG5和DRG6。
C组采用4/0铬制肠线,剪成长0.5 cm,取4条~6条,沿左侧DRG5和DRG6周围纵轴排列放置,并用无菌手术骨蜡固定,1层~2层明胶海绵覆盖在硬脊膜表面,缝合伤口,送动物室饲养。D组采用与C组相同的损伤模型,但当模型制作完毕后,直视下在DRG旁侧分别放置1根无菌医用2FX聚乙烯肝素内衬导管,并将导管固定。术后1周~8周,每周经导管推注2%利多卡因0.5 ml加2.5%醋酸氢化泼尼松注射液0.5 ml,2次/周。A组除局部不放置铬制肠线外,其手术显露和术后处理均与C组相同,A组为正常对照组,而B组、C组和D组右侧的DRG5和DRG6为自身对照组。
, http://www.100md.com
1.3 观测指标
1.3.1 SEP测定 采用双银丝(间距4 mm)刺激保护电极,经手术将电极固定在实验侧胫神经上。记录电极采用双银球记录电极(直径0.6 mm,间距4 mm),放置在实验侧DRG的传入神经进入脊髓背角平面的硬脊膜外。参考电极放置在实验侧皮下。温热石蜡油保护好脊髓和DRG。刺激用恒流电采用宽度0.2 ms~0.5 ms的方波脉冲,刺激强度为受刺激神经所支配肌肉出现轻微抽动。刺激频率为4 Hz,叠加次数50次,分析时间20 ms。采用WD-4 000神经电位诊断仪测定。A组的测定值作为各组术前正常值,B组、C组和D组分别在术后1,2,4及8周各取4只家兔测定SEP的变化。
1.3.2 DRG组织学观察
常规光镜切片 术后开胸,升主动脉插管灌注0.9%生理盐水和4%多聚甲醛液(0.1 mol/L,pH7.4,4℃)1 500 ml~2 000 ml,2小时后取标本置入相同固定液再固定24小时,修整,石蜡包埋,常规切片和HE染色、Van Giesson氏染色、Toluidine blue氏染色,Olympus生物显微镜下观察。
, http://www.100md.com
常规电镜标本 灌注固定后取标本,在解剖显微镜下将标本修剪成1 mm3的组织小块。再置入2%锇酸(OsO4)中固定,系列丙酮脱水,环氧树酯包埋,超薄切片,醋酸铀-枸橼酸铅双层染色,JEM-200型日立电子显微镜观察。
1.3.3 统计学处理 实验结果的数据统计均在486/DX266型微机上,采用Microsoft Excel 5.0的统计程序,行样本单因素和多因素方差分析,显著性t检验。
2 结果
2.1 SEP测定结果
2.1.1 DRG机械性压迫损伤 正常家兔脊髓SEP由两个向下的正波和两个向上的负波构成,分别定义为P1、P2、N1和N2波。研究表明,A组N1波平均潜伏期为(1.36±0.27) ms,P1波的平均潜伏期为(2.23±0.32) ms。当B组DRG机械性压迫期间,SEP的潜伏期(N1和P1)明显延长(P<0.05),与A组相比,其潜伏期延长率分别为64.3%和60.7%(附表)。
, 百拇医药
2.1.2 DRG炎性损伤 术后1周,潜伏期无显著变化,术后2周~4周SEP的潜伏期(N1和P1)明显缩短(P<0.05),术后8周延长(图1,2)。
2.1.3 治疗组 术后与术前比较,各时相SEP改变无显著差异(P>0.05)。与C组比较,D组术后1周~2周的P1潜伏期明显延长(P<0.05),见图1,2。
2.2 DRG损伤后的组织学变化
2.2.1 DRG机械性压迫损伤 术后1周~2周,DRG神经内膜间隙明显充血、水肿和出血(图3),伴部分神经细胞肿胀、坏死和脱髓鞘样改变。术后4周~8周DRG充血、出血和水肿明显减轻,而以神经纤维的脱髓鞘样改变和纤维细胞增生为主。电镜改变(图4)与DRG炎性损伤组基本相同,但改变的程度和范围相对较轻。
2.2.2 DRG炎性损伤组 肉眼观察:术后1周~2周,DRG明显充血水肿,其体积较对侧增大近1/2。术后4周DRG与周围组织相互粘连,其充血和水肿
, 百拇医药
附表 B组、C组及D组不同时期的SEP变化比较(ms,
 ±s) 组别
±s) 组别潜伏期
术后1周
术后2周
术后4周
术后8周
B
N1
3.23±0.25△★
3.04±0.32△★
, http://www.100md.com
3.17±0.28△★
2.35±0.31
P1
4.01±0.33△★
3.95±0.24△★
2.90±0.21
3.08±0.36
C
N1
1.02±0.19
0.68±0.06△
, 百拇医药
0.71±0.10△
1.96±0.22
P1
0.95±0.08△
0.76±0.04△
1.84±0.16
3.03±0.26
D
N1
2.01±0.16
1.95±0.17
, 百拇医药
2.25±0.13
2.04±0.11
P1
2.89±0.20★
3.01±0.32★
2.77±0.23
2.46±0.22
注:1.正常组平均潜伏期:N1=1.36±0.27,P1=2.23±0.32; 2.其它组与正常组比较:△ P值<0.05; 3.其它组与炎性损伤组比较:★ P<0.05

, 百拇医药
图1 B组、C组及D组N1波平均潜伏期变化

图2 B组、C组及D组P1波平均潜伏期变化
等炎性反应仍然明显。术后8周DRG与周围组织粘连,局部纤维瘢痕形成,压迫DRG和SNR,DRG和神经根外膜也明显增厚呈纤维化样改变。光镜观察:术后1周~2周,DRG内膜间质增宽呈明显充血和水肿,微血管扩张,大量炎性细胞浸润,神经细胞尼氏小体颜色变浅,呈颗粒状改变,部分神经细胞染色不均,核固缩,部分髓鞘呈空泡样改变。术后4周~8周,除上述病理改变外,大直径髓鞘纤维数量明显减少,而小直径无髓鞘纤维数量相对增多,同时可见神经外膜和神经内膜的纤维化样改变,胶原纤维明显增多,并包绕在神经细胞周围(图5),大量有髓神经纤维呈脱髓鞘样改变,较多神经细胞染色不均、变性。电镜观察:髓鞘纤维改变显著,髓鞘板层结构呈点状松散,板层结构排列疏松、紊乱和肿胀,并挤压轴突,轴突呈不规则样改变,轴浆内细胞器密集。部分血管内皮细胞肿胀,胞浆内出现大量的吞饮小泡,血管腔膜面的质膜上出现大量的“凹腔”和“膜孔”样结构,内皮连接间隙增宽,提示这些血管的通透性显著增加。部分雪旺细胞肿胀,胞浆内出现许多清亮的泡状小体,显示分泌功能增强。神经细胞内线粒体明显肿胀,嵴排列紊乱和消失,呈空泡样改变(图6)。同时核周粗面内质网减少,胞核呈颗粒样改变,溶酶体多见,游离核糖体增多。胞浆内含有较多的呈空泡样改变的粗面内质网、滑面内质网和扩张的高尔基扁平囊泡。细胞核膜出现“裂隙”样改变。治疗组的病理变化规律虽然与炎性损伤组的改变基本相似,但改变的程度显著减轻、范围显著缩小,尤其是早期炎性反应和后期纤维化改变明显减轻。

, http://www.100md.com
图3 DRG机械性压迫1周,神经内膜间隙明显充血、水肿和出血,部分神经细胞肿胀和变性(HE ×200)

图4 DRG机械性压迫2周,雪旺细胞肿胀,挤压轴突(↑),轴突部分区域收缩,脱离髓鞘(MF)。神经细胞内线粒体(M)肿胀(TEM ×30 000)

图5 DRG炎性损伤4周,神经外膜和内膜纤维化样改变,胶原纤维明显增多,并包绕在神经细胞周围(Van Giesson ×200)

图6 DRG炎性损伤1周,神经细胞内线粒体(M)明显肿胀,嵴排列紊乱和消失,呈空泡样改变(↑),胞核(N)呈颗粒样改变(TEM ×15 000)
, 百拇医药
3 讨论
3.1 机械性压迫对DRG结构和功能的影响
腰腿痛是工业化国家面临的主要健康问题之一。流行病学调查表明,80%成年人或早或晚,或轻或重都将受到腰腿痛的困扰,约20%腰腿痛患者为此而丧失工作能力[1]。自从本世纪初Sack等[2]首先报道1例因腰椎板肥厚机械性压迫马尾神经根而导致根性疼痛以来,有关各种腰椎退行性改变,如椎间盘突出、椎管狭窄和腰骶椎不稳所造成的SNR和DRG损伤,导致神经感觉和运动功能障碍,以及神经行为异常改变,如患肢感觉过敏、麻木和放射性疼痛等,给患者生活和工作带来极大痛苦和危害,同时也成为临床医生研究和治疗的重点。DRG是机体内外环境与脊髓连结的纽带,传输和调节机体的各种感觉,并接受和传递各种伤害性感受。由于DRG细胞对各种刺激高度敏感,DRG外膜上又分布有大量伤害性感受器[3],刺激后可产生自发性异位放电和反射性神经冲动[4]。因此,DRG的损伤可导致与腰腿痛相关的神经病理生理反应,但其损伤机制尚不完全清楚,以往的研究曾观察到直接压迫SNR[5]或马尾神经[6,7],可导致神经传导功能障碍,主要表现为神经潜伏期延长和神经传导速度降低,主要临床表现为感觉和运动功能降低或丧失。对于DRG直接压迫后,SEP的变化规律及影响则尚不清楚。我们采用微型手术血管夹直接压迫DRG后,表现为SEP潜伏期明显延长,其N1和P1波的潜伏期较正常时延长64.3%和60.7%(P<0.05),神经传导功能降低,感觉减退或丧失。压迫造成的神经损害主要是通过机械性压迫的直接力学效应和神经血供障碍的间接生物学效应所致。压迫早期神经细胞和神经轴突已出现明显的病理改变,直接压迫区神经内膜间隙明显充血、出血、水肿和血管内皮细胞肿胀,间隙明显增宽等病理改变,同时部分神经细胞和神经纤维变性。结果表明,压迫导致的神经功能改变,主要与压迫造成DRG的神经细胞和神经纤维的直接损伤,以及微循环损害,血管通透性增加,组织充血和水肿相关。
, http://www.100md.com
3.2 炎性损伤对DRG组织结构和功能的影响
椎管狭窄或椎间盘脱出造成的神经根或神经节损伤,不但与压迫物的机械性损伤有关,而且与局部炎性反应释放的神经源性和非神经源性的炎性细胞介质的损伤相关[8],两者相互作用,互为因果。来源于退行性改变的椎间盘、神经根和神经节周围局部炎性反应组织所释放的内源性化学物质,具有炎性刺激和炎性损伤作用[9,10],而且还可增加伤害性感受器对其它致炎和致痛物质的敏感性。我们采用DRG的炎性损伤模型,探讨DRG炎性损伤过程中的组织结构和功能改变。研究表明:①损伤后第1周,SEP的P1波潜伏期较正常组显著缩短。此阶段组织改变主要为明显充血、水肿,大量的炎性细胞浸润,神经细胞和神经纤维出现轻微变性,伤后2周~4周SEP的N1和P1波潜伏期均显著缩短(P<0.05)。其改变可能与炎性刺激造成神经细胞兴奋性增高,轴突转运和传导功能增强相关。②损伤后第8周,SEP的潜伏期逐渐延长到伤前水平,组织学改变主要以神经细胞变性坏死,大量有髓纤维脱髓鞘样改变,以及明显的纤维组织增生,神经纤维化样改变为特征。上述组织结构改变造成神经功能降低,神经传导功能损害。机械性压迫产生的生物力学效应,炎性损伤造成的大量炎性介质和毒素释放,在病理生理变化中起重要作用。我们实验治疗组的结果表明,2%利多卡因加2.5%醋酸氢化泼尼松DRG局部浸润麻醉,不但可以显著增加DRG的血供,同时通过醋酸氢化泼尼松的抗炎作用,显著减轻了DRG的炎性反应和纤维化样瘢痕形成。这一研究结果具有临床应用价值。
, http://www.100md.com
4 参考文献
1 Sminonds M, Kumar S. The basis of low back pain. Neuro Orthopedits, 1992;13:1
2 Sack B, Fraeukel J. Progressive andylotic rigidity of pain. J Neru Ment Dis, 1990;27:1
3 Olmarker K, Byrod G, Cornefjord M et al. Effects of methylprednisolone on nucleus pulposus-induced nerve root injury. Spine, 1994;19(16):1803
4 Wall PD, Devor M. Sensory afferent impulses originate from dorsal root ganglia as well as from the periphery in normal and nerve injured rats. Pain, 1983;17:321
, http://www.100md.com
5 Lind B, Massie J, Lincoln T et al. The effects of induced hypertension and acute graded compression on impulse progagation in the spinal nerve roots of the pig. Spine, 1993;18(11):1550
6 Terade K, Larson BJ, Owen JH et al. The effect of nerve root lesioning on various somatosensory evoked potentials in the hog. Spine, 1993;18(8):1090
7 Kim NH, Yang IH, Song IK. Electrodiagnostic and histologic changes of graded caudal compression on cauda equinal in dog. Spine, 1994;19(9):1054
, http://www.100md.com
8 Kang JD, Grorgesou HI, Mcintyre-larkin L et al. Herniated lumbar intervertebral discs spontaneously produce matrix metalloproteinases, nitric oxide, interleukin-6, and prostaglandin E. Spine, 1996,21(3):271
9 Oimarker K, Rydevik B, Nordborg C. Autologous nucleus pulposus induces neurophysiologic and histologic changes in porcine cauda equina nerve roots. Spine, 1993;18(11):1425
10 Takahashi H, Surgyro T, Okazima Y et al. Inflammatory cytokines in the herniated disc of the lumbar spine. Spine, 1996;21(2):218
(收稿:1997-08-12), 百拇医药