培养液对紫外线诱发晶体混浊的影响及机制
作者:吴开力* 潘苏华* 水迎波** 李绍珍*
单位:
*广州中山医科大学中山眼科中心,510060;**新加坡国立眼研究所
关键词:紫外线;培养;晶体;光化学反应
培养液对紫外线诱发晶体混浊的影响及机制 摘 要 通过比较不同培养液对紫外线A和B的透光率,检测紫外线B(UVB)照射培养液后溶液中过氧化氢的生成和还原型谷胱甘肽的减少,分析培养晶体受UVB照射后其不同部位的生化改变,探讨在体外紫外线诱发白内障时来源于培养液的效应。结果提示在这类模型研究中,除紫外线对晶体的直接光损伤作用外,培养液能够吸收紫外线,发生光化学反应,反应产物也对晶体造成一定的损害。
分类号 R776
Effects of medium on the lens opacity induced by ultraviolet irradiation/Wu Kaili…∥Ophthalmol CHN.-1998,7(3),-183~186(Zhongshan Ophthalmic Center,Sun Yat-sen University of Medical Sciences,Guangzhou 510060)
, http://www.100md.com
In order to investigate the effects of medium on lens opacity induced by ultraviolet (UV) irradiation,we studied the alterations of the media and the lens under the irradiation of UVB.The transmittances of five different media,which contained various components,were measured at the range of 280~400nm.The production of H2O2 and the reduction of glutathione (GSH) in medium were noted.The cultured rabbit lenses were exposed to UVB and the alterations in lens sections(equator,anterior and posterior cortex and nucleus)were analyzed with biochemical methods.The results showed that there was photooxidation occurred in the media.Although the most obvious damage appeared in anterior cortex,there were biochemical changes occurred in all four lens sections.Our results suggested that,in the cataract model induced by UVB in vitro,there was an indirect effect of UVB from photooxidation of culture medium except the direct damage caused by UVB irradiation.
, 百拇医药
Subject terms Ultraviolet;Culture;Lens,crystalline; Photooxidation
紫外线(UV)辐射可导致白内障,其损害的机制在于UV对晶体的光氧化作用[1,2]。器官培养和细胞培养被广泛用于UV相关白内障形成机制的研究[3~5]。这类模型研究中,除UV对培养的组织器官和细胞的作用外,同时也可能存在辐射对培养液产生光化学反应,而反应的产物进一步损害被培养物;另外,人眼含有房水和泪液,UV导致的眼损害中,也可能存在UV引起泪液、房水的改变进而损害眼组织,但目前还缺乏这方面的资料。本文比较几种培养液对UV的透光性及经紫外线B(UVB)照射后培养液的反应,并观察了培养晶体经UVB照射后不同部位的损害程度,以探讨有关体外研究UV相关眼病时培养液的效应。
1 材料和方法
1.1 材料
, 百拇医药
五种培养液均从GibcoBRL公司购买,其组成见表1。
表1 五种培养液的组成比较
Earle
谷酰胺
酚红
Hepes
NaHCO3
A液(T-199)
B液(T-199)
C液(MEM)
D液(MEM)
, 百拇医药 E液(MEM)
+
+
+
+
+
+
+
-
-
-
+
+
+
, http://www.100md.com
+
-
-
+
-
+
-
+
+
-
-
-
注:各溶液的详细组成见该公司产品介绍
4对正常晶体来自2岁新西兰白兔,取出后立即置于T-199培养液(B液),培养24小时后观察,晶体仍透明者说明其未受损伤,分组进行UVB照射实验。来源于同一动物的2个晶体配对分配于实验组和对照组。
, http://www.100md.com
1.2 UBV照射
UVB照射方法同我们以前的报道[6]。对培养液的照射是将装有培养液的3ml石英杯暴露于UVB光源下,部分实验同时向溶液连续通入少量氧气或氮气。不同时间取出一定量的培养液作过氧化氢(H2O2)和巯基的检测;照射培养的晶体是直接用装有晶体的培养皿(6孔培养板,GibcoBRL公司产品)进行,照射时晶体上皮面朝向UVB光源,并将培养液调整至液面恰好覆盖晶体前表面。
培养的晶体分别在第2、3、4天分3次接受UVB照射,总量为240mJ/cm2,然后继续培养3天,培养结束时照相。再经微分割法将其分为前皮质、核部、后皮质和赤道部四部分[6],各部分匀浆后作生化分析。
1.3 生化分析
溶液的光通透性用3ml石英杯在紫外-可见光分光光度计检测(岛津,UV2201)。检测波长为紫外线A和B段,即400~280nm范围。
, 百拇医药
采用文献报道的方法进行生化分析,用化学方法测量H2O2[7];由改变的Ellman法测量巯基[6];用蔗糖密度梯度离心分离位于45/50蔗糖密度中的膜组分,以DPH(1,6-二苯基-1,3,5-己三烯)为荧光探子检测膜荧光强度[8];脂质过氧化物(LPO)的测定用Yagi报道的荧光法检测(日本和光试剂盒)[9]。
2 结果
五种培养液的紫外光通透性如图1,A和B液、C和D液呈现相同的紫外光通透性,A’-E’为对应于表1所列的培养液中加入10%的胎牛血清白蛋白的透光率,由图可见它们将<290nm的光全部吸收。
, http://www.100md.com
图1 五种培养液(A-E液,见表1)在280~400nm波长范围的透光率(实线)。
图中虚线为五种培养液分别加上10%胎牛血清白蛋白的透光率(A'-E')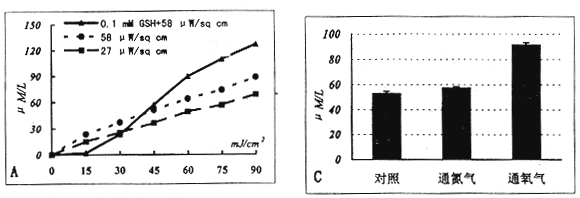
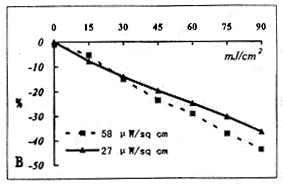
图2 UVB照射培养液(E液)后溶液中过氧化氢和巯基的变化。A:E液中H2O2的产生随UVB照射量的增加而增多,不同UVB强度和加入0.1mmol/L GSH(终浓度)后H2O2的生成有不同。B:UVB照射(0-90mJ/cm2,分别用27和58μW/cm2)含有1mmol/L GSH于E液,溶液中巯基含量的减少百分率。C:在E液中持续通入氮气或氧气的状态下用60mJ/cm2的UVB照射,以自然状态的E液为对照,三者中H2O2的生成量的比较。所有测定点均为3-4测定值的平均值
, http://www.100md.com
图2示用UVB照射E液后,溶液中H2O2产生和巯基含量的变化。随着UVB照射的增加,H2O2产生也增多,在溶液中加入0.1mmol/L的谷胱苷肽(GSH)时,早期能一定程度地抑制H2O2的产生,当UVB的量超过45mJ/cm2后,则使其产生增加(图2A);将1mmol/L的GSH加入到溶液中,UVB照射使GSH逐渐减少(图2B);比较不同UVB照射强度的作用可见,高强度的UVB所致H2O2的生成量和GSH的减少要更甚(图2A和B)。向E液中通入氧气时,可使UVB照射(60mJ/cm2)的溶液中的H2O2生成增加,而通氮气和不通气则差别不大(图2C)。
经过1周的培养,接受UVB照射兔透明晶体出现混浊,而未受照射的对照组晶体仍透明,混浊主要位于前皮质下。照射组较对照组晶体湿重增加(分别为619.4±16.6mg和665.4±20.3mg)。晶体不同部位的生化分析结果见表2,各测定结果显示前皮质是受损最大的区域,其次为赤道部,核部的蛋白有变化,后皮质则以脂类的变化明显。 表2 UVB照射培养晶体的不同部位的生化分析
, 百拇医药
可溶性蛋白(mg/g lens)
巯基(mM/mg lens)
脂类的比较(照射/对照)
对照
UVB照射
对照
UVB照射
LPO
PTH荧光
赤道部
321.91±15.36
271.82±16.65*
, 百拇医药
34.77±2.45
27.91±3.16
1.2
1.25
前皮质
438.16±15.19
367.25±26.15*
44.62±2.04
36.31±2.63**
1.53
1.34
, 百拇医药 核 部
394.01±7.50
337.33±23.19*
42.13±1.90
38.28±3.17
1.03
—
后皮质
416.86±11.00
372.40±29.46
41.92±1.46
37.34±3.52
, http://www.100md.com
1.48
1.31
*P<0.05;**P<0.01
3 讨论
在研究紫外线诱发白内障的机制时常应用体外培养模型,这类研究所造成的晶体损害除紫外线直接损害晶体组织外[4,5,7],也可能涉及到培养液发生的间接效应。为探讨这种可能性,本文进行了相关研究,结果显示:培养液能减少紫外线的通透性;UVB照射能使培养液产生H2O2,减少溶液中巯基的含量;照射培养的晶体以直接受辐射的前皮质的改变最大,但其它部位也有一定程度的损害。
比较UV在五种培养液中的通透性可见,酚红对其影响较大,加入胎牛血清白蛋白能大大减少UVB的通透性(图1),其它几种添加物的影响相对较小。我们选择对UVB吸收较少的E液来观察在UVB照射下,溶液中H2O2的产生和巯基量的变化,以了解UVB在溶液中可能发生的光化学反应。由图2可见H2O2的生成随UVB的照射量的增加而增多,溶液中氧含量能影响H2O2的生成量。Hightower和McCready[5]在用UVB照射培养的晶体的研究表明,溶液中氧张力越高,培养晶体内的GSH降低越快,受照射晶体的培养液中的H2O2较非照射组要高。我们曾向溶液中加入1.8mmol/L GSH后经UVB照射(90mJ/cm2)也不能检测到H2O2的产生,但可见GSH随UVB的照射而减少(结果未显示),说明溶液中存在着光化学反应,GSH能对抗这类反应。发生光化学反应的先决条件必须要有光的吸收,因E液对UVB的吸收较其它几种培养液少,推测UVB照射另外几种培养液所发生的光化学反应将更甚。
, 百拇医药
通过对培养的晶体的不同部位的分析可见,本文所用的实验体系中,以晶体前皮质的变化为最甚,同时赤道部、核部和后皮质也发生了变化。在我们对兔晶体各部分的蛋白进行UVB照射时,受损的顺序为核部>前后皮质>赤道部[6]。本文用UVB照射培养的晶体,其损害发生的程度以前皮质最甚(表2),说明与既往文献报道的一致,本实验中UVB对晶体的损害也以直接作用为主[4,5,7],而发生于后皮质和核的变化可能为经培养液的间接作用。
需要强调的是本文的UVB剂量大大高于自然环境中的UV量,是一短期急性毒性作用,与自然环境中的UVB对人的慢性累积效应应有相当大的差别。但本文的结果提示我们无论在体外实验或是解释体内机制时,应注意培养液和组织液(房水等)的间接作用。
4 参考文献
1 Reme C,Reinboth J,Clausen M,et al.Light da-mage revisited:converging evidence,diverging views?Grefe's Arch Clin Exp Ophthalmol,1996;234:2
, 百拇医药
2 West SK,Valmadrid CT.Epidemiology of risk factors for age-related cataract.Surv Ophthalmol,1995;39:3234
3 Weinreb O,Dovrat A.Transglutaminase involvement in UV-A damage to the eye lens.Exp Eye Res,1996;63:591
4 Stuart DD,Sivak JG,Cullen AP,et al.UV-B radiation and the optical properties of cultured bovine lenses.Curr Eye Res,1991;10:177
5 Hightower K,McCready J.Mechanisms involved in cataract development following near-ultraviolet radiation of cultured lens.Curr Eye Res,1992;11:679
, 百拇医药
6 Wu K,Kojima M,et al.In vitro UV-B effect on lens protein solutions.Ophthalmic Res,1997;29:75
7 Spector A,Wang G,Wang R,et al.A brief photochemically induced oxidative insult causes irreversible lens damage and cataract:I.Transparency and epithelial cell layer.Exp Eye Res,1995;60:471
8 Wu K,Shui YB,Pan S,et al.In vitro UVB irradiation effects on lens membranes and their binding-capacity with lens proteins.眼科研究,1998;16:82
9 Yagi K.A simple fluorometric assay for lipidpero-xide in blood plasma.Biochem Med,1976;15:216
(1998-02-23收稿,1998-06-15修回), 百拇医药
单位:
*广州中山医科大学中山眼科中心,510060;**新加坡国立眼研究所
关键词:紫外线;培养;晶体;光化学反应
培养液对紫外线诱发晶体混浊的影响及机制 摘 要 通过比较不同培养液对紫外线A和B的透光率,检测紫外线B(UVB)照射培养液后溶液中过氧化氢的生成和还原型谷胱甘肽的减少,分析培养晶体受UVB照射后其不同部位的生化改变,探讨在体外紫外线诱发白内障时来源于培养液的效应。结果提示在这类模型研究中,除紫外线对晶体的直接光损伤作用外,培养液能够吸收紫外线,发生光化学反应,反应产物也对晶体造成一定的损害。
分类号 R776
Effects of medium on the lens opacity induced by ultraviolet irradiation/Wu Kaili…∥Ophthalmol CHN.-1998,7(3),-183~186(Zhongshan Ophthalmic Center,Sun Yat-sen University of Medical Sciences,Guangzhou 510060)
, http://www.100md.com
In order to investigate the effects of medium on lens opacity induced by ultraviolet (UV) irradiation,we studied the alterations of the media and the lens under the irradiation of UVB.The transmittances of five different media,which contained various components,were measured at the range of 280~400nm.The production of H2O2 and the reduction of glutathione (GSH) in medium were noted.The cultured rabbit lenses were exposed to UVB and the alterations in lens sections(equator,anterior and posterior cortex and nucleus)were analyzed with biochemical methods.The results showed that there was photooxidation occurred in the media.Although the most obvious damage appeared in anterior cortex,there were biochemical changes occurred in all four lens sections.Our results suggested that,in the cataract model induced by UVB in vitro,there was an indirect effect of UVB from photooxidation of culture medium except the direct damage caused by UVB irradiation.
, 百拇医药
Subject terms Ultraviolet;Culture;Lens,crystalline; Photooxidation
紫外线(UV)辐射可导致白内障,其损害的机制在于UV对晶体的光氧化作用[1,2]。器官培养和细胞培养被广泛用于UV相关白内障形成机制的研究[3~5]。这类模型研究中,除UV对培养的组织器官和细胞的作用外,同时也可能存在辐射对培养液产生光化学反应,而反应的产物进一步损害被培养物;另外,人眼含有房水和泪液,UV导致的眼损害中,也可能存在UV引起泪液、房水的改变进而损害眼组织,但目前还缺乏这方面的资料。本文比较几种培养液对UV的透光性及经紫外线B(UVB)照射后培养液的反应,并观察了培养晶体经UVB照射后不同部位的损害程度,以探讨有关体外研究UV相关眼病时培养液的效应。
1 材料和方法
1.1 材料
, 百拇医药
五种培养液均从GibcoBRL公司购买,其组成见表1。
表1 五种培养液的组成比较
Earle
谷酰胺
酚红
Hepes
NaHCO3
A液(T-199)
B液(T-199)
C液(MEM)
D液(MEM)
, 百拇医药 E液(MEM)
+
+
+
+
+
+
+
-
-
-
+
+
+
, http://www.100md.com
+
-
-
+
-
+
-
+
+
-
-
-
注:各溶液的详细组成见该公司产品介绍
4对正常晶体来自2岁新西兰白兔,取出后立即置于T-199培养液(B液),培养24小时后观察,晶体仍透明者说明其未受损伤,分组进行UVB照射实验。来源于同一动物的2个晶体配对分配于实验组和对照组。
, http://www.100md.com
1.2 UBV照射
UVB照射方法同我们以前的报道[6]。对培养液的照射是将装有培养液的3ml石英杯暴露于UVB光源下,部分实验同时向溶液连续通入少量氧气或氮气。不同时间取出一定量的培养液作过氧化氢(H2O2)和巯基的检测;照射培养的晶体是直接用装有晶体的培养皿(6孔培养板,GibcoBRL公司产品)进行,照射时晶体上皮面朝向UVB光源,并将培养液调整至液面恰好覆盖晶体前表面。
培养的晶体分别在第2、3、4天分3次接受UVB照射,总量为240mJ/cm2,然后继续培养3天,培养结束时照相。再经微分割法将其分为前皮质、核部、后皮质和赤道部四部分[6],各部分匀浆后作生化分析。
1.3 生化分析
溶液的光通透性用3ml石英杯在紫外-可见光分光光度计检测(岛津,UV2201)。检测波长为紫外线A和B段,即400~280nm范围。
, 百拇医药
采用文献报道的方法进行生化分析,用化学方法测量H2O2[7];由改变的Ellman法测量巯基[6];用蔗糖密度梯度离心分离位于45/50蔗糖密度中的膜组分,以DPH(1,6-二苯基-1,3,5-己三烯)为荧光探子检测膜荧光强度[8];脂质过氧化物(LPO)的测定用Yagi报道的荧光法检测(日本和光试剂盒)[9]。
2 结果
五种培养液的紫外光通透性如图1,A和B液、C和D液呈现相同的紫外光通透性,A’-E’为对应于表1所列的培养液中加入10%的胎牛血清白蛋白的透光率,由图可见它们将<290nm的光全部吸收。

, http://www.100md.com
图1 五种培养液(A-E液,见表1)在280~400nm波长范围的透光率(实线)。
图中虚线为五种培养液分别加上10%胎牛血清白蛋白的透光率(A'-E')


图2 UVB照射培养液(E液)后溶液中过氧化氢和巯基的变化。A:E液中H2O2的产生随UVB照射量的增加而增多,不同UVB强度和加入0.1mmol/L GSH(终浓度)后H2O2的生成有不同。B:UVB照射(0-90mJ/cm2,分别用27和58μW/cm2)含有1mmol/L GSH于E液,溶液中巯基含量的减少百分率。C:在E液中持续通入氮气或氧气的状态下用60mJ/cm2的UVB照射,以自然状态的E液为对照,三者中H2O2的生成量的比较。所有测定点均为3-4测定值的平均值
, http://www.100md.com
图2示用UVB照射E液后,溶液中H2O2产生和巯基含量的变化。随着UVB照射的增加,H2O2产生也增多,在溶液中加入0.1mmol/L的谷胱苷肽(GSH)时,早期能一定程度地抑制H2O2的产生,当UVB的量超过45mJ/cm2后,则使其产生增加(图2A);将1mmol/L的GSH加入到溶液中,UVB照射使GSH逐渐减少(图2B);比较不同UVB照射强度的作用可见,高强度的UVB所致H2O2的生成量和GSH的减少要更甚(图2A和B)。向E液中通入氧气时,可使UVB照射(60mJ/cm2)的溶液中的H2O2生成增加,而通氮气和不通气则差别不大(图2C)。
经过1周的培养,接受UVB照射兔透明晶体出现混浊,而未受照射的对照组晶体仍透明,混浊主要位于前皮质下。照射组较对照组晶体湿重增加(分别为619.4±16.6mg和665.4±20.3mg)。晶体不同部位的生化分析结果见表2,各测定结果显示前皮质是受损最大的区域,其次为赤道部,核部的蛋白有变化,后皮质则以脂类的变化明显。 表2 UVB照射培养晶体的不同部位的生化分析
, 百拇医药
可溶性蛋白(mg/g lens)
巯基(mM/mg lens)
脂类的比较(照射/对照)
对照
UVB照射
对照
UVB照射
LPO
PTH荧光
赤道部
321.91±15.36
271.82±16.65*
, 百拇医药
34.77±2.45
27.91±3.16
1.2
1.25
前皮质
438.16±15.19
367.25±26.15*
44.62±2.04
36.31±2.63**
1.53
1.34
, 百拇医药 核 部
394.01±7.50
337.33±23.19*
42.13±1.90
38.28±3.17
1.03
—
后皮质
416.86±11.00
372.40±29.46
41.92±1.46
37.34±3.52
, http://www.100md.com
1.48
1.31
*P<0.05;**P<0.01
3 讨论
在研究紫外线诱发白内障的机制时常应用体外培养模型,这类研究所造成的晶体损害除紫外线直接损害晶体组织外[4,5,7],也可能涉及到培养液发生的间接效应。为探讨这种可能性,本文进行了相关研究,结果显示:培养液能减少紫外线的通透性;UVB照射能使培养液产生H2O2,减少溶液中巯基的含量;照射培养的晶体以直接受辐射的前皮质的改变最大,但其它部位也有一定程度的损害。
比较UV在五种培养液中的通透性可见,酚红对其影响较大,加入胎牛血清白蛋白能大大减少UVB的通透性(图1),其它几种添加物的影响相对较小。我们选择对UVB吸收较少的E液来观察在UVB照射下,溶液中H2O2的产生和巯基量的变化,以了解UVB在溶液中可能发生的光化学反应。由图2可见H2O2的生成随UVB的照射量的增加而增多,溶液中氧含量能影响H2O2的生成量。Hightower和McCready[5]在用UVB照射培养的晶体的研究表明,溶液中氧张力越高,培养晶体内的GSH降低越快,受照射晶体的培养液中的H2O2较非照射组要高。我们曾向溶液中加入1.8mmol/L GSH后经UVB照射(90mJ/cm2)也不能检测到H2O2的产生,但可见GSH随UVB的照射而减少(结果未显示),说明溶液中存在着光化学反应,GSH能对抗这类反应。发生光化学反应的先决条件必须要有光的吸收,因E液对UVB的吸收较其它几种培养液少,推测UVB照射另外几种培养液所发生的光化学反应将更甚。
, 百拇医药
通过对培养的晶体的不同部位的分析可见,本文所用的实验体系中,以晶体前皮质的变化为最甚,同时赤道部、核部和后皮质也发生了变化。在我们对兔晶体各部分的蛋白进行UVB照射时,受损的顺序为核部>前后皮质>赤道部[6]。本文用UVB照射培养的晶体,其损害发生的程度以前皮质最甚(表2),说明与既往文献报道的一致,本实验中UVB对晶体的损害也以直接作用为主[4,5,7],而发生于后皮质和核的变化可能为经培养液的间接作用。
需要强调的是本文的UVB剂量大大高于自然环境中的UV量,是一短期急性毒性作用,与自然环境中的UVB对人的慢性累积效应应有相当大的差别。但本文的结果提示我们无论在体外实验或是解释体内机制时,应注意培养液和组织液(房水等)的间接作用。
4 参考文献
1 Reme C,Reinboth J,Clausen M,et al.Light da-mage revisited:converging evidence,diverging views?Grefe's Arch Clin Exp Ophthalmol,1996;234:2
, 百拇医药
2 West SK,Valmadrid CT.Epidemiology of risk factors for age-related cataract.Surv Ophthalmol,1995;39:3234
3 Weinreb O,Dovrat A.Transglutaminase involvement in UV-A damage to the eye lens.Exp Eye Res,1996;63:591
4 Stuart DD,Sivak JG,Cullen AP,et al.UV-B radiation and the optical properties of cultured bovine lenses.Curr Eye Res,1991;10:177
5 Hightower K,McCready J.Mechanisms involved in cataract development following near-ultraviolet radiation of cultured lens.Curr Eye Res,1992;11:679
, 百拇医药
6 Wu K,Kojima M,et al.In vitro UV-B effect on lens protein solutions.Ophthalmic Res,1997;29:75
7 Spector A,Wang G,Wang R,et al.A brief photochemically induced oxidative insult causes irreversible lens damage and cataract:I.Transparency and epithelial cell layer.Exp Eye Res,1995;60:471
8 Wu K,Shui YB,Pan S,et al.In vitro UVB irradiation effects on lens membranes and their binding-capacity with lens proteins.眼科研究,1998;16:82
9 Yagi K.A simple fluorometric assay for lipidpero-xide in blood plasma.Biochem Med,1976;15:216
(1998-02-23收稿,1998-06-15修回), 百拇医药