一氧化氮和一氧化碳对胎盘促肾上腺皮质素
作者:倪 鑫 Roger Smith△
单位:
关键词:一氧化氮;一氧化碳;促肾上腺皮质素释放素;胎盘
摘要 目的摘要 目的: 研究一氧化氮(NO)和一氧化碳(CO)及其细胞内信使cGMP对培养的胎盘细胞促肾上腺皮质素释放素(CRH)分泌的调节作用。方法: 采用细胞培养技术观察体外培养的胎盘细胞分别给予NO和CO的供体或前体、NO合酶和血红素加氧酶的抑制剂以及鸟苷酸环化酶的抑制剂后,培养上清和细胞内CRH含量的变化。CRH含量的测定应用放射免疫分析技术。结果: NO供体硝普钠不仅可显著抑制CRH的基础分泌,还可抑制由KCl刺激所致的CRH的释放。NO合酶的抑制剂L-硝基-精氨酸甲酯和鸟苷酸环化酶抑制剂LY83583可逆转硝普钠对CRH分泌的抑制作用,还可促进CRH的基础分泌。CO前体Hemin和血红素加氧酶的抑制剂ZnPP9对CRH的基础分泌和KCl刺激引起的CRH的释放均无影响。结论: 外源性和内源性的NO均可抑制胎盘CRH的分泌。NO抑制胎盘CRH分泌的作用可能是由cGMP介导的。CO对胎盘CRH的分泌无影响。
, http://www.100md.com
中国图书资料分类法分类号 R714.12
The effects of nitric oxide and carbon monoxide on corticotropin
releasing hormone secretion from cultured placental cells
Ni Xin, Roger Smith (Department of Neurobiology, Department of Basic Medicine, Second Military Medical University, Shanghai, 200433)
Abstract Objective:To investigate the effects of nitric oxide(NO) and carbon monoxide(CO) on corticotropin releasing hormone (CRH) secretion from cultured placental cells. Methods: Changes of CRH contents in culture media were observed after cultured placental cells were treated with NO and CO donors or precursors, NO synthase (NOS) and heme oxygenase (HO) inhibitors and guanylate cyclase inhibitor, respectively. Measurement of CRH contents was performed by radioimmunoassay(RIA). Results: Sodium nitroprusside (SNP), NO donor, inhibited basal and KCl stimulated CRH secretion from cultured placental cells. This effect could be reversed by L-nitro-arginine methyl ester (L-NAME), a NOS inhibitor. L- NAME also increased basal CRH secretion. LY83583,a guanylate cyclase inhibitor, reversed SNP-induced suppression of CRH secretion and enhanced basal CRH secretion. However, CO precursor Hemin and HO inhibitor ZnPP9, did not affect basal and KCl-stimulated CRH secretion. Conclusion: Exogenous and endogenous NO could inhibit CRH secretion from placental cells. CO has no effect on CRH secretion from placental cells. The inhibitory effect of NO on CRH exocytosis may be mediated by cGMP.
, http://www.100md.com
Key words nitric oxide; carbon monoxide; corticotropin releasing hormone; placenta
在妊娠中晚期,人胎盘合体滋养层细胞产生和分泌大量促肾上腺皮质素释放素(CRH)进入母体和胎儿的体循环中。母体血中CRH的水平在临产前达到高峰。研究表明,胎盘CRH在母体和胎儿的下丘脑-垂体-肾上腺轴中起重要作用,与胎儿生长、成熟有密切关系[1];而且胎盘CRH犹如生物钟控制妊娠的长短,是分娩的启动因子[2]。而母体血中CRH水平的过高与早产、妊娠高血压、胎儿宫内发育迟缓有着密切的关系[3]。因此,研究和探讨调节胎盘CRH的合成和释放的因素,显得尤为重要。
一氧化氮(NO)和一氧化碳(CO)均可调节下丘脑CRH的释放[4,5]。现已发现胎盘滋养层细胞含有NO合酶(NOS),也可表达生成CO酶——血红素加氧酶。它们的细胞内信号转导系统,鸟苷酸环化酶也存在于胎盘细胞内。为此,我们用体外培养的胎盘细胞,研究NO和CO及其细胞内的信使cGMP对CRH分泌的调节作用。
, http://www.100md.com
1 材料和方法
1.1 试剂 硝普钠、L-精氨酸、L-硝基-精氨酸甲酯(L-NAME),Hemin, ZnPP9均购自Sigma 公司。LY83583购自ICN公司。培养基DMEM、胎牛血清(FCS)、胰酶和DNA酶I均购自Gibco公司。CRH抗血清由Lowry教授惠赠。
1.2 胎盘细胞的分离和培养 滋养层细胞的分离和培养按Kliman方法[6]。
1.3 不同效应剂对细胞的处理 滋养层细胞培养3 d后分化形成合体滋养层细胞。用DMEM培养液将细胞洗2次后, 加入新鲜的培养液孵育1 h。加入KCl、 硝普钠、 L-精氨酸、 L-NAME, Hemin, ZnPP9和LY83583, 使它们的最终浓度分别为:KCl 45 mmol/L; 硝普钠100 μmol/L; L-精氨酸100 μmol/L; L-NAME 100 μmol/L; Hemin 50~100 μmol/L; ZnPP9 100 μmol/L; LY83583 1 μmol/L。细胞孵育3 h后, 收集上清和细胞, 置入-20℃待测。
, http://www.100md.com
1.4 CRH的放射免疫测定 用Vycor硅土提取胎盘细胞培养上清液中的CRH。2 ml的培养上清中加入150 mg硅土,30 min后,用水和2 mol/L HCl 洗,最后用60%的丙酮洗脱,洗脱液冷冻干燥后,贮存于-20℃。细胞内加入1 mol/L HCl,粉碎,置100℃水中10 min,离心,上清液冷冻干燥,贮存于-20℃。CRH的RIA采用我们以往建立的方法[7]。 CRH的碘标记采用氯胺-T方法。标记物经HPLC纯化。RIA的灵敏度为2.8 pg/L。
1.5 统计学处理 实验结果采用t检验和方差分析判断显著性差异。
2 结 果
2.1 NO供体和CO前体对CRH分泌的影响 胎盘细胞与NO的供体硝普钠共同孵育3 h后,培养上清液中CRH的含量明显降低,细胞内CRH的含量明显升高。NO对KCl刺激引起的CRH分泌也有抑制作用(图1)。给予CO前体Hemin后,培养上清和细胞内CRH的含量无明显变化。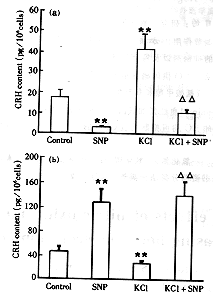
, 百拇医药
图 1 硝普钠对胎盘细胞CRH分泌的抑制作用
Fig 1 Sodium nitroprusside inhibits CRH secretion
from cultured placental cells
a: CRH contents in culture media; b: CRH contents in
cultured placental cells; SNP: Sodium nitroprusside;
Data were expressed as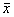 ±s, n=7; **P<0.01 vs control;△△P<0.01 vs KCl
±s, n=7; **P<0.01 vs control;△△P<0.01 vs KCl
, 百拇医药
图 2 L-NAME对CRH分泌的影响
Fig 2 The effect of L-NAME on CRH secretion
from cultured placental cells
Data were expressed as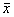 ±s, n=6; **P<0.01 vs
±s, n=6; **P<0.01 vs
control;△△P<0.01 vs L-NAME; ARG: L-arginine
2.2 NO合酶和CO合酶抑制剂的作用 NO合酶的抑制剂L-NAME可使培养上清中CRH含量明显增加, 提示L-NAME刺激CRH的基础分泌。 L-精氨酸可逆转其作用(图2)。 CO合酶抑制剂ZnPP9对CRH的基础分泌无明显作用, ZnPP9与Hemin合用对胎盘细胞分泌CRH也无影响。
, 百拇医药
2.3 鸟苷酸环化酶抑制剂LY83583的作用 LY83583可明显地提高CRH的基础分泌,并能逆转硝普钠的作用(图3)。
图 3 LY83583对胎盘CRH分泌的影响
Fig 3 The Effect of LY83583 on CRH secretion
from cultured placental cells
Data were expressed as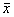 ±s, n=5; **P<0.01
±s, n=5; **P<0.01
, http://www.100md.com
vs control;△△P<0.01 vs LY 83583
3 讨 论
在体内,L-精氨酸在NO合酶的作用下生成鸟氨酸和NO。内源性NO以自分泌和旁分泌的方式调节递质和激素的释放。有关NO对下丘脑CRH的分泌调节作用的报道有争议。 Costa等[4]报道NO可抑制下丘脑CRH的释放。也有研究报道NO可刺激CRH的释放[8]。我们以往的研究发现,给胎盘组织灌流NO的供体硝普钠可抑制其释放CRH[9]。本研究表明,培养的胎盘细胞给予硝普钠,可显著地抑制基础CRH的分泌和KCl刺激引起的CRH的释放。
KCl刺激可使细胞膜去极化,细胞内分泌囊泡外排递质或激素。本研究发现,培养胎盘细胞给予KCl后,细胞内的CRH含量明显下降,而培养上清CRH的含量明显升高,说明KCl刺激导致CRH的胞裂外排。给予硝普钠后,细胞内CRH的含量明显升高,培养上清CRH的含量明显下降;硝普钠还可使KCl刺激细胞的CRH含量升高,提示硝普钠抑制胎盘细胞CRH的胞裂外排。有研究表明,NO对中枢神经系统神经递质释放的调节作用主要影响突触囊泡胞裂外排。Meredith等[10]报道,NO可抑制胰岛β细胞胰岛素的胞裂外排作用。结合本研究结果说明,NO对神经和内分泌系统的递质和激素分泌的调节作用,主要影响其囊泡的外排。
, 百拇医药
Eis等报道胎盘合体滋养层细胞可表达NO合酶,我们用RT-PCR的方法也发现,培养的胎盘细胞可表达NO合酶mRNA。胎盘CRH是由合体滋养层细胞产生和分泌的。培养的胎盘细胞给予NO合酶的抑制剂L-NAME后,CRH的基础分泌明显升高,L-精氨酸可逆转其作用。提示内源性的NO以旁分泌或自分泌的方式调节CRH基础分泌的作用。胎盘组织和细胞均可表达血红素加氧酶,但我们应用CO前体Hemin和血红素加氧酶抑制剂ZnPP9对CRH的基础分泌和KCl刺激引起的CRH释放均无影响,说明CO对胎盘CRH的分泌无影响。NO激活可溶性鸟氨酸环化酶,使细胞内cGMP含量升高而产生一系列的反应。该酶的抑制剂LY83583可逆转硝普钠的作用,说明NO-cGMP系统具有抑制CRH分泌的作用。LY83583还可刺激CRH的基础分泌,为内源性的NO对CRH基础分泌的调节作用提供了又一证据。
最近,我们的研究表明胎盘CRH是分娩的启动因子[2]。Giles等[11]发现, 多普勒检查脐带血流异常孕妇,其胎盘NO合酶活性明显降低。鉴于母体血CRH异常升高与早产有密切关系,而内源性NO对胎盘CRH基础分泌有抑制作用,因此,如果胎盘NO合酶活性降低,由此使CRH分泌过高,从而导致早产的发生。Lee等应用三磷酸甘油贴膜可延长妊娠,阻止孕妇早产。这种NO供体的治疗作用也可从NO抑制CRH分泌来解释。
, http://www.100md.com
参 考 文 献
1 Goland RS, Jozak S, Warren WB, et al. Elevated levels of umbilical cord plasma corticotropin-releasing hormone in growth-retarted fetuses. J Clin Endocrinol Metab, 1993, 77(5):1174
2 McLean M, Bisits A, Davies J, et al. A placental clock controlling the length of human pregnancy. Nat Med, 1995, 1(5): 460
3 Petraglia F, Aguzzoli L, Florio P, et al. Maternal plasma and placental immunoreactive corticotropin-releasing factor concentrations in infection-associated term and pre-term delivery. Placenta, 1995, 16(2):157
, 百拇医药
4 Costa A, Trainer P, Besser M, et al. Nitric oxide modulates the release of corticotropin-releasing hormone from the rat hypothalamus. Brain Res, 1993, 605(2):187
5 Pozzoli G, Mancuso C, Mirtella A, et al. Carbon monoxide as a novel neuroendocrine modulator: inhibition of stimulated corticotropin-releasing hormone release from acute rat hypothalamic explants. Endocrinology, 1994, 135(6): 2314
6 Kliman HJ, Nestler JE, Sermasi E, et al. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology, 1986,118(4):1567
, 百拇医药
7 Chan EC, Thomson M, Madsen G, et al. Differential processing of corticotrophin-releasing hormone by the human placenta and hypothalamus. Biochem Biophys Res Commun, 1988,153(3):1229
8 Karanth S, Lyson K, McCann SM. Role of nitric oxide in interleukin-2 induced corticotropin-releasing factor release from incubated hypothalami. Proc Natl Acad Sci USA, 1993, 90(8):3383
9 Roe CM, Leitch IM, Boura AL, et al. Nitric oxide regulation of corticotropin-releasing hormone release from the human perfuse placenta in vitro. J Clin Endocrinol Metab, 1996, 81(2):763
, http://www.100md.com
10 Meredith M, Rabaglia ME, Corbett JA, et al. Dual functional effects of interleukin-1β on purine nucleotides and insulin secretion in rat islets and INS-1 cells. Diabetes, 1996, 45(12):1783
11 Giles W, OCallaghan S, Read M, et al. Placental nitric oxide synthase activity and abnormal umbilical artery flow velocity waveforms. Obstet Gynecol, 1997, 89(1): 49
(1997-12-25收稿, 1998-05-08修回)
, http://www.100md.com
单位:
关键词:一氧化氮;一氧化碳;促肾上腺皮质素释放素;胎盘
摘要 目的摘要 目的: 研究一氧化氮(NO)和一氧化碳(CO)及其细胞内信使cGMP对培养的胎盘细胞促肾上腺皮质素释放素(CRH)分泌的调节作用。方法: 采用细胞培养技术观察体外培养的胎盘细胞分别给予NO和CO的供体或前体、NO合酶和血红素加氧酶的抑制剂以及鸟苷酸环化酶的抑制剂后,培养上清和细胞内CRH含量的变化。CRH含量的测定应用放射免疫分析技术。结果: NO供体硝普钠不仅可显著抑制CRH的基础分泌,还可抑制由KCl刺激所致的CRH的释放。NO合酶的抑制剂L-硝基-精氨酸甲酯和鸟苷酸环化酶抑制剂LY83583可逆转硝普钠对CRH分泌的抑制作用,还可促进CRH的基础分泌。CO前体Hemin和血红素加氧酶的抑制剂ZnPP9对CRH的基础分泌和KCl刺激引起的CRH的释放均无影响。结论: 外源性和内源性的NO均可抑制胎盘CRH的分泌。NO抑制胎盘CRH分泌的作用可能是由cGMP介导的。CO对胎盘CRH的分泌无影响。
, http://www.100md.com
中国图书资料分类法分类号 R714.12
The effects of nitric oxide and carbon monoxide on corticotropin
releasing hormone secretion from cultured placental cells
Ni Xin, Roger Smith (Department of Neurobiology, Department of Basic Medicine, Second Military Medical University, Shanghai, 200433)
Abstract Objective:To investigate the effects of nitric oxide(NO) and carbon monoxide(CO) on corticotropin releasing hormone (CRH) secretion from cultured placental cells. Methods: Changes of CRH contents in culture media were observed after cultured placental cells were treated with NO and CO donors or precursors, NO synthase (NOS) and heme oxygenase (HO) inhibitors and guanylate cyclase inhibitor, respectively. Measurement of CRH contents was performed by radioimmunoassay(RIA). Results: Sodium nitroprusside (SNP), NO donor, inhibited basal and KCl stimulated CRH secretion from cultured placental cells. This effect could be reversed by L-nitro-arginine methyl ester (L-NAME), a NOS inhibitor. L- NAME also increased basal CRH secretion. LY83583,a guanylate cyclase inhibitor, reversed SNP-induced suppression of CRH secretion and enhanced basal CRH secretion. However, CO precursor Hemin and HO inhibitor ZnPP9, did not affect basal and KCl-stimulated CRH secretion. Conclusion: Exogenous and endogenous NO could inhibit CRH secretion from placental cells. CO has no effect on CRH secretion from placental cells. The inhibitory effect of NO on CRH exocytosis may be mediated by cGMP.
, http://www.100md.com
Key words nitric oxide; carbon monoxide; corticotropin releasing hormone; placenta
在妊娠中晚期,人胎盘合体滋养层细胞产生和分泌大量促肾上腺皮质素释放素(CRH)进入母体和胎儿的体循环中。母体血中CRH的水平在临产前达到高峰。研究表明,胎盘CRH在母体和胎儿的下丘脑-垂体-肾上腺轴中起重要作用,与胎儿生长、成熟有密切关系[1];而且胎盘CRH犹如生物钟控制妊娠的长短,是分娩的启动因子[2]。而母体血中CRH水平的过高与早产、妊娠高血压、胎儿宫内发育迟缓有着密切的关系[3]。因此,研究和探讨调节胎盘CRH的合成和释放的因素,显得尤为重要。
一氧化氮(NO)和一氧化碳(CO)均可调节下丘脑CRH的释放[4,5]。现已发现胎盘滋养层细胞含有NO合酶(NOS),也可表达生成CO酶——血红素加氧酶。它们的细胞内信号转导系统,鸟苷酸环化酶也存在于胎盘细胞内。为此,我们用体外培养的胎盘细胞,研究NO和CO及其细胞内的信使cGMP对CRH分泌的调节作用。
, http://www.100md.com
1 材料和方法
1.1 试剂 硝普钠、L-精氨酸、L-硝基-精氨酸甲酯(L-NAME),Hemin, ZnPP9均购自Sigma 公司。LY83583购自ICN公司。培养基DMEM、胎牛血清(FCS)、胰酶和DNA酶I均购自Gibco公司。CRH抗血清由Lowry教授惠赠。
1.2 胎盘细胞的分离和培养 滋养层细胞的分离和培养按Kliman方法[6]。
1.3 不同效应剂对细胞的处理 滋养层细胞培养3 d后分化形成合体滋养层细胞。用DMEM培养液将细胞洗2次后, 加入新鲜的培养液孵育1 h。加入KCl、 硝普钠、 L-精氨酸、 L-NAME, Hemin, ZnPP9和LY83583, 使它们的最终浓度分别为:KCl 45 mmol/L; 硝普钠100 μmol/L; L-精氨酸100 μmol/L; L-NAME 100 μmol/L; Hemin 50~100 μmol/L; ZnPP9 100 μmol/L; LY83583 1 μmol/L。细胞孵育3 h后, 收集上清和细胞, 置入-20℃待测。
, http://www.100md.com
1.4 CRH的放射免疫测定 用Vycor硅土提取胎盘细胞培养上清液中的CRH。2 ml的培养上清中加入150 mg硅土,30 min后,用水和2 mol/L HCl 洗,最后用60%的丙酮洗脱,洗脱液冷冻干燥后,贮存于-20℃。细胞内加入1 mol/L HCl,粉碎,置100℃水中10 min,离心,上清液冷冻干燥,贮存于-20℃。CRH的RIA采用我们以往建立的方法[7]。 CRH的碘标记采用氯胺-T方法。标记物经HPLC纯化。RIA的灵敏度为2.8 pg/L。
1.5 统计学处理 实验结果采用t检验和方差分析判断显著性差异。
2 结 果
2.1 NO供体和CO前体对CRH分泌的影响 胎盘细胞与NO的供体硝普钠共同孵育3 h后,培养上清液中CRH的含量明显降低,细胞内CRH的含量明显升高。NO对KCl刺激引起的CRH分泌也有抑制作用(图1)。给予CO前体Hemin后,培养上清和细胞内CRH的含量无明显变化。

, 百拇医药
图 1 硝普钠对胎盘细胞CRH分泌的抑制作用
Fig 1 Sodium nitroprusside inhibits CRH secretion
from cultured placental cells
a: CRH contents in culture media; b: CRH contents in
cultured placental cells; SNP: Sodium nitroprusside;
Data were expressed as

, 百拇医药
图 2 L-NAME对CRH分泌的影响
Fig 2 The effect of L-NAME on CRH secretion
from cultured placental cells
Data were expressed as
control;△△P<0.01 vs L-NAME; ARG: L-arginine
2.2 NO合酶和CO合酶抑制剂的作用 NO合酶的抑制剂L-NAME可使培养上清中CRH含量明显增加, 提示L-NAME刺激CRH的基础分泌。 L-精氨酸可逆转其作用(图2)。 CO合酶抑制剂ZnPP9对CRH的基础分泌无明显作用, ZnPP9与Hemin合用对胎盘细胞分泌CRH也无影响。
, 百拇医药
2.3 鸟苷酸环化酶抑制剂LY83583的作用 LY83583可明显地提高CRH的基础分泌,并能逆转硝普钠的作用(图3)。

图 3 LY83583对胎盘CRH分泌的影响
Fig 3 The Effect of LY83583 on CRH secretion
from cultured placental cells
Data were expressed as
, http://www.100md.com
vs control;△△P<0.01 vs LY 83583
3 讨 论
在体内,L-精氨酸在NO合酶的作用下生成鸟氨酸和NO。内源性NO以自分泌和旁分泌的方式调节递质和激素的释放。有关NO对下丘脑CRH的分泌调节作用的报道有争议。 Costa等[4]报道NO可抑制下丘脑CRH的释放。也有研究报道NO可刺激CRH的释放[8]。我们以往的研究发现,给胎盘组织灌流NO的供体硝普钠可抑制其释放CRH[9]。本研究表明,培养的胎盘细胞给予硝普钠,可显著地抑制基础CRH的分泌和KCl刺激引起的CRH的释放。
KCl刺激可使细胞膜去极化,细胞内分泌囊泡外排递质或激素。本研究发现,培养胎盘细胞给予KCl后,细胞内的CRH含量明显下降,而培养上清CRH的含量明显升高,说明KCl刺激导致CRH的胞裂外排。给予硝普钠后,细胞内CRH的含量明显升高,培养上清CRH的含量明显下降;硝普钠还可使KCl刺激细胞的CRH含量升高,提示硝普钠抑制胎盘细胞CRH的胞裂外排。有研究表明,NO对中枢神经系统神经递质释放的调节作用主要影响突触囊泡胞裂外排。Meredith等[10]报道,NO可抑制胰岛β细胞胰岛素的胞裂外排作用。结合本研究结果说明,NO对神经和内分泌系统的递质和激素分泌的调节作用,主要影响其囊泡的外排。
, 百拇医药
Eis等报道胎盘合体滋养层细胞可表达NO合酶,我们用RT-PCR的方法也发现,培养的胎盘细胞可表达NO合酶mRNA。胎盘CRH是由合体滋养层细胞产生和分泌的。培养的胎盘细胞给予NO合酶的抑制剂L-NAME后,CRH的基础分泌明显升高,L-精氨酸可逆转其作用。提示内源性的NO以旁分泌或自分泌的方式调节CRH基础分泌的作用。胎盘组织和细胞均可表达血红素加氧酶,但我们应用CO前体Hemin和血红素加氧酶抑制剂ZnPP9对CRH的基础分泌和KCl刺激引起的CRH释放均无影响,说明CO对胎盘CRH的分泌无影响。NO激活可溶性鸟氨酸环化酶,使细胞内cGMP含量升高而产生一系列的反应。该酶的抑制剂LY83583可逆转硝普钠的作用,说明NO-cGMP系统具有抑制CRH分泌的作用。LY83583还可刺激CRH的基础分泌,为内源性的NO对CRH基础分泌的调节作用提供了又一证据。
最近,我们的研究表明胎盘CRH是分娩的启动因子[2]。Giles等[11]发现, 多普勒检查脐带血流异常孕妇,其胎盘NO合酶活性明显降低。鉴于母体血CRH异常升高与早产有密切关系,而内源性NO对胎盘CRH基础分泌有抑制作用,因此,如果胎盘NO合酶活性降低,由此使CRH分泌过高,从而导致早产的发生。Lee等应用三磷酸甘油贴膜可延长妊娠,阻止孕妇早产。这种NO供体的治疗作用也可从NO抑制CRH分泌来解释。
, http://www.100md.com
参 考 文 献
1 Goland RS, Jozak S, Warren WB, et al. Elevated levels of umbilical cord plasma corticotropin-releasing hormone in growth-retarted fetuses. J Clin Endocrinol Metab, 1993, 77(5):1174
2 McLean M, Bisits A, Davies J, et al. A placental clock controlling the length of human pregnancy. Nat Med, 1995, 1(5): 460
3 Petraglia F, Aguzzoli L, Florio P, et al. Maternal plasma and placental immunoreactive corticotropin-releasing factor concentrations in infection-associated term and pre-term delivery. Placenta, 1995, 16(2):157
, 百拇医药
4 Costa A, Trainer P, Besser M, et al. Nitric oxide modulates the release of corticotropin-releasing hormone from the rat hypothalamus. Brain Res, 1993, 605(2):187
5 Pozzoli G, Mancuso C, Mirtella A, et al. Carbon monoxide as a novel neuroendocrine modulator: inhibition of stimulated corticotropin-releasing hormone release from acute rat hypothalamic explants. Endocrinology, 1994, 135(6): 2314
6 Kliman HJ, Nestler JE, Sermasi E, et al. Purification, characterization, and in vitro differentiation of cytotrophoblasts from human term placentae. Endocrinology, 1986,118(4):1567
, 百拇医药
7 Chan EC, Thomson M, Madsen G, et al. Differential processing of corticotrophin-releasing hormone by the human placenta and hypothalamus. Biochem Biophys Res Commun, 1988,153(3):1229
8 Karanth S, Lyson K, McCann SM. Role of nitric oxide in interleukin-2 induced corticotropin-releasing factor release from incubated hypothalami. Proc Natl Acad Sci USA, 1993, 90(8):3383
9 Roe CM, Leitch IM, Boura AL, et al. Nitric oxide regulation of corticotropin-releasing hormone release from the human perfuse placenta in vitro. J Clin Endocrinol Metab, 1996, 81(2):763
, http://www.100md.com
10 Meredith M, Rabaglia ME, Corbett JA, et al. Dual functional effects of interleukin-1β on purine nucleotides and insulin secretion in rat islets and INS-1 cells. Diabetes, 1996, 45(12):1783
11 Giles W, OCallaghan S, Read M, et al. Placental nitric oxide synthase activity and abnormal umbilical artery flow velocity waveforms. Obstet Gynecol, 1997, 89(1): 49
(1997-12-25收稿, 1998-05-08修回)
, http://www.100md.com