肿瘤坏死因子-α和骨形成发生蛋白2诱导成纤维细胞成骨表型表达的体外研究△
作者:邓廉夫1 汤雪明1 柴本甫2 李 慧2
单位:1 上海第二医科大学细胞生物学实验室(上海,200025);2 上海市伤骨科研究所
关键词:成纤维细胞;成骨;诱导因子
中国修复重建外科杂志980414 摘 要 成纤维细胞的成骨作用已在体内外得到证实。为进一步探索诱导成纤维细胞成骨潜能得以表现的调控因素,以实现体外获取大量成骨型成纤维细胞、形成骨修复材料的设想,采用分离、纯化人皮肤成纤维细胞,使其生长在含不同浓度的EGF、IL-6、TNF-α、BMP2培养液的干预条件下,采用生物化学、组织化学和电镜观察方法,检测成纤维细胞成骨性标志物形成状况。发现:TNF-α和BMP2联合应用,可使成纤维细胞分泌碱性磷酸酶、骨钙素及胶原的量增加;成纤维细胞由梭形向圆形或多突形转化,蛋白分泌旺盛;细胞外基质中,丰富的胶原纤丝定向或杂乱排列,其间散在较多的钙颗粒;成纤维细胞可重叠交织形成多层结构,其表面分泌颗粒和钙盐结晶堆积,并不断融合扩大成骨结节。认为,TNF-α和BMP2可诱导成纤维细胞成骨。
, 百拇医药
REGULATORY FACTORS OF OSTEOGENIC PHENOTYPICAL EXPERESSION BY FIBROBLASTS IN VITRO/Deng Lianfu, Tang Xueming, Chai Benfu et al. The Laboratory of Cell Biology. Second Medical University of Shanghai, Shanghai, P.R. China 200025
Abstract In order to explore further the regulatory factors to the potentiality in inducing osteogenesis by fibroblasts, the fibroblasts were isolated, and purified from human skin, and were grown in incubation in the media of EGF, IL-6, TNF-α and BMP2 at different concentrations for two weeks, then, the markers for osteogenic features were investigated by biochemistry, histochemistry and electron microscopic observations. It was found that the combined use of TNF-α and BMP2 could stimulate fibroblasts to secrete alkaline phosphatase, osteocalcin and collagen, and the morphological changes of the fibroblasts were also very stroking. In the extracellular matrix, the collagen fibrils, with or without periodicity, were arranged regularly or randomly oriented, and numerous minute calcium granules were interspersed among them. The fibroblasts were interwoven one on top of another in the form of multilayer structure and on the surface, there were secreting granules and piling up of calcium crystals which coalessed steadily and increased in size in forming bony nodules. It was considered that TNF-α and BMP2 were capable of inducing the fibroblasts to form bone.
, 百拇医药
Key words Fibroblast Osteogenesis Induction factor
在过去通过从成纤维细胞的来源、功能及归宿等方面的研究,对其成骨现象获取了较多的实验资料,并认识到有可能存在着特殊环境、特殊需要条件对成纤维细胞成骨潜能的触发机制[1,2]。我们以近年来有关细胞因子骨作用机制的研究进展为依据,藉以探寻成纤维细胞成骨表型表达的调控因素,为体外获取骨修复材料及组织工程的建立打下基础。
1 材料与方法
1.1 分离、纯化及培养人皮肤成纤维细胞
取人正常皮肤,剪除表皮组织,2.5%胰蛋白酶消化、分离真皮成纤维细胞,Dulbecco's改良最低必需培养液[Dulbecco's modified eagle medium, DMEM(含10%小牛血清、青霉素100 U/ml及链霉素100 μg/ml)]稀释细胞,调合适细胞浓度,以1×105/cm2接种至75 ml培养瓶,置37℃、5% CO2培养箱内,传代培养。第3次传代培养的成纤维细胞,以同样密度接种至铺有或无玻片的12孔培养板和培养瓶中,原培养液培养16小时,轻轻吸去培养液,换条件培养液。
, 百拇医药
1.2 条件培养液对成纤维细胞的影响
1.2.1 条件培养液的配制及诱导因素的筛选 条件培养液分别含表皮生长因子(epidermal grouth factor, EGF) 10,20,30,50及80 ng/ml;肿瘤坏死因子-α(tumornecrosis factor-α,TNF-α) 5,50,500,1 000及2 000 U/ml;白细胞介素-6(interleukin-6,IL-6) 100,200,300,400及600 U/ml;骨形态发生蛋白2(bone morphogenetic protein 2,BMP2) 0.4,0.8,1.2及1.6 μg/ml。加入培养瓶(板),置37℃、5% CO2培养箱,每3天换一次条件培养液,培养细胞生长2周。逐日在倒置显微镜下观察成纤维细胞的形态、生长及结节形成状况。
1.2.2 据成纤维细胞在不同条件干预下生长所形成结节及形态转化的状况,选取TNF-α 50 U/ml和BMP2 0.4 μg/ml联合条件,制成条件培养液,加入以同样密度接种细胞的培养瓶(板)中,培养细胞,设四个复瓶(板),检测成纤维细胞成骨表型表达状况。
, 百拇医药
碱性磷酸酶(alkaline phosphatase, ALP)活力 收集不同时期培养的细胞上清液,以对-硝基酚磷酯为底物,分光光度计测OD值(波长405 nm),然后换算成ALP活力,以每毫升上清液中含有的ALP单位数(U/ml)表示。
骨钙素含量 采用放射免疫技术,测不同时期细胞上清液中骨钙素含量。
胶原合成量 含3H-脯氨酸的条件培养液培养细胞,收集不同期上清液经胃蛋白酶消化、处理后,过滤至玻璃纤维膜上,分别经蒸馏水、乙醇冲洗滤膜数次,干燥后进行液闪计数。3H-脯氨酸掺入胶原的量用cpm值表示。
组织化学研究 细胞培养至3周,趋骨性荧光素标记、ARS染色和甲苯胺蓝染色方法同以往报道[2]。
透射电镜观察 细胞培养至第3周,用Hank's液清液三次,戊二醛固定,用细胞刮刮下细胞,收集于离心管,离心沉淀,锇酸再固定,丙酮逐级脱水,树脂浸透包埋,超薄切片,铅、铀双重染色,电镜观察。
, 百拇医药
1.3 统计学处理
计量资料均采用t检验。
2 结果
2.1 显微变化
传代培养的成纤维细胞30分钟开始贴壁,10小时后全部贴壁生长并伸出生长突。非条件液培养的成纤维细胞呈梭形,极向排列,第7天铺满瓶壁,指纹状排列明显增加,至第3周收获时,无结节形成。含EGF 50ng/ml的条件培养液培养的细胞,增殖活跃,核分裂相细胞较多,至培养的第5天铺满瓶壁,呈极向或交叉排列,随细胞密度增加及培养时间延长,细胞因接触性抑制而生长缓慢,第10天时,可见有膜片状从瓶壁脱落。含TNF-α 50 U/ml条件培养液培养的细胞,24小时后,视野中圆形或鳞片形细胞比例增加,核分裂相明显,核仁清晰,细胞集落性生长并形成多层结构,至7天时,在多层结构的表面分泌物集聚成不透光的结节,但随培养时间的延长,只有结节数量增加,而无结节密度加深。在含BMP2 0.4 μg/ml的条件培养液作用下,多突形细胞比例增加,细胞内外有较多的分泌颗粒或囊泡,但细胞增殖缓慢,至第2周时,视野中无明显的重叠交织性多层结构及结节形成。当应用含TNF-α(50 U/ml)和BMP2(0.4 μg/ml)的联合条件培养液作用于成纤维细胞时,圆形或多突形细胞明显增加,细胞增殖迅速,细胞内外见有大量的分泌颗粒或囊泡,至培养的第12天,在细胞交织形成的多层重叠结构的表面,分泌物集聚成不透光的结节;随培养时间延长,结节增大并相互连接成小梁状,其数量增多、密度逐渐加深呈深黑色(图1,2);结节经趋骨性四环素荧光标记,呈金黄色强荧光,经ARS染色,呈深红色钙阳性反应,并在结节处含有甲苯胺蓝染色强阳性的粘多糖类异染物质。表明结节为新生骨组织。
, 百拇医药
2.2 体外骨生成的超微结构变化
在TNF-α(50 U/ml)和BMP2(0.4 μg/ml)联合诱导后,透射电镜下可见成纤维细胞呈方形并行排列,细胞膜有指状突起,细胞浆内有丰富的线粒体,粗面内质网量多并池状扩张,可见有分泌泡排出,细胞核不规整(图3);细胞外基质中,胶原纤丝呈波浪状或杂乱排列,纤丝束间散在钙化颗粒及基质小泡(图4);在细胞及基质表面,有钙化斑形成(图5)。
2.3 ALP活力(U/ml)的变化
在TNF-α(50 U/ml)和BMP2(0.4 μg/ml)诱导下,成纤维细胞分泌的ALP活力,在原基础上进一步升高(图6),从而为钙盐沉积于Ⅰ型胶原提供了条件。
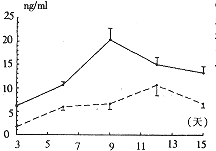
2.4 骨钙素分泌量的变化
, 百拇医药 含一定浓度TNF-α和BMP2的联合条件培养液的成纤维细胞所形成的骨钙素水平高于非条件培养
图1 联合条件培养液培养第12天,在细胞多层结构的表面,分泌物聚集成不透光的结节(倒置显微镜 ×66)
图2 联合条件培养液培养第20天,结节致密呈深黑色,并逐渐形成小梁状结构(倒置显微镜 ×66)
液培养的成纤维细胞,其最大分泌量提前发生,培养第9天时,联合条件培养液干预组成纤维细胞的骨钙素分泌量明显高于非条件培养液组(P<0.05,图7)。
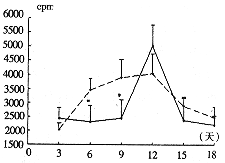
2.5 3H-脯氨酸掺入胶原的量
, http://www.100md.com
3 H-脯氨酸掺入的量代表成纤维细胞胶原合成量。在TNF-α和BMP2的联合干预下,成纤维细胞分泌胶原的时间曲线发生了改变,联合条件培养液干预组成纤维细胞3H-脯氨酸掺入量,在培养第6天和第9天时,低于非条件培养液培养组(P<0.05),但在培养第9天和第12天时,骤然增加并达高峰(图8)。
图3 联合条件培养液培养第21天,细胞呈方形,蛋白分泌相旺盛(透射电镜 ×6 000) 图4 联合条件培养液培养第21天,细胞外胶原纤丝呈波浪状排列,其间有钙化颗粒(透射电镜 ×6 000) 图5 联合条件培养液培养第21天,细胞外基质内形成钙化斑(透射电镜 ×6 000)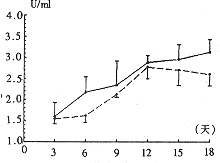
, 百拇医药
图6 ALP活力的变化对比图 图7 骨钙素量的变化对比图 图8 3H-脯氨酸掺入胶原量的变化对比图
非条件培养…△… 联合条件培养—△—
3 讨论
成纤维细胞与骨系细胞一样起源于间充质细胞,在骨发生、骨修复过程中,成骨细胞、成软骨细胞和成纤维细胞可表达成骨的共有表型[3]。因此,在探寻加速骨修复途径的研究领域,存在于骨髓、骨外膜、牙周韧带的间充质细胞的成骨作用一直为人们所重视[4~6]。我们也发现,骨折部位及体外培养的成纤维细胞可形成骨组织并转化为骨细胞[1,2],而且近期体外研究表明,滑膜成纤维细胞样细胞同样可形成骨组织。成纤维细胞或成纤维细胞样细胞参与成骨现象可能是成纤维细胞固有特征在特殊环境、特殊需要条件下所进行分化的不同表现。在一定条件下使来源丰富的成纤维细胞转化为成骨型细胞,将有可能成为骨修复组织工程的理想材料。因此,寻求成纤维细胞向成骨型转化的合适诱导条件与发生机理,则是我们继续深入与拓展的关键。近年来,有关细胞因子和生长因子在骨作用机制的深入研究,为探寻具有对成纤维细胞成骨潜能触发作用的特殊需要条件提供了可能途径。
, http://www.100md.com
在骨发生及骨形成过程中,细胞的生长、发育乃至分化,有着复杂的调控机制,既需要有丝分裂原刺激因子的存在,又要求一种包括Ⅰ型胶原纤维和蛋白多糖等大分子基质成分的立体构型环境。在我们的实验中,非条件培养液以及单独应用含EGF、IL-6、TNF-α、BMP2的条件培养液培养的成纤维细胞,尽管可检测到ALP、骨钙素的形成,因不具备骨形成的合理条件而无骨结节形成。一定浓度TNF-α和BMP2联合作用下的成纤维细胞,骨钙素及ALP分泌水平进一步升高;胶原分泌的时间—效应曲线发生了改变,这一过程可能存在着成纤维细胞由分泌Ⅰ型、Ⅲ型胶原转化为以分泌Ⅰ型胶原的“开关”机制;成纤维细胞由长梭形向方形或圆形演变,增殖迅速,蛋白分泌功能旺盛;细胞外基质中,具有或无周期性横纹的胶原纤丝杂乱或定向排列,与细胞一起形成重叠交织的多层结构,在其表面钙颗粒、基质小泡及分泌物集聚形成针状或方形结晶,并不断融合扩大为结节,经组织化学显示结节内含骨性成分,趋骨性荧光素证实为新生骨组织。因此,一定浓度的TNF-α和BMP2联合应用,是诱导成纤维细胞成骨表型表达的因素之一。
, 百拇医药
在体内骨折处,TNF-α、BMP2可来源于骨折碎片及早期的骨痂细胞。TNF-α和BMP2协同作用下,诱发成纤维细胞成骨表型的表达,可能与TNF-α及BMP2能激活细胞分裂与转化、活化细胞内传导途径,进而启动处于“关闭”状态的成纤维细胞成骨性标志基因、使成纤维细胞向成骨型定向分化有关,进一步的作用机理正在研究中。
4 参考文献
1 柴本甫,汤雪明,李 慧.骨折二期愈合过程中的成纤维细胞成骨作用.中华骨科杂志,1996;16(4):245
2 柴本甫,汤雪明,徐荣辉.家兔皮肤成纤维细胞的成骨潜能(组织化学及放射自显影研究).中华骨科杂志,1994;16(11):682
3 Hugens SS, Hicks DG, O'keefe RJ et al. Shared phentypic expression of osteoblasts and chondrocytes in fracture callus. J Bone Miner Res, 1995;10(4):533
, http://www.100md.com
4 Mizuno M, Shindo M, Kobayashi D et al. Osteogenesis by bone marrow stromal cell maintained on type Ⅰ collagen matrix gels in vivo. Bone, 1997;20(2):101
5 Nakahara H, Dennis JE, Bruder PS et al. In vitro differentiation of bone and hypertrophic cartilage from periosteal-derived cells. Exp Cell Res, 1991;195(3):492
6 Herr Y, Masahiro M, Lin WL et al. The origin of fibroblasts and their role in the early stages of horizontal funcation defect healing in the beagle dog. J Periodontol, 1995;66(8):716
△ 国家自然科学基金资助项目
(收稿:1997-10-29), 百拇医药
单位:1 上海第二医科大学细胞生物学实验室(上海,200025);2 上海市伤骨科研究所
关键词:成纤维细胞;成骨;诱导因子
中国修复重建外科杂志980414 摘 要 成纤维细胞的成骨作用已在体内外得到证实。为进一步探索诱导成纤维细胞成骨潜能得以表现的调控因素,以实现体外获取大量成骨型成纤维细胞、形成骨修复材料的设想,采用分离、纯化人皮肤成纤维细胞,使其生长在含不同浓度的EGF、IL-6、TNF-α、BMP2培养液的干预条件下,采用生物化学、组织化学和电镜观察方法,检测成纤维细胞成骨性标志物形成状况。发现:TNF-α和BMP2联合应用,可使成纤维细胞分泌碱性磷酸酶、骨钙素及胶原的量增加;成纤维细胞由梭形向圆形或多突形转化,蛋白分泌旺盛;细胞外基质中,丰富的胶原纤丝定向或杂乱排列,其间散在较多的钙颗粒;成纤维细胞可重叠交织形成多层结构,其表面分泌颗粒和钙盐结晶堆积,并不断融合扩大成骨结节。认为,TNF-α和BMP2可诱导成纤维细胞成骨。
, 百拇医药
REGULATORY FACTORS OF OSTEOGENIC PHENOTYPICAL EXPERESSION BY FIBROBLASTS IN VITRO/Deng Lianfu, Tang Xueming, Chai Benfu et al. The Laboratory of Cell Biology. Second Medical University of Shanghai, Shanghai, P.R. China 200025
Abstract In order to explore further the regulatory factors to the potentiality in inducing osteogenesis by fibroblasts, the fibroblasts were isolated, and purified from human skin, and were grown in incubation in the media of EGF, IL-6, TNF-α and BMP2 at different concentrations for two weeks, then, the markers for osteogenic features were investigated by biochemistry, histochemistry and electron microscopic observations. It was found that the combined use of TNF-α and BMP2 could stimulate fibroblasts to secrete alkaline phosphatase, osteocalcin and collagen, and the morphological changes of the fibroblasts were also very stroking. In the extracellular matrix, the collagen fibrils, with or without periodicity, were arranged regularly or randomly oriented, and numerous minute calcium granules were interspersed among them. The fibroblasts were interwoven one on top of another in the form of multilayer structure and on the surface, there were secreting granules and piling up of calcium crystals which coalessed steadily and increased in size in forming bony nodules. It was considered that TNF-α and BMP2 were capable of inducing the fibroblasts to form bone.
, 百拇医药
Key words Fibroblast Osteogenesis Induction factor
在过去通过从成纤维细胞的来源、功能及归宿等方面的研究,对其成骨现象获取了较多的实验资料,并认识到有可能存在着特殊环境、特殊需要条件对成纤维细胞成骨潜能的触发机制[1,2]。我们以近年来有关细胞因子骨作用机制的研究进展为依据,藉以探寻成纤维细胞成骨表型表达的调控因素,为体外获取骨修复材料及组织工程的建立打下基础。
1 材料与方法
1.1 分离、纯化及培养人皮肤成纤维细胞
取人正常皮肤,剪除表皮组织,2.5%胰蛋白酶消化、分离真皮成纤维细胞,Dulbecco's改良最低必需培养液[Dulbecco's modified eagle medium, DMEM(含10%小牛血清、青霉素100 U/ml及链霉素100 μg/ml)]稀释细胞,调合适细胞浓度,以1×105/cm2接种至75 ml培养瓶,置37℃、5% CO2培养箱内,传代培养。第3次传代培养的成纤维细胞,以同样密度接种至铺有或无玻片的12孔培养板和培养瓶中,原培养液培养16小时,轻轻吸去培养液,换条件培养液。
, 百拇医药
1.2 条件培养液对成纤维细胞的影响
1.2.1 条件培养液的配制及诱导因素的筛选 条件培养液分别含表皮生长因子(epidermal grouth factor, EGF) 10,20,30,50及80 ng/ml;肿瘤坏死因子-α(tumornecrosis factor-α,TNF-α) 5,50,500,1 000及2 000 U/ml;白细胞介素-6(interleukin-6,IL-6) 100,200,300,400及600 U/ml;骨形态发生蛋白2(bone morphogenetic protein 2,BMP2) 0.4,0.8,1.2及1.6 μg/ml。加入培养瓶(板),置37℃、5% CO2培养箱,每3天换一次条件培养液,培养细胞生长2周。逐日在倒置显微镜下观察成纤维细胞的形态、生长及结节形成状况。
1.2.2 据成纤维细胞在不同条件干预下生长所形成结节及形态转化的状况,选取TNF-α 50 U/ml和BMP2 0.4 μg/ml联合条件,制成条件培养液,加入以同样密度接种细胞的培养瓶(板)中,培养细胞,设四个复瓶(板),检测成纤维细胞成骨表型表达状况。
, 百拇医药
碱性磷酸酶(alkaline phosphatase, ALP)活力 收集不同时期培养的细胞上清液,以对-硝基酚磷酯为底物,分光光度计测OD值(波长405 nm),然后换算成ALP活力,以每毫升上清液中含有的ALP单位数(U/ml)表示。
骨钙素含量 采用放射免疫技术,测不同时期细胞上清液中骨钙素含量。
胶原合成量 含3H-脯氨酸的条件培养液培养细胞,收集不同期上清液经胃蛋白酶消化、处理后,过滤至玻璃纤维膜上,分别经蒸馏水、乙醇冲洗滤膜数次,干燥后进行液闪计数。3H-脯氨酸掺入胶原的量用cpm值表示。
组织化学研究 细胞培养至3周,趋骨性荧光素标记、ARS染色和甲苯胺蓝染色方法同以往报道[2]。
透射电镜观察 细胞培养至第3周,用Hank's液清液三次,戊二醛固定,用细胞刮刮下细胞,收集于离心管,离心沉淀,锇酸再固定,丙酮逐级脱水,树脂浸透包埋,超薄切片,铅、铀双重染色,电镜观察。
, 百拇医药
1.3 统计学处理
计量资料均采用t检验。
2 结果
2.1 显微变化
传代培养的成纤维细胞30分钟开始贴壁,10小时后全部贴壁生长并伸出生长突。非条件液培养的成纤维细胞呈梭形,极向排列,第7天铺满瓶壁,指纹状排列明显增加,至第3周收获时,无结节形成。含EGF 50ng/ml的条件培养液培养的细胞,增殖活跃,核分裂相细胞较多,至培养的第5天铺满瓶壁,呈极向或交叉排列,随细胞密度增加及培养时间延长,细胞因接触性抑制而生长缓慢,第10天时,可见有膜片状从瓶壁脱落。含TNF-α 50 U/ml条件培养液培养的细胞,24小时后,视野中圆形或鳞片形细胞比例增加,核分裂相明显,核仁清晰,细胞集落性生长并形成多层结构,至7天时,在多层结构的表面分泌物集聚成不透光的结节,但随培养时间的延长,只有结节数量增加,而无结节密度加深。在含BMP2 0.4 μg/ml的条件培养液作用下,多突形细胞比例增加,细胞内外有较多的分泌颗粒或囊泡,但细胞增殖缓慢,至第2周时,视野中无明显的重叠交织性多层结构及结节形成。当应用含TNF-α(50 U/ml)和BMP2(0.4 μg/ml)的联合条件培养液作用于成纤维细胞时,圆形或多突形细胞明显增加,细胞增殖迅速,细胞内外见有大量的分泌颗粒或囊泡,至培养的第12天,在细胞交织形成的多层重叠结构的表面,分泌物集聚成不透光的结节;随培养时间延长,结节增大并相互连接成小梁状,其数量增多、密度逐渐加深呈深黑色(图1,2);结节经趋骨性四环素荧光标记,呈金黄色强荧光,经ARS染色,呈深红色钙阳性反应,并在结节处含有甲苯胺蓝染色强阳性的粘多糖类异染物质。表明结节为新生骨组织。
, 百拇医药
2.2 体外骨生成的超微结构变化
在TNF-α(50 U/ml)和BMP2(0.4 μg/ml)联合诱导后,透射电镜下可见成纤维细胞呈方形并行排列,细胞膜有指状突起,细胞浆内有丰富的线粒体,粗面内质网量多并池状扩张,可见有分泌泡排出,细胞核不规整(图3);细胞外基质中,胶原纤丝呈波浪状或杂乱排列,纤丝束间散在钙化颗粒及基质小泡(图4);在细胞及基质表面,有钙化斑形成(图5)。
2.3 ALP活力(U/ml)的变化
在TNF-α(50 U/ml)和BMP2(0.4 μg/ml)诱导下,成纤维细胞分泌的ALP活力,在原基础上进一步升高(图6),从而为钙盐沉积于Ⅰ型胶原提供了条件。
2.4 骨钙素分泌量的变化
, 百拇医药 含一定浓度TNF-α和BMP2的联合条件培养液的成纤维细胞所形成的骨钙素水平高于非条件培养

图1 联合条件培养液培养第12天,在细胞多层结构的表面,分泌物聚集成不透光的结节(倒置显微镜 ×66)

图2 联合条件培养液培养第20天,结节致密呈深黑色,并逐渐形成小梁状结构(倒置显微镜 ×66)
液培养的成纤维细胞,其最大分泌量提前发生,培养第9天时,联合条件培养液干预组成纤维细胞的骨钙素分泌量明显高于非条件培养液组(P<0.05,图7)。
2.5 3H-脯氨酸掺入胶原的量
, http://www.100md.com
3 H-脯氨酸掺入的量代表成纤维细胞胶原合成量。在TNF-α和BMP2的联合干预下,成纤维细胞分泌胶原的时间曲线发生了改变,联合条件培养液干预组成纤维细胞3H-脯氨酸掺入量,在培养第6天和第9天时,低于非条件培养液培养组(P<0.05),但在培养第9天和第12天时,骤然增加并达高峰(图8)。

图3 联合条件培养液培养第21天,细胞呈方形,蛋白分泌相旺盛(透射电镜 ×6 000) 图4 联合条件培养液培养第21天,细胞外胶原纤丝呈波浪状排列,其间有钙化颗粒(透射电镜 ×6 000) 图5 联合条件培养液培养第21天,细胞外基质内形成钙化斑(透射电镜 ×6 000)



, 百拇医药
图6 ALP活力的变化对比图 图7 骨钙素量的变化对比图 图8 3H-脯氨酸掺入胶原量的变化对比图
非条件培养…△… 联合条件培养—△—
3 讨论
成纤维细胞与骨系细胞一样起源于间充质细胞,在骨发生、骨修复过程中,成骨细胞、成软骨细胞和成纤维细胞可表达成骨的共有表型[3]。因此,在探寻加速骨修复途径的研究领域,存在于骨髓、骨外膜、牙周韧带的间充质细胞的成骨作用一直为人们所重视[4~6]。我们也发现,骨折部位及体外培养的成纤维细胞可形成骨组织并转化为骨细胞[1,2],而且近期体外研究表明,滑膜成纤维细胞样细胞同样可形成骨组织。成纤维细胞或成纤维细胞样细胞参与成骨现象可能是成纤维细胞固有特征在特殊环境、特殊需要条件下所进行分化的不同表现。在一定条件下使来源丰富的成纤维细胞转化为成骨型细胞,将有可能成为骨修复组织工程的理想材料。因此,寻求成纤维细胞向成骨型转化的合适诱导条件与发生机理,则是我们继续深入与拓展的关键。近年来,有关细胞因子和生长因子在骨作用机制的深入研究,为探寻具有对成纤维细胞成骨潜能触发作用的特殊需要条件提供了可能途径。
, http://www.100md.com
在骨发生及骨形成过程中,细胞的生长、发育乃至分化,有着复杂的调控机制,既需要有丝分裂原刺激因子的存在,又要求一种包括Ⅰ型胶原纤维和蛋白多糖等大分子基质成分的立体构型环境。在我们的实验中,非条件培养液以及单独应用含EGF、IL-6、TNF-α、BMP2的条件培养液培养的成纤维细胞,尽管可检测到ALP、骨钙素的形成,因不具备骨形成的合理条件而无骨结节形成。一定浓度TNF-α和BMP2联合作用下的成纤维细胞,骨钙素及ALP分泌水平进一步升高;胶原分泌的时间—效应曲线发生了改变,这一过程可能存在着成纤维细胞由分泌Ⅰ型、Ⅲ型胶原转化为以分泌Ⅰ型胶原的“开关”机制;成纤维细胞由长梭形向方形或圆形演变,增殖迅速,蛋白分泌功能旺盛;细胞外基质中,具有或无周期性横纹的胶原纤丝杂乱或定向排列,与细胞一起形成重叠交织的多层结构,在其表面钙颗粒、基质小泡及分泌物集聚形成针状或方形结晶,并不断融合扩大为结节,经组织化学显示结节内含骨性成分,趋骨性荧光素证实为新生骨组织。因此,一定浓度的TNF-α和BMP2联合应用,是诱导成纤维细胞成骨表型表达的因素之一。
, 百拇医药
在体内骨折处,TNF-α、BMP2可来源于骨折碎片及早期的骨痂细胞。TNF-α和BMP2协同作用下,诱发成纤维细胞成骨表型的表达,可能与TNF-α及BMP2能激活细胞分裂与转化、活化细胞内传导途径,进而启动处于“关闭”状态的成纤维细胞成骨性标志基因、使成纤维细胞向成骨型定向分化有关,进一步的作用机理正在研究中。
4 参考文献
1 柴本甫,汤雪明,李 慧.骨折二期愈合过程中的成纤维细胞成骨作用.中华骨科杂志,1996;16(4):245
2 柴本甫,汤雪明,徐荣辉.家兔皮肤成纤维细胞的成骨潜能(组织化学及放射自显影研究).中华骨科杂志,1994;16(11):682
3 Hugens SS, Hicks DG, O'keefe RJ et al. Shared phentypic expression of osteoblasts and chondrocytes in fracture callus. J Bone Miner Res, 1995;10(4):533
, http://www.100md.com
4 Mizuno M, Shindo M, Kobayashi D et al. Osteogenesis by bone marrow stromal cell maintained on type Ⅰ collagen matrix gels in vivo. Bone, 1997;20(2):101
5 Nakahara H, Dennis JE, Bruder PS et al. In vitro differentiation of bone and hypertrophic cartilage from periosteal-derived cells. Exp Cell Res, 1991;195(3):492
6 Herr Y, Masahiro M, Lin WL et al. The origin of fibroblasts and their role in the early stages of horizontal funcation defect healing in the beagle dog. J Periodontol, 1995;66(8):716
△ 国家自然科学基金资助项目
(收稿:1997-10-29), 百拇医药