心脏缝隙连结的功能及其调节
作者:陈宝平 夏强
单位:浙江大学医学院生理学教研室(杭州 310031)
关键词:
中国心脏起搏与心电生理杂志980422 心脏的缝隙连结(Gap junction)是指心肌细胞之间及与其他类型细胞之间的连接通道,该通道具有亲水性、直径大、通透性高、低选择性、纵向阻抗低和保持开放状态的特性。缝隙连结实现细胞之间的电信号和化学信号的通讯联系,完成各细胞之间的合作与协调。近几年来,由于对这方面研究的深入,使人们对心律失常发生的机理有了更深入的理解。本文拟对这方面的进展作一简要介绍。
1 缝隙连结的结构
心肌细胞间的闰盘处具有三种特异结构,即桥粒、粘连膜和缝隙连结。其中缝隙连结处有许多连结两相邻细胞的桥样结构,在常规电镜下,缝隙连结处相邻细胞的质膜由一条宽3 nm的狭缝隔开,缝隙连结由此得名。用冷冻蚀刻、X射线衍射和生化分析等技术研究发现,缝隙连结是跨膜蛋白分子以连结子(Connexon)的结构形成的。每个连结子在冷冻蚀刻复型膜上是一个膜蛋白的颗粒,直径6~7 nm,它本身是由6个相同亚单位环绕排列组成的中空结构。当相邻细胞上的连结子互相连结时,就在两个细胞之间形成一条直径约1.5 nm水性通道,细胞内的离子和小分子物质可借此出入相邻细胞(附图)。每个连结子是由6个相同的连结蛋白(Connexin)所组成。这种连结蛋白是一个多基因家族的保守蛋白,在不同的细胞类型、组织和种族中有不同的表达。已发现的心脏缝隙连结蛋白有连结蛋白43(Connexin43,Cx43)、连结蛋白40(Cx40)、连结蛋白45(Cx45) 、连结蛋白46(Cx46)和连结蛋白37(Cx37),其中Cx43是心脏中最丰富的连结蛋白[1]。Kanter等[2]运用PCR(Polymerase chain reaction)及基因克隆技术排列出人的Cx43、Cx40和Cx45的氨基酸序列及其基因的核苷酸序列,Cx43由382个氨基酸组成,Cx40含有358个氨基酸,而Cx45则含有396个氨基酸。由Cx43构成的缝隙连结即Cx43缝隙连结(Connexin43 gap junction)在正常成人心室肌层大多局限于闰盘周围,呈戒指状,而闰盘中心缝隙连结较少;而在新生儿心肌层Cx43缝隙连结呈点状分布于心肌细胞的整个细胞膜表面,随着年龄的增长,Cx43缝隙连结逐渐极性化,向成熟的闰盘靠近,大约于6岁时其分布接近于正常成人[3]。另外,除了心肌细胞间头尾端相接处分布较多缝隙连结外,心肌细胞间侧面相接处也有缝隙连结分布,其分布多少则依各组织的功能而定,如心房肌侧面分布较少,而心室肌侧面分布则较多。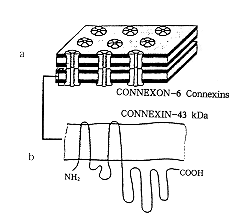
, http://www.100md.com
附图 缝隙连结的模式图 a.缝隙连结由一簇通道组成,每个通道由一对分别位于相邻两细胞膜上的连结子组成,每个连结子由6个相同的连结蛋白构成。b.Cx43的4个跨膜区域,其氨基端及羧基端位于膜的胞浆侧
2 缝隙连结各连结蛋白的心脏分布
用单克隆抗体技术对人窦房结、房室结、His束及其分支、心房及左右心室壁进行研究发现,Cx43、Cx40和Cx45在心脏有着相对丰富的分布,且人心脏的缝隙连结蛋白的分布与动物的有所不同。窦房结的缝隙连结较小且较稀疏,含有少量的Cx45和Cx40,但不含Cx43。房室结的缝隙连结也较小,主要含有Cx45和Cx40,含有少量的Cx43。心房肌细胞的缝隙连结要比窦房结和房室结的大些,含有中等量的Cx40、Cx43和Cx45。His束的缝隙连结是最大的,含有丰富的Cx40、Cx43和Cx45。心室肌细胞的缝隙连结主要含有Cx43和Cx45,但在心内膜下层的肌细胞和小、中型的室壁内冠状动脉的内皮细胞可见少量的Cx40。在心房或心室的肌细胞中偶尔可发现微量的Cx37和Cx46。可见,各种缝隙连结连结蛋白在人心脏的不同区域分布不同,而且其数量也存在着很大差异;这些差异可能在调节心脏传导速度方面起着重要的作用[1,4]。
, 百拇医药
3 缝隙连结的生物学特性
早在1964年,有人发现较大的亲水性分子荧光素(分子量为330道尔顿)能通过连结膜,表明缝隙连结是一个口径较大和低选择性的水性通道。后来发现在哺乳类心肌细胞中,荧光染料若丹明(分子量859道尔顿)的扩散速率很低,可预测缝隙连结直径大约为1.6 nm。
缝隙连结具有一定的离子选择通透性。在几种哺乳类动物心肌细胞的连结膜处,带负电荷的荧光物质(如氨基荧光素)的通透性低于分子量相同但不带电荷的物质,这表明缝隙连结可能带有固定的负电荷。与离子通道相比,缝隙连结对离子有着较低的选择性,但对各碱性离子又表现出某种选择通透梯度(Cs+>Rb+>K+>Na+>Li+) 。
最近的研究显示,单个心肌细胞能表达多种连结蛋白,由不同的连结蛋白组成的缝隙连结有着不同的生物学特性。例如,由Cx40组成的通道比Cx43组成的通道有更高的电导[5]。窦房结、房室结、传导通路、心房及心室肌等组织表达不同的连结蛋白,各组织主要表达何种连结蛋白依其功能而定,如传导通路表达Cx40较多,主要是利于其快速传导[6]。
, 百拇医药
Lau等[7]发现,Cx43是一种磷蛋白,通过其磷酸化或去磷酸化可改变该缝隙连结的电导值,从而影响细胞间通讯。另外,Cx43缝隙连结还受到许多因素的影响,如温度、跨缝隙连结电压、胞内Ca2+浓度、胞内pH值及成纤维细胞生长因子-2(Fibroblast growth factor-2,FGF-2)等。
4 缝隙连结的功能
缝隙连结的主要功能是介导细胞之间电和化学信号的传递。缝隙连结的分布、数量和各连结蛋白表达的区域性变化都有助于形成正常心肌层冲动扩布的各向异性和心房、心室规则的收缩和舒张。Cx40主要表达于特殊传导系统的心肌细胞中,有助于冲动在特殊传导系统内的快速传导,以实现冲动在心脏中的快速扩布[8]。缝隙连结细胞通讯对细胞内Ca2+浓度的同步波动也起着很重要作用,而后者有助于心肌收缩和舒张的同步化,从而有利于心脏的泵血功能。
, 百拇医药
在心房肌纤维(如界嵴)中,电信号的传导很快,并且是高度各向异性的。左室肌层纵向与横向传导速度之比是3∶1,而心房界嵴处纵向与横向传导速度之比约为10∶1。超微结构分析显示,一个典型的左室肌细胞大约与12个其他肌细胞相接触,并且头尾端相接处与侧面相接处的缝隙连结数量相当;而心房界嵴处的一个肌细胞仅同大约7个其他肌细胞相接触,并且头尾端相接处的缝隙连结几乎占该细胞总缝隙连结数量的80%。与左室肌细胞相比,心房界嵴处肌细胞的缝隙连结的这种分布限制了侧面相邻细胞间电信号的传导,从而加强了传导速度在纵横向上的各向异性[9]。
此外,缝隙连结在组织的稳定性、生长控制及其分化等方面也都起着重要作用。在胚胎发育过程中,缝隙连结介导的细胞通讯显得尤为重要。当胚胎发育到一定阶段,一部分细胞与另一部分细胞失去偶合,开始向各自的特定方向发展;而同一部分的细胞则保持互相偶合,以协调的方式循同一方向发展,表现出整体性。另外,缝隙连结在细胞间可传递正常生长调节信号。Rose等〔10〕将大鼠心脏表达Cx43的α1基因转导到致瘤的小鼠MCA-10细胞中,α1基因被并入该细胞基因组后,外来基因表达并形成了功能性通道,并进行正常的生长调节,细胞通讯增加,抑制了肿瘤的发生。缝隙连结还具有保护功能,当某些心肌细胞受损并产生伤害性电流时,缝隙连结受到诸多因素的影响而自动关闭,从而保护了邻近的正常肌细胞。
, 百拇医药
5 病理情况下缝隙连结的变化
缝隙连结的性质是心肌传导性的决定性因素,缝隙连结的空间分布及数量的紊乱可引起冲动扩布异常,导致心律失常趋势,并引起缺血性或肥大性心肌机械收缩功能的缺失。
缺血性心脏病人,离梗死区较远的心肌中Cx43的空间分布仍属正常,但每个细胞Cx43的含量下降30%,每个细胞单位容积Cx43的含量下降47%。心肌肥厚病人每个肥大肌细胞Cx43的含量不发生明显变化,但是单位细胞容积含量则下降40%[3,11]。
与心肌梗死的疤痕区域相接触的心肌组织中,Cx43空间分布出现紊乱,在已退变但仍存活的心肌细胞中Cx43沿着其侧面纵向点缀状排列,这可能是原已存在的缝隙连结重新分布的结果。这种变化在夹闭犬冠状动脉4天后即可出现[3]。近来有文献报道,犬心外膜梗死区的边缘区域Cx43缝隙连结的紊乱与在该处形成的折返环路有关,并导致室性心动过速[12]。
, 百拇医药
对恰加斯氏病的患者进行研究发现,感染的心肌细胞Cx43的总含量虽然没有明显变化,但Cx43的侧面分布则大为减少,甚至难以观察到。这种Cx43分布的变化可能与该病的心脏传导紊乱及心脏收缩不协调有关[13]。
在豚鼠心肌对肾血管性高血压发生肥大性反应的早期,心肌细胞内Cx43表达增高,每个细胞Cx43含量增加45%,而单位容积Cx43的含量增加30%。这种变化与在人慢性肥厚的心室肌中所观察的结果相反,其原因仍不清楚[3]。
6 缝隙连结的调节
缝隙连结由于其口径大、低选择性、开放稳定性及协作的双细胞结构而被认为是非通常意义上的离子通道。所有心肌细胞通过缝隙连结而被连结起来,其结果有两面性:一方面,通过缝隙连结,细胞之间电和化学信号的传递使多细胞组织发挥统一的组织功能;另一方面,如果一个细胞受损,则会损害到其他细胞,除非存在某种在异常情况下自动关闭细胞间通讯的机制。在异常情况下的关闭机制目前仍不很清楚。可是,在生理和病理生理状态下,可能有几种因素参与该机制,这些因素可能包括跨缝隙连结电压、pH值、胞内Ca2+浓度及FGF-2等。
, http://www.100md.com
双电压钳制术的研究发现有正常连结的新生大鼠心肌细胞连结膜电导与温度呈正相关。当温度从37 °C降至14 °C,连结膜电导呈陡性下降(温度系数=1.43),温度从14 °C降至-2 °C时膜电导缓慢下降(温度系数=1.14)。这两种温度系数的存在提示膜电导的控制可能与酶反应有关[14]。
缝隙连结细胞通讯受pH值变化的调节,这种调节在缺血性心脏组织中起着重要作用。研究者应用双电压钳制术比较了由Cx43和Cx45组成的缝隙连结对pH值的敏感性。pH值=6.7时,Cx45缝隙连结的电导下降至对照组(pH值=7.0)的20%;pH值=6.3时,所有通道关闭。Cx43缝隙连结的电导在pH值=6.7时,约为对照组的70%;在pH值=6.3时,约为对照组的40%;在pH值=5.8时,所有通道关闭。对单个通道的电导而言,pH值=7.0时,Cx45和Cx43缝隙连结的电导分别是7.8 ps和40.8 ps,这两者的电导在低pH值时并不发生显著性变化。表明在低pH值时,宏观电导的下降不是因为单通道电导下降造成的,而是因为缝隙连结开放率下降所致[15]。近来对胞内酸化引起缝隙连结关闭的分子机制的研究发现,切除Cx43的羧基端(Carboxyl terminal,简称CT)125个氨基酸并不影响其功能通道的形成,但会使Cx43通道pH值依赖性关闭受到影响。CT能与其受体相互作用,甚至在CT端125个氨基酸被切除后该作用仍然存在。所以研究者提出颗粒-受体模式(Particle-receptor model)来解释Cx43通道对pH值依赖性关闭的机制。所谓颗粒就是指CT(羧基端125个氨基酸,其中氨基酸261-399及374-382的作用尤其重要),而其受体则是Cx43通道本身的一部分(可能是Cx43的胞内环部分),当pH值下降到一定值时,CT就与其受体结合,堵住Cx43通道使其关闭[16]。
, http://www.100md.com
二价阳离子对缝隙连结的电导也有影响。应用双电压钳制术及微电极技术对乳鼠及成年大鼠的心肌细胞的研究发现,当微电极内溶液的Ca2+浓度下降,电导出现剂量依从性下降。如果Ca2+和pH值同时下降,则电导下降更为明显。当电极内溶液含有Mg2+、Ba2+时,电导则未出现明显下降,当电极中含有Sr2+(5 mM),部分通道关闭。可见,大鼠心肌细胞的电导显示出不同的离子敏感性[17]。
所有哺乳类动物缝隙连结对跨缝隙连结电压都是敏感的。应用电压钳制术对Cx43缝隙连结进行研究显示,其电导值在跨缝隙连结电压低于-50 mV及高于50 mV时均下降。可是,在较大的跨缝隙连结电压下,Cx43缝隙连结仍有一定的电导存在。对某种缝隙连结通道而言,其对特定刺激发生反应而引起通道关闭的过程是分级性的,而不是“全或无”式的。
当Cx43转导并表达于SKHepl细胞中,其组成的通道在CsCl作为主要电流载体离子并在中度的跨缝隙连结电压(<60 mV)下呈现出两种不同的电导值:一种电导是60~70 ps,另一种是90~100 ps。培养大鼠心肌细胞中大部分通道的电导是60~70 ps。通过微电极将碱性磷酸酶注入该SKHepl细胞,则其通道由低电导(60~70 ps)向高电导(90~100 ps)转变,并导致Cx43丝氨酸残基上磷酸化的减少。在SKHepl细胞中表达的Cx43显示出多个电泳泳动度(大约41~45 KD),当对来自这些细胞的Cx43用碱性磷酸酶处理可将其分解成单一的41 KD类,并可产生较大电导的通道。所以Cx43缝隙连结的电导值的改变是同该蛋白的磷酸化相一致的,即磷酸化后其电导减小,去磷酸化则电导增大[18]。近来有文献报道,当细胞进入有丝分裂期,分裂素激酶作用于Cx43,使其第255、279及282位上的丝氨酸发生磷酸化,Cx43缝隙连结的电导下降,通透性减小,从而相邻细胞的缝隙连结通讯联系下调,有助于细胞的有丝分裂[19]。
, 百拇医药
缝隙连结分布的紊乱和心脏中Cx43含量的下降可能在缺血性心脏病及心肌梗死心律失常的发生上起了重要作用,故认为增加细胞间缝隙连结的电导可能减少心律失常的发生。近来有文献报道,合成的抗心律失常肽(Antiarrhythmic peptide,简称AAP10,分子式为Gly-ALa-Gly-4Hyp-Pro-Tyr-CONH2)在局部缺血的模型上具有抗心律失常作用。作者通过测量豚鼠乳头肌刺激反应间期(Stimulus-response-interval,SRI)发现,高浓度的AAP10在正常供氧状态下能缩短SRI大约10%,低浓度AAP10(10 nM)对SRI则没有影响,但能阻止低氧、含葡萄糖的台氏液灌注引发的SRI的上升。双电压钳制术试验证实了AAP10能与心脏的缝隙连结相互作用,10 nM的AAP10能减小缝隙连结电导的下降幅度,甚或倒转。在对照组,缝隙连结电导以-2.5±2.0 ns/min的速率下降,在用了10 nM AAP10后,缝隙连结电导则以1.0±0.7 ns/min的速率上升,在去除AAP10后,缝隙连结电导又以与对照组相似的速率下降。结果提示,AAP10能与缝隙连结相互作用,并且这种作用是AAP10抗心律失常作用的基础[20]。已发现了几种与AAP10作用相反即能降低缝隙连结电导的药物,如用于治疗乳腺癌的抗雌激素药克罗米芬和Tamoxifen,还有庚醇、佛波醇二酯及FGF-2等。筛选能增加缝隙连结电导的药物可能为寻找新一代抗心律失常药提供又一途径。
, http://www.100md.com
FGF-2是一种内源性生长促进蛋白。有人认为FGF-2也参与心脏对损伤的短期和长期反应。有研究者用培养的新生大鼠心肌细胞研究FGF-2对缝隙连结介导的代谢偶联(Metabolic coupling)的短期影响,发现FGF-2可下调缝隙连结的代谢偶联,蛋白激酶抑制剂Genistein可阻断FGF-2的这种作用。在半小时内,FGF-2对Cx43的表达和分布没有影响,FGF-2可促进Cx43的磷酸化,这些磷酸化是在丝氨酸残基上进行的[21],这同前述Cx43的磷酸化可下调其电导是一致的。
参考文献
1 Davis LM,Rodefeld ME,Green K,et al.Gap junction protein phenotypes of the human heart and conduction system.J Cardiovasc Electrophysiol,1995,6(10 pt1):813
, 百拇医药
2 Kanter HL,Saffitz JE,Beyer EC.Molecular cloning of two human cardiac gap junction proteins,connexin40 and connexin45.J Mol Cell Cardiol,1994,26(7);861
3 Peters NS.New insights into myocardial arrhythmogenesis: distribution of gap-junctional coupling in normal,ischaemic and hypertrophied hearts.Clin Sci Colch,1996,90(6):447
4 Verheule S,Van Kempen MJ,Te Welscher PH,et al.Characterization of gap junction channels in adult rabbit atrial and ventricular myocardium.Circ Res,1997,80(5):673
, 百拇医药
5 De Maziere A,Analbers L,Jongsma HJ,et al.Immunoelectron microscopic visualization of the gap junction protein connexin40 in the mammalian heart.Eur J Morphol,1993,31(1-2):51
6 Saffitz JE,Davis LM,Darrow BJ,et al.The molecular basis of anisotropy: role of gap junctions.J Cardiovasc Electrophysiol,1995,6(6):498
7 Lau AF,Hatch Pigott V,Crow DS.Evidence that heart connexin43 is a phosphoprotein.J Mol Cell Cardiol,1991,23 (6):659
, 百拇医药
8 Severs NJ.Cardiac muscle cell interaction: from microanatomy to the molecular make-up of the gap junction.Histol Histopathol,1995,10(2):481
9 Saffitz JE,Kanter HL,Green KG,et al.Tissue-specific determinants of anisotropic conduction velocity in canine atrial and ventricular myocardium.Circ Res,1994,74(6):1 065
10 Rose B,Mehta PP,Loewenstein WR.Gap-junction protein gene suppresses tumorigenicity.Carcinogenesis,1993,14(5);1 073
, 百拇医药
11 Severs NJ.Gap junction alterations in the failing heart.Eur Heart J,1994,15(Suppl D):53
12 Peters NS,Coromilas J,Severs NJ,et al.Disturbed connexin43 gap junction distribution correlates with the location of reentrant circuits in the epicardial border zone of healing canine infarcts that cause ventricular tachycardia.Circulation,1997,95(4):988
13 De Carvalho AC,Masuda MO,Tanowitz HB,et al.Conduction defects and arrhythmias in Chagas' disease: possible role of gap junctions and humoral mechanisms.J Cardiovasc Electrophysiol,1994,5(8):686
, 百拇医药
14 Bukauskas FF,Weingart R.Temperature dependence of gap junction properties in neonatal rat heart cells.Pflugers Arch,1993,423(1-2):133
15 Hermans MM,Kortekaas P,Jongsma HJ,et al.pH sensitivity of the cardiac gap junction proteins,connexin45 and 43.Pflugers Arch,1995,431(1):138
16 Morley GE,Ek Vitor JF,Taffet SM,et al.Structure of connexin43 and its regulation by pHi.J Cardiovasc Electrophysiol,1997,8(8):939
, 百拇医药
17 Firek L,Weingart R.Modification of gap junction conductance by divalent cations and protons in neonatal rat heart cells.J Mol Cell Cardiol,1995,27(8):1 633
18 Moreno AP,Saez JC,Fishman GI,et al.Human connexin43 gap junction channel regulation of unitary conductances by phosphorylation.Circ Res,1994,76(6):1 050
19 Warn Cramer BJ,Cottrell GT,Burt JM,et al.Regulation of connexin-43 gap junctional intercellular communication by mitogen-activated protein kinase.J Biol Chem,1998,273(15):9 188
, 百拇医药
20 Mler A,Schaefer T,Linke W,et al.Actions of the antiarrhythmic peptide AAP10 on intecellular coupling.Naunyn Schiedebergs Arch Pharmacol,1997,356(1):76
21 Doble BW,Chen Y,Bosc DG,et al.Fibroblast growth factor-2 decreases metabolic coupling and stimulates phosphorylation as well as masking of connexin43 epitopes in cardiac myocytes.Circ Res,1996,79(4):647
(1998-04-14收稿), 百拇医药
单位:浙江大学医学院生理学教研室(杭州 310031)
关键词:
中国心脏起搏与心电生理杂志980422 心脏的缝隙连结(Gap junction)是指心肌细胞之间及与其他类型细胞之间的连接通道,该通道具有亲水性、直径大、通透性高、低选择性、纵向阻抗低和保持开放状态的特性。缝隙连结实现细胞之间的电信号和化学信号的通讯联系,完成各细胞之间的合作与协调。近几年来,由于对这方面研究的深入,使人们对心律失常发生的机理有了更深入的理解。本文拟对这方面的进展作一简要介绍。
1 缝隙连结的结构
心肌细胞间的闰盘处具有三种特异结构,即桥粒、粘连膜和缝隙连结。其中缝隙连结处有许多连结两相邻细胞的桥样结构,在常规电镜下,缝隙连结处相邻细胞的质膜由一条宽3 nm的狭缝隔开,缝隙连结由此得名。用冷冻蚀刻、X射线衍射和生化分析等技术研究发现,缝隙连结是跨膜蛋白分子以连结子(Connexon)的结构形成的。每个连结子在冷冻蚀刻复型膜上是一个膜蛋白的颗粒,直径6~7 nm,它本身是由6个相同亚单位环绕排列组成的中空结构。当相邻细胞上的连结子互相连结时,就在两个细胞之间形成一条直径约1.5 nm水性通道,细胞内的离子和小分子物质可借此出入相邻细胞(附图)。每个连结子是由6个相同的连结蛋白(Connexin)所组成。这种连结蛋白是一个多基因家族的保守蛋白,在不同的细胞类型、组织和种族中有不同的表达。已发现的心脏缝隙连结蛋白有连结蛋白43(Connexin43,Cx43)、连结蛋白40(Cx40)、连结蛋白45(Cx45) 、连结蛋白46(Cx46)和连结蛋白37(Cx37),其中Cx43是心脏中最丰富的连结蛋白[1]。Kanter等[2]运用PCR(Polymerase chain reaction)及基因克隆技术排列出人的Cx43、Cx40和Cx45的氨基酸序列及其基因的核苷酸序列,Cx43由382个氨基酸组成,Cx40含有358个氨基酸,而Cx45则含有396个氨基酸。由Cx43构成的缝隙连结即Cx43缝隙连结(Connexin43 gap junction)在正常成人心室肌层大多局限于闰盘周围,呈戒指状,而闰盘中心缝隙连结较少;而在新生儿心肌层Cx43缝隙连结呈点状分布于心肌细胞的整个细胞膜表面,随着年龄的增长,Cx43缝隙连结逐渐极性化,向成熟的闰盘靠近,大约于6岁时其分布接近于正常成人[3]。另外,除了心肌细胞间头尾端相接处分布较多缝隙连结外,心肌细胞间侧面相接处也有缝隙连结分布,其分布多少则依各组织的功能而定,如心房肌侧面分布较少,而心室肌侧面分布则较多。

, http://www.100md.com
附图 缝隙连结的模式图 a.缝隙连结由一簇通道组成,每个通道由一对分别位于相邻两细胞膜上的连结子组成,每个连结子由6个相同的连结蛋白构成。b.Cx43的4个跨膜区域,其氨基端及羧基端位于膜的胞浆侧
2 缝隙连结各连结蛋白的心脏分布
用单克隆抗体技术对人窦房结、房室结、His束及其分支、心房及左右心室壁进行研究发现,Cx43、Cx40和Cx45在心脏有着相对丰富的分布,且人心脏的缝隙连结蛋白的分布与动物的有所不同。窦房结的缝隙连结较小且较稀疏,含有少量的Cx45和Cx40,但不含Cx43。房室结的缝隙连结也较小,主要含有Cx45和Cx40,含有少量的Cx43。心房肌细胞的缝隙连结要比窦房结和房室结的大些,含有中等量的Cx40、Cx43和Cx45。His束的缝隙连结是最大的,含有丰富的Cx40、Cx43和Cx45。心室肌细胞的缝隙连结主要含有Cx43和Cx45,但在心内膜下层的肌细胞和小、中型的室壁内冠状动脉的内皮细胞可见少量的Cx40。在心房或心室的肌细胞中偶尔可发现微量的Cx37和Cx46。可见,各种缝隙连结连结蛋白在人心脏的不同区域分布不同,而且其数量也存在着很大差异;这些差异可能在调节心脏传导速度方面起着重要的作用[1,4]。
, 百拇医药
3 缝隙连结的生物学特性
早在1964年,有人发现较大的亲水性分子荧光素(分子量为330道尔顿)能通过连结膜,表明缝隙连结是一个口径较大和低选择性的水性通道。后来发现在哺乳类心肌细胞中,荧光染料若丹明(分子量859道尔顿)的扩散速率很低,可预测缝隙连结直径大约为1.6 nm。
缝隙连结具有一定的离子选择通透性。在几种哺乳类动物心肌细胞的连结膜处,带负电荷的荧光物质(如氨基荧光素)的通透性低于分子量相同但不带电荷的物质,这表明缝隙连结可能带有固定的负电荷。与离子通道相比,缝隙连结对离子有着较低的选择性,但对各碱性离子又表现出某种选择通透梯度(Cs+>Rb+>K+>Na+>Li+) 。
最近的研究显示,单个心肌细胞能表达多种连结蛋白,由不同的连结蛋白组成的缝隙连结有着不同的生物学特性。例如,由Cx40组成的通道比Cx43组成的通道有更高的电导[5]。窦房结、房室结、传导通路、心房及心室肌等组织表达不同的连结蛋白,各组织主要表达何种连结蛋白依其功能而定,如传导通路表达Cx40较多,主要是利于其快速传导[6]。
, 百拇医药
Lau等[7]发现,Cx43是一种磷蛋白,通过其磷酸化或去磷酸化可改变该缝隙连结的电导值,从而影响细胞间通讯。另外,Cx43缝隙连结还受到许多因素的影响,如温度、跨缝隙连结电压、胞内Ca2+浓度、胞内pH值及成纤维细胞生长因子-2(Fibroblast growth factor-2,FGF-2)等。
4 缝隙连结的功能
缝隙连结的主要功能是介导细胞之间电和化学信号的传递。缝隙连结的分布、数量和各连结蛋白表达的区域性变化都有助于形成正常心肌层冲动扩布的各向异性和心房、心室规则的收缩和舒张。Cx40主要表达于特殊传导系统的心肌细胞中,有助于冲动在特殊传导系统内的快速传导,以实现冲动在心脏中的快速扩布[8]。缝隙连结细胞通讯对细胞内Ca2+浓度的同步波动也起着很重要作用,而后者有助于心肌收缩和舒张的同步化,从而有利于心脏的泵血功能。
, 百拇医药
在心房肌纤维(如界嵴)中,电信号的传导很快,并且是高度各向异性的。左室肌层纵向与横向传导速度之比是3∶1,而心房界嵴处纵向与横向传导速度之比约为10∶1。超微结构分析显示,一个典型的左室肌细胞大约与12个其他肌细胞相接触,并且头尾端相接处与侧面相接处的缝隙连结数量相当;而心房界嵴处的一个肌细胞仅同大约7个其他肌细胞相接触,并且头尾端相接处的缝隙连结几乎占该细胞总缝隙连结数量的80%。与左室肌细胞相比,心房界嵴处肌细胞的缝隙连结的这种分布限制了侧面相邻细胞间电信号的传导,从而加强了传导速度在纵横向上的各向异性[9]。
此外,缝隙连结在组织的稳定性、生长控制及其分化等方面也都起着重要作用。在胚胎发育过程中,缝隙连结介导的细胞通讯显得尤为重要。当胚胎发育到一定阶段,一部分细胞与另一部分细胞失去偶合,开始向各自的特定方向发展;而同一部分的细胞则保持互相偶合,以协调的方式循同一方向发展,表现出整体性。另外,缝隙连结在细胞间可传递正常生长调节信号。Rose等〔10〕将大鼠心脏表达Cx43的α1基因转导到致瘤的小鼠MCA-10细胞中,α1基因被并入该细胞基因组后,外来基因表达并形成了功能性通道,并进行正常的生长调节,细胞通讯增加,抑制了肿瘤的发生。缝隙连结还具有保护功能,当某些心肌细胞受损并产生伤害性电流时,缝隙连结受到诸多因素的影响而自动关闭,从而保护了邻近的正常肌细胞。
, 百拇医药
5 病理情况下缝隙连结的变化
缝隙连结的性质是心肌传导性的决定性因素,缝隙连结的空间分布及数量的紊乱可引起冲动扩布异常,导致心律失常趋势,并引起缺血性或肥大性心肌机械收缩功能的缺失。
缺血性心脏病人,离梗死区较远的心肌中Cx43的空间分布仍属正常,但每个细胞Cx43的含量下降30%,每个细胞单位容积Cx43的含量下降47%。心肌肥厚病人每个肥大肌细胞Cx43的含量不发生明显变化,但是单位细胞容积含量则下降40%[3,11]。
与心肌梗死的疤痕区域相接触的心肌组织中,Cx43空间分布出现紊乱,在已退变但仍存活的心肌细胞中Cx43沿着其侧面纵向点缀状排列,这可能是原已存在的缝隙连结重新分布的结果。这种变化在夹闭犬冠状动脉4天后即可出现[3]。近来有文献报道,犬心外膜梗死区的边缘区域Cx43缝隙连结的紊乱与在该处形成的折返环路有关,并导致室性心动过速[12]。
, 百拇医药
对恰加斯氏病的患者进行研究发现,感染的心肌细胞Cx43的总含量虽然没有明显变化,但Cx43的侧面分布则大为减少,甚至难以观察到。这种Cx43分布的变化可能与该病的心脏传导紊乱及心脏收缩不协调有关[13]。
在豚鼠心肌对肾血管性高血压发生肥大性反应的早期,心肌细胞内Cx43表达增高,每个细胞Cx43含量增加45%,而单位容积Cx43的含量增加30%。这种变化与在人慢性肥厚的心室肌中所观察的结果相反,其原因仍不清楚[3]。
6 缝隙连结的调节
缝隙连结由于其口径大、低选择性、开放稳定性及协作的双细胞结构而被认为是非通常意义上的离子通道。所有心肌细胞通过缝隙连结而被连结起来,其结果有两面性:一方面,通过缝隙连结,细胞之间电和化学信号的传递使多细胞组织发挥统一的组织功能;另一方面,如果一个细胞受损,则会损害到其他细胞,除非存在某种在异常情况下自动关闭细胞间通讯的机制。在异常情况下的关闭机制目前仍不很清楚。可是,在生理和病理生理状态下,可能有几种因素参与该机制,这些因素可能包括跨缝隙连结电压、pH值、胞内Ca2+浓度及FGF-2等。
, http://www.100md.com
双电压钳制术的研究发现有正常连结的新生大鼠心肌细胞连结膜电导与温度呈正相关。当温度从37 °C降至14 °C,连结膜电导呈陡性下降(温度系数=1.43),温度从14 °C降至-2 °C时膜电导缓慢下降(温度系数=1.14)。这两种温度系数的存在提示膜电导的控制可能与酶反应有关[14]。
缝隙连结细胞通讯受pH值变化的调节,这种调节在缺血性心脏组织中起着重要作用。研究者应用双电压钳制术比较了由Cx43和Cx45组成的缝隙连结对pH值的敏感性。pH值=6.7时,Cx45缝隙连结的电导下降至对照组(pH值=7.0)的20%;pH值=6.3时,所有通道关闭。Cx43缝隙连结的电导在pH值=6.7时,约为对照组的70%;在pH值=6.3时,约为对照组的40%;在pH值=5.8时,所有通道关闭。对单个通道的电导而言,pH值=7.0时,Cx45和Cx43缝隙连结的电导分别是7.8 ps和40.8 ps,这两者的电导在低pH值时并不发生显著性变化。表明在低pH值时,宏观电导的下降不是因为单通道电导下降造成的,而是因为缝隙连结开放率下降所致[15]。近来对胞内酸化引起缝隙连结关闭的分子机制的研究发现,切除Cx43的羧基端(Carboxyl terminal,简称CT)125个氨基酸并不影响其功能通道的形成,但会使Cx43通道pH值依赖性关闭受到影响。CT能与其受体相互作用,甚至在CT端125个氨基酸被切除后该作用仍然存在。所以研究者提出颗粒-受体模式(Particle-receptor model)来解释Cx43通道对pH值依赖性关闭的机制。所谓颗粒就是指CT(羧基端125个氨基酸,其中氨基酸261-399及374-382的作用尤其重要),而其受体则是Cx43通道本身的一部分(可能是Cx43的胞内环部分),当pH值下降到一定值时,CT就与其受体结合,堵住Cx43通道使其关闭[16]。
, http://www.100md.com
二价阳离子对缝隙连结的电导也有影响。应用双电压钳制术及微电极技术对乳鼠及成年大鼠的心肌细胞的研究发现,当微电极内溶液的Ca2+浓度下降,电导出现剂量依从性下降。如果Ca2+和pH值同时下降,则电导下降更为明显。当电极内溶液含有Mg2+、Ba2+时,电导则未出现明显下降,当电极中含有Sr2+(5 mM),部分通道关闭。可见,大鼠心肌细胞的电导显示出不同的离子敏感性[17]。
所有哺乳类动物缝隙连结对跨缝隙连结电压都是敏感的。应用电压钳制术对Cx43缝隙连结进行研究显示,其电导值在跨缝隙连结电压低于-50 mV及高于50 mV时均下降。可是,在较大的跨缝隙连结电压下,Cx43缝隙连结仍有一定的电导存在。对某种缝隙连结通道而言,其对特定刺激发生反应而引起通道关闭的过程是分级性的,而不是“全或无”式的。
当Cx43转导并表达于SKHepl细胞中,其组成的通道在CsCl作为主要电流载体离子并在中度的跨缝隙连结电压(<60 mV)下呈现出两种不同的电导值:一种电导是60~70 ps,另一种是90~100 ps。培养大鼠心肌细胞中大部分通道的电导是60~70 ps。通过微电极将碱性磷酸酶注入该SKHepl细胞,则其通道由低电导(60~70 ps)向高电导(90~100 ps)转变,并导致Cx43丝氨酸残基上磷酸化的减少。在SKHepl细胞中表达的Cx43显示出多个电泳泳动度(大约41~45 KD),当对来自这些细胞的Cx43用碱性磷酸酶处理可将其分解成单一的41 KD类,并可产生较大电导的通道。所以Cx43缝隙连结的电导值的改变是同该蛋白的磷酸化相一致的,即磷酸化后其电导减小,去磷酸化则电导增大[18]。近来有文献报道,当细胞进入有丝分裂期,分裂素激酶作用于Cx43,使其第255、279及282位上的丝氨酸发生磷酸化,Cx43缝隙连结的电导下降,通透性减小,从而相邻细胞的缝隙连结通讯联系下调,有助于细胞的有丝分裂[19]。
, 百拇医药
缝隙连结分布的紊乱和心脏中Cx43含量的下降可能在缺血性心脏病及心肌梗死心律失常的发生上起了重要作用,故认为增加细胞间缝隙连结的电导可能减少心律失常的发生。近来有文献报道,合成的抗心律失常肽(Antiarrhythmic peptide,简称AAP10,分子式为Gly-ALa-Gly-4Hyp-Pro-Tyr-CONH2)在局部缺血的模型上具有抗心律失常作用。作者通过测量豚鼠乳头肌刺激反应间期(Stimulus-response-interval,SRI)发现,高浓度的AAP10在正常供氧状态下能缩短SRI大约10%,低浓度AAP10(10 nM)对SRI则没有影响,但能阻止低氧、含葡萄糖的台氏液灌注引发的SRI的上升。双电压钳制术试验证实了AAP10能与心脏的缝隙连结相互作用,10 nM的AAP10能减小缝隙连结电导的下降幅度,甚或倒转。在对照组,缝隙连结电导以-2.5±2.0 ns/min的速率下降,在用了10 nM AAP10后,缝隙连结电导则以1.0±0.7 ns/min的速率上升,在去除AAP10后,缝隙连结电导又以与对照组相似的速率下降。结果提示,AAP10能与缝隙连结相互作用,并且这种作用是AAP10抗心律失常作用的基础[20]。已发现了几种与AAP10作用相反即能降低缝隙连结电导的药物,如用于治疗乳腺癌的抗雌激素药克罗米芬和Tamoxifen,还有庚醇、佛波醇二酯及FGF-2等。筛选能增加缝隙连结电导的药物可能为寻找新一代抗心律失常药提供又一途径。
, http://www.100md.com
FGF-2是一种内源性生长促进蛋白。有人认为FGF-2也参与心脏对损伤的短期和长期反应。有研究者用培养的新生大鼠心肌细胞研究FGF-2对缝隙连结介导的代谢偶联(Metabolic coupling)的短期影响,发现FGF-2可下调缝隙连结的代谢偶联,蛋白激酶抑制剂Genistein可阻断FGF-2的这种作用。在半小时内,FGF-2对Cx43的表达和分布没有影响,FGF-2可促进Cx43的磷酸化,这些磷酸化是在丝氨酸残基上进行的[21],这同前述Cx43的磷酸化可下调其电导是一致的。
参考文献
1 Davis LM,Rodefeld ME,Green K,et al.Gap junction protein phenotypes of the human heart and conduction system.J Cardiovasc Electrophysiol,1995,6(10 pt1):813
, 百拇医药
2 Kanter HL,Saffitz JE,Beyer EC.Molecular cloning of two human cardiac gap junction proteins,connexin40 and connexin45.J Mol Cell Cardiol,1994,26(7);861
3 Peters NS.New insights into myocardial arrhythmogenesis: distribution of gap-junctional coupling in normal,ischaemic and hypertrophied hearts.Clin Sci Colch,1996,90(6):447
4 Verheule S,Van Kempen MJ,Te Welscher PH,et al.Characterization of gap junction channels in adult rabbit atrial and ventricular myocardium.Circ Res,1997,80(5):673
, 百拇医药
5 De Maziere A,Analbers L,Jongsma HJ,et al.Immunoelectron microscopic visualization of the gap junction protein connexin40 in the mammalian heart.Eur J Morphol,1993,31(1-2):51
6 Saffitz JE,Davis LM,Darrow BJ,et al.The molecular basis of anisotropy: role of gap junctions.J Cardiovasc Electrophysiol,1995,6(6):498
7 Lau AF,Hatch Pigott V,Crow DS.Evidence that heart connexin43 is a phosphoprotein.J Mol Cell Cardiol,1991,23 (6):659
, 百拇医药
8 Severs NJ.Cardiac muscle cell interaction: from microanatomy to the molecular make-up of the gap junction.Histol Histopathol,1995,10(2):481
9 Saffitz JE,Kanter HL,Green KG,et al.Tissue-specific determinants of anisotropic conduction velocity in canine atrial and ventricular myocardium.Circ Res,1994,74(6):1 065
10 Rose B,Mehta PP,Loewenstein WR.Gap-junction protein gene suppresses tumorigenicity.Carcinogenesis,1993,14(5);1 073
, 百拇医药
11 Severs NJ.Gap junction alterations in the failing heart.Eur Heart J,1994,15(Suppl D):53
12 Peters NS,Coromilas J,Severs NJ,et al.Disturbed connexin43 gap junction distribution correlates with the location of reentrant circuits in the epicardial border zone of healing canine infarcts that cause ventricular tachycardia.Circulation,1997,95(4):988
13 De Carvalho AC,Masuda MO,Tanowitz HB,et al.Conduction defects and arrhythmias in Chagas' disease: possible role of gap junctions and humoral mechanisms.J Cardiovasc Electrophysiol,1994,5(8):686
, 百拇医药
14 Bukauskas FF,Weingart R.Temperature dependence of gap junction properties in neonatal rat heart cells.Pflugers Arch,1993,423(1-2):133
15 Hermans MM,Kortekaas P,Jongsma HJ,et al.pH sensitivity of the cardiac gap junction proteins,connexin45 and 43.Pflugers Arch,1995,431(1):138
16 Morley GE,Ek Vitor JF,Taffet SM,et al.Structure of connexin43 and its regulation by pHi.J Cardiovasc Electrophysiol,1997,8(8):939
, 百拇医药
17 Firek L,Weingart R.Modification of gap junction conductance by divalent cations and protons in neonatal rat heart cells.J Mol Cell Cardiol,1995,27(8):1 633
18 Moreno AP,Saez JC,Fishman GI,et al.Human connexin43 gap junction channel regulation of unitary conductances by phosphorylation.Circ Res,1994,76(6):1 050
19 Warn Cramer BJ,Cottrell GT,Burt JM,et al.Regulation of connexin-43 gap junctional intercellular communication by mitogen-activated protein kinase.J Biol Chem,1998,273(15):9 188
, 百拇医药
20 Mler A,Schaefer T,Linke W,et al.Actions of the antiarrhythmic peptide AAP10 on intecellular coupling.Naunyn Schiedebergs Arch Pharmacol,1997,356(1):76
21 Doble BW,Chen Y,Bosc DG,et al.Fibroblast growth factor-2 decreases metabolic coupling and stimulates phosphorylation as well as masking of connexin43 epitopes in cardiac myocytes.Circ Res,1996,79(4):647
(1998-04-14收稿), 百拇医药