腺病毒载体转染大鼠颈动脉的实验研究
作者:黄志雄 郭加强 郭少先
单位:100037 北京,中国医学科学院心血管病研究所中国协和医科大学阜外心血管病医院
关键词:载体蛋白类;基因转移;支架;基因表达
中华医学杂志980724 【摘要】 目的 观察腺病毒载体转染大鼠颈动脉的有效性和外源性基因表达的时间过程。方法 用AdV5-CMV质粒(对照组)或Adv5-CMV/LacZ质粒(治疗组)转染大鼠颈动脉30分钟。术后2、7、14、28、60及90天取被转染的颈动脉,行β-半乳糖苷酶活性测定和组织化学染色。结果 对照组所有颈动脉均无β-半乳糖苷酶活性,治疗组术后2天颈动脉即有β-半乳糖苷酶的表达,7~14天为表达高峰期,28天后表达量明显减少,但可持续表达3个月之久。治疗组术后2、7、14、28、60及90天每条颈动脉均可见蓝染,其中术后7及14天每条颈动脉横切面的全周均有蓝染,血管壁内层、中层的大部分细胞被染成蓝色。对照组所有动脉均未见蓝染。结论 腺病毒载体能高效转染大鼠在体颈动脉。转染后,外源性基因的高水平表达只能维持1个月左右。
, http://www.100md.com
Gene expression in vivo mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries Huang Zhixiong, Guo Jiaqiang, Guo Shaoxian. Cardiovascular Institute and Fu Wai Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100037
【Abstract 】 Objective To observe the efficiency and time course of gene expression in vivo mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries. Methods After being soaked in high concentration of glucose solution containing Adv5-CMV (control group) or Adv5-CMV/LacZ (treatment group) for 30 minutes, soluble stents were inserted into the lumina of cut rat carotid arteries and end-to-end anastomoses were performed. On the 2nd, 7th, 14th, 28th, 60th and 90th day after surgery,the anastomotic carotid arteries of the two groups were explanted. All samples were analyzed for the presence of β-galactosidase activity and histochemical staining. Results β-galactosidase activity was not detected in the carotid arteries of the control group. Microscopic examination of sections from vessels of the control group revealed no X-gal staining. The treatment group revealed bluestaining in all anastomotic arteries and in all layers of the arterial wall explanted including the intima, media, and adventitia on the 7th, 14th day postoperatively. Conclusions Adenoviral vector could make foreign effectively transfer into rat carotid arteries in vivo. Mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries, the high level of gene expression only persisted about one month.
, http://www.100md.com
【Key words 】 Carrier proteins Gene transfer Braces Gene expression
(Natl Med J China, 1998, 78:534-536)
用可溶性支架,使Adv5-CMV/LacZ质粒转染大鼠颈动脉,通过β-半乳糖苷酶(LacZ基因的表达产物)活性测定和组织化学染色,观察腺病毒载体转染在体血管的有效性和外源性基因表达的时间过程。
材料和方法
一、材料
1.动物:Wistar雄性大鼠,体重300~350 g,中国医学科学院动物研究所提供。
2.Adv5-CMV及Adv5-CMV/LacZ质粒:北京医科大学心血管基础研究所提供。
, http://www.100md.com
3.可溶性空心小管腔吻合支架(可溶性支架):吉林省永吉县医用塑料厂生产。
二、方法
1.Adv5-CMV/LacZ质粒的构建:将CMV/LacZ的表达片段插入P353的Swal克隆部位构建成P353-CMV/LacZ质粒,然后将此质粒和Adv5病毒基因的右臂共同转染人的293细胞即产生Adv5-CMV/LacZ质粒,该病毒载体在人293细胞内繁殖、扩增至滴度为2×1012pfu/ml。
2.可溶性支架的使用方法参见文献[1]。
3.大鼠颈总动脉的缝合:将Wistar雄性大鼠随机分为对照组48只和治疗组48只。对照组:用浸有Adv5-CMV质粒的可溶性支架;治疗组:用浸有Adv5-CMV/LacZ质粒的可溶性支架。颈总动脉吻合参见文献[1]。
, 百拇医药
4.β-半乳糖苷酶活性检测:术后2、7、14、28、60及90天,分别取对照组和治疗组大鼠各3只,剪下吻合的颈总动脉。因一条血管组织太少,故以同一组缝合术后相同天数的6条血管为1份标本。每份标本称重。用Promega公司的β-半乳糖苷酶检测系统测定LacZ基因表达产物β-半乳糖苷酶的活性。
5.β-半乳糖苷酶组织化学染色:术后2、7、14、28、60及90天,分别取对照组和治疗组大鼠各5只。剪下吻合的颈总动脉。按Willard等[2]介绍的方法,对标本进行处理和组织化学染色。
结 果
一、颈动脉吻合情况
对照组和治疗组的大鼠均成活,全部吻合的颈总动脉通畅、搏动良好。
二、β-半乳糖苷酶活性测定结果
, 百拇医药
对照组术后2、7、14、28、60及90天的颈动脉均无β-半乳糖苷酶活性,治疗组术后2天颈动脉即有β-半乳糖苷酶的表达(3.9×10-3 U/g组织),7~14天为表达高峰期分别为10.1×10-3 U/g组织、8.9×10-3 U/g组织,28天后表达量明显减少为5.5×10-3 U/g组织,2个月时降为2×10-3 U/g组织;但可持续表达3个月之久。
三、β-半乳糖苷酶组织化学染色结果
治疗组术后2、7、14、28、60及90天每条颈动脉均可见蓝染,其中术后7及14天每条颈动脉横切面的全周均有蓝染,血管壁内层、中层的大部分细胞被染成蓝色。对照组所有颈动脉未见蓝染(图1~4)。
讨 论
近年来,有关心血管疾病的基因治疗研究取得了迅速的发展,其中在基因转移方法上积累了不少的实验经验。但脂质体转染法和逆转录病毒载体的转染效率均低,脂质体仅能转染0.1%的细胞[3],逆转录病毒载体的转染率仅为0.1%~1%[4]。因此,研究者们一直在寻求一种更好的方法以提高在体血管基因转移、表达的效率。腺病毒载体具有高转染性、可以转染增殖和非增殖的细胞,所能携带的外源性基因大,滴度高,染色体外复制减少了随机插入性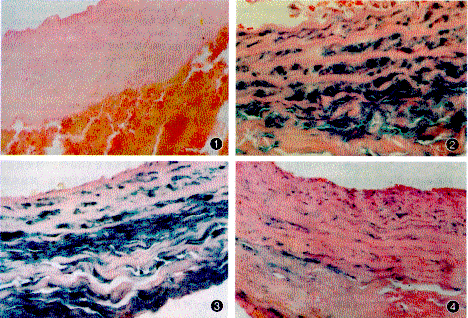
, 百拇医药
图1 对照组术后14天颈动脉组织化学染色结果 细胞未被蓝染 ×40 图2 治疗组术后7天颈动脉组织化学染色结果血管内、中层大部分细胞被染成蓝色图3、4相同 ×10 图3 治疗组术后14天颈动脉组织化学染色结果 ×40 图4 治疗组术后28天
颈动脉组织化学染色结果 ×10
突变的发生。
本研究用可溶性支架,使Adv5-CMV/LacZ质粒转染大鼠颈动脉,组织化学染色结果表明腺病毒载体能高效转染在体血管。Lee等用腺病毒载体转染气囊导管损伤后的大鼠颈动脉,术后3天,颈动脉中层即有30%的细胞被转染。
β-半乳糖苷酶活性检测结果表明:用腺病毒载体转染在体血管,转染后第2天即可测到外源性基因的表达产物,7~14天为基因表达的高峰期,28天后基因表达明显减少,但少量基因表达可持续至转染后3个月。与此相对应,颈动脉组织化学染色亦显示转染后第2天,即可见少量细胞蓝染,7~14天有大量蓝染细胞,28天后蓝染细胞显著减少,说明腺病毒载体转染在体血管后,基因的高水平表达只能维持1个月左右,这可能与下列因素有关:首先腺病毒载体不整合人靶细胞核染色体,因而插入突变的危险性大大减少。但此同一特性亦导致腺病毒不能在靶细胞内长期存在;其次宿主细胞对腺病毒晚期表达产物产生免疫反应,从而导致外源性基因表达随时间延长而减少[5]。删除病毒基因组E2和E4区或改装E3区有可能减轻宿主的免疫反应,因而延长外源性基因的高水平表达期[6]。
, http://www.100md.com
参考文献
1 黄志雄,郭加强,李晓惠,等.可溶性支架转基因的实验研究.中华外科杂志,1997,35:310-312.
2 Willard JE, Landau C, Glamann B, et al. Genetic modification of the vessel wall-comparison of surgical and catheter-based techniques for delivery of recombinant adenovirus. Circulation, 1994, 90:2190-2197.
3 Leclerc G, Gal D, Takeshita S, et al. Percutaneous arterial gene transfer in a rabbit model: efficiency in normal and balloon-dilated atherosclerotic arteries. J Clin Invest, 1992, 90:936-944.
, 百拇医药
4 Flugelman MY, Jaklitsh MT, Newman KD, et al. Low level in vivo gene transfer into the arterial wall through a perforated balloon catheter. Circulation, 1992, 85:1110-1117.
5 Yang Y, Nunes FA, Rerencsi K, et al. Cellular immunity to viral antigens limits E1-deleted adenoviruses for gene therapy. Proc Natl Acad Sci USA, 1994, 91:4407-4411.
6 Engelhardt JF, Ye X, Doranz B, et al. ablation of E2A in recombinant adenoviruses improve transgene persistence and decrease inflammatory response in mouse liver. Proc Natl Acad Sci USA, 1994, 91:6196-6200.
(收稿:1997-08-08 修回:1998-04-06), http://www.100md.com
单位:100037 北京,中国医学科学院心血管病研究所中国协和医科大学阜外心血管病医院
关键词:载体蛋白类;基因转移;支架;基因表达
中华医学杂志980724 【摘要】 目的 观察腺病毒载体转染大鼠颈动脉的有效性和外源性基因表达的时间过程。方法 用AdV5-CMV质粒(对照组)或Adv5-CMV/LacZ质粒(治疗组)转染大鼠颈动脉30分钟。术后2、7、14、28、60及90天取被转染的颈动脉,行β-半乳糖苷酶活性测定和组织化学染色。结果 对照组所有颈动脉均无β-半乳糖苷酶活性,治疗组术后2天颈动脉即有β-半乳糖苷酶的表达,7~14天为表达高峰期,28天后表达量明显减少,但可持续表达3个月之久。治疗组术后2、7、14、28、60及90天每条颈动脉均可见蓝染,其中术后7及14天每条颈动脉横切面的全周均有蓝染,血管壁内层、中层的大部分细胞被染成蓝色。对照组所有动脉均未见蓝染。结论 腺病毒载体能高效转染大鼠在体颈动脉。转染后,外源性基因的高水平表达只能维持1个月左右。
, http://www.100md.com
Gene expression in vivo mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries Huang Zhixiong, Guo Jiaqiang, Guo Shaoxian. Cardiovascular Institute and Fu Wai Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100037
【Abstract 】 Objective To observe the efficiency and time course of gene expression in vivo mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries. Methods After being soaked in high concentration of glucose solution containing Adv5-CMV (control group) or Adv5-CMV/LacZ (treatment group) for 30 minutes, soluble stents were inserted into the lumina of cut rat carotid arteries and end-to-end anastomoses were performed. On the 2nd, 7th, 14th, 28th, 60th and 90th day after surgery,the anastomotic carotid arteries of the two groups were explanted. All samples were analyzed for the presence of β-galactosidase activity and histochemical staining. Results β-galactosidase activity was not detected in the carotid arteries of the control group. Microscopic examination of sections from vessels of the control group revealed no X-gal staining. The treatment group revealed bluestaining in all anastomotic arteries and in all layers of the arterial wall explanted including the intima, media, and adventitia on the 7th, 14th day postoperatively. Conclusions Adenoviral vector could make foreign effectively transfer into rat carotid arteries in vivo. Mediated by adenoviral vector after direct gene transfer into anastomotic rat carotid arteries, the high level of gene expression only persisted about one month.
, http://www.100md.com
【Key words 】 Carrier proteins Gene transfer Braces Gene expression
(Natl Med J China, 1998, 78:534-536)
用可溶性支架,使Adv5-CMV/LacZ质粒转染大鼠颈动脉,通过β-半乳糖苷酶(LacZ基因的表达产物)活性测定和组织化学染色,观察腺病毒载体转染在体血管的有效性和外源性基因表达的时间过程。
材料和方法
一、材料
1.动物:Wistar雄性大鼠,体重300~350 g,中国医学科学院动物研究所提供。
2.Adv5-CMV及Adv5-CMV/LacZ质粒:北京医科大学心血管基础研究所提供。
, http://www.100md.com
3.可溶性空心小管腔吻合支架(可溶性支架):吉林省永吉县医用塑料厂生产。
二、方法
1.Adv5-CMV/LacZ质粒的构建:将CMV/LacZ的表达片段插入P353的Swal克隆部位构建成P353-CMV/LacZ质粒,然后将此质粒和Adv5病毒基因的右臂共同转染人的293细胞即产生Adv5-CMV/LacZ质粒,该病毒载体在人293细胞内繁殖、扩增至滴度为2×1012pfu/ml。
2.可溶性支架的使用方法参见文献[1]。
3.大鼠颈总动脉的缝合:将Wistar雄性大鼠随机分为对照组48只和治疗组48只。对照组:用浸有Adv5-CMV质粒的可溶性支架;治疗组:用浸有Adv5-CMV/LacZ质粒的可溶性支架。颈总动脉吻合参见文献[1]。
, 百拇医药
4.β-半乳糖苷酶活性检测:术后2、7、14、28、60及90天,分别取对照组和治疗组大鼠各3只,剪下吻合的颈总动脉。因一条血管组织太少,故以同一组缝合术后相同天数的6条血管为1份标本。每份标本称重。用Promega公司的β-半乳糖苷酶检测系统测定LacZ基因表达产物β-半乳糖苷酶的活性。
5.β-半乳糖苷酶组织化学染色:术后2、7、14、28、60及90天,分别取对照组和治疗组大鼠各5只。剪下吻合的颈总动脉。按Willard等[2]介绍的方法,对标本进行处理和组织化学染色。
结 果
一、颈动脉吻合情况
对照组和治疗组的大鼠均成活,全部吻合的颈总动脉通畅、搏动良好。
二、β-半乳糖苷酶活性测定结果
, 百拇医药
对照组术后2、7、14、28、60及90天的颈动脉均无β-半乳糖苷酶活性,治疗组术后2天颈动脉即有β-半乳糖苷酶的表达(3.9×10-3 U/g组织),7~14天为表达高峰期分别为10.1×10-3 U/g组织、8.9×10-3 U/g组织,28天后表达量明显减少为5.5×10-3 U/g组织,2个月时降为2×10-3 U/g组织;但可持续表达3个月之久。
三、β-半乳糖苷酶组织化学染色结果
治疗组术后2、7、14、28、60及90天每条颈动脉均可见蓝染,其中术后7及14天每条颈动脉横切面的全周均有蓝染,血管壁内层、中层的大部分细胞被染成蓝色。对照组所有颈动脉未见蓝染(图1~4)。
讨 论
近年来,有关心血管疾病的基因治疗研究取得了迅速的发展,其中在基因转移方法上积累了不少的实验经验。但脂质体转染法和逆转录病毒载体的转染效率均低,脂质体仅能转染0.1%的细胞[3],逆转录病毒载体的转染率仅为0.1%~1%[4]。因此,研究者们一直在寻求一种更好的方法以提高在体血管基因转移、表达的效率。腺病毒载体具有高转染性、可以转染增殖和非增殖的细胞,所能携带的外源性基因大,滴度高,染色体外复制减少了随机插入性

, 百拇医药
图1 对照组术后14天颈动脉组织化学染色结果 细胞未被蓝染 ×40 图2 治疗组术后7天颈动脉组织化学染色结果血管内、中层大部分细胞被染成蓝色图3、4相同 ×10 图3 治疗组术后14天颈动脉组织化学染色结果 ×40 图4 治疗组术后28天
颈动脉组织化学染色结果 ×10
突变的发生。
本研究用可溶性支架,使Adv5-CMV/LacZ质粒转染大鼠颈动脉,组织化学染色结果表明腺病毒载体能高效转染在体血管。Lee等用腺病毒载体转染气囊导管损伤后的大鼠颈动脉,术后3天,颈动脉中层即有30%的细胞被转染。
β-半乳糖苷酶活性检测结果表明:用腺病毒载体转染在体血管,转染后第2天即可测到外源性基因的表达产物,7~14天为基因表达的高峰期,28天后基因表达明显减少,但少量基因表达可持续至转染后3个月。与此相对应,颈动脉组织化学染色亦显示转染后第2天,即可见少量细胞蓝染,7~14天有大量蓝染细胞,28天后蓝染细胞显著减少,说明腺病毒载体转染在体血管后,基因的高水平表达只能维持1个月左右,这可能与下列因素有关:首先腺病毒载体不整合人靶细胞核染色体,因而插入突变的危险性大大减少。但此同一特性亦导致腺病毒不能在靶细胞内长期存在;其次宿主细胞对腺病毒晚期表达产物产生免疫反应,从而导致外源性基因表达随时间延长而减少[5]。删除病毒基因组E2和E4区或改装E3区有可能减轻宿主的免疫反应,因而延长外源性基因的高水平表达期[6]。
, http://www.100md.com
参考文献
1 黄志雄,郭加强,李晓惠,等.可溶性支架转基因的实验研究.中华外科杂志,1997,35:310-312.
2 Willard JE, Landau C, Glamann B, et al. Genetic modification of the vessel wall-comparison of surgical and catheter-based techniques for delivery of recombinant adenovirus. Circulation, 1994, 90:2190-2197.
3 Leclerc G, Gal D, Takeshita S, et al. Percutaneous arterial gene transfer in a rabbit model: efficiency in normal and balloon-dilated atherosclerotic arteries. J Clin Invest, 1992, 90:936-944.
, 百拇医药
4 Flugelman MY, Jaklitsh MT, Newman KD, et al. Low level in vivo gene transfer into the arterial wall through a perforated balloon catheter. Circulation, 1992, 85:1110-1117.
5 Yang Y, Nunes FA, Rerencsi K, et al. Cellular immunity to viral antigens limits E1-deleted adenoviruses for gene therapy. Proc Natl Acad Sci USA, 1994, 91:4407-4411.
6 Engelhardt JF, Ye X, Doranz B, et al. ablation of E2A in recombinant adenoviruses improve transgene persistence and decrease inflammatory response in mouse liver. Proc Natl Acad Sci USA, 1994, 91:6196-6200.
(收稿:1997-08-08 修回:1998-04-06), http://www.100md.com