胸腺肽α1单用及联合干扰素-α1b治疗慢性乙型肝炎疗效观察
作者:陆志檬 姚光弼 邬祥惠 高健 计焱焱 张清波
单位:陆志檬、高健 200025 上海第二医科大学附属瑞金医院;姚光弼、计焱焱 上海市静安区中心医院;邬祥惠、张清波 上海医科大学华山医院
关键词:慢性乙型肝炎;胸腺肽;干扰素
中华传染病杂志990107 【摘要】 目的 研究单用胸腺肽α1(Tα1)及联合应用干扰素(IFN)对慢性乙型肝炎(CHB)的治疗作用。方法 36例CHB患者随机分为A、B两组,A组采用Tα1和IFN联合治疗;B组单用Tα1,疗程均为6个月。结果 治疗后6月时ALT水平在A、B两组分别下降至(72.1±4.77)U/L和(73.7±37.9)U/L,较治疗前(226.7±219.4)U/L和(170.1±165.6)U/L明显下降(P=0.0027和0.0003)。HBV DNA水平在A、B两组分别下降到(130±283)mEq/ml和(373±825)mEq/ml,较治疗前(807±1222)mEq/ml和(883±1438)mEq/ml明显下降(P=0.0019和0.019)。治疗后6月时,具有ALT完全反应者,A组和B组分别为8例(44%)和9例(50%),具有HBV清除反应者A组为8例(44.4%),B组为7例(38.8%)。结论 采用Tα1或Tα1联合IFN-α1b治疗CHB均能取得较好的效果。
, http://www.100md.com
A comparative trial of thymosin-α1 vs. thymosin-α1 combined with interferon-α1b in the treatment of chronic hepatitis B
LU Zhimeng, YAO Guangbi, WU Xianghui, et al.
Ruijin Hospital, Shanghai Second Medical University, Shanghai 200025
【Abstract】 Objective To observe the efficacy and safety of Tα1 vs. Tα1 combined with IFN-α in the treatment of chronic hepatitis B. Methods Thirty-eight patients with chronic hepatitis B were randomly divided into group A and B. Patients in both groups received Tα1 for six months. However, patients in group A received IFN-α coincidently for six months. Results At the end of treatment, ALT level decreased in the patients of both group A and group B(P=0.0043 and P=0.0036, respectively), which decreased 96.6±38.3IU/L(P=0.00189) in group A and 81.93±56.39IU/L in group B respectively. HBV DNA level decreased 130±283 mEq/ml(P=0.0019) in group A and 373±825 mEq/ml in group B(P=0.019).Conclusion The Tα1 or Tα1 combined with IFN-α is efficient to treat patients with chronic hepatitis B.
, 百拇医药
【Key words】 Chronic hepatitis B Thymosin Interferon
研究表明,IFN-α1b能较有效地治疗乙型肝炎(HB),但疗效在个体间有明显差异,其ALT复常率和HBV DNA阴转率为30%~50%左右,探讨慢性乙肝(CHB)的治疗仍是广受关注的问题。胸腺肽α1(Tα1)是由28个氨基酸(aa)组成的多肽,是胸腺提取物第五组份(TF5)中的主要活性成份[1,2]。Tα1主要促使T细胞的分化及成熟[3],增加T细胞前体数量[4],使IL-2生成及IL-2高亲和力受体的表达增加,增强Th细胞的功能使机体能有效的发挥免疫防护功能[5]。基于Tα1这方面的作用,近年来采用Tα1治疗CHB已取得初步疗效[6]。本研究对Tα1和Tα1+IFN-α1b治疗CHB的疗效及不良反应作了观察,初步报告如下。
材料与方法
, 百拇医药
一、病例来源
36例CHB患者来自瑞金医院20例,华山医院8例,静安区中心医院8例。入选对象符合1995年全国传染病与寄生虫病学术会议修订的CHB诊断标准。36例患者随机分为A、B两组,每组18例,两组基本情况见表1。治疗前心电图、肾功能、白细胞和血小板均正常。这些患者近6个月内未接受过IFN-α或其它免疫调节剂治疗。
表1 36例CHB患者基本情况(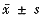 ) 组别
) 组别
疾病分级
ALT(U/L)
A(g/L)
, 百拇医药
γ-GT
HBV DNA
A组
(n=18)
CHB:5/13
226.72±
219.39
43.94±
3.65
59.18±
38.65
807.2±
1222.7
, 百拇医药
B组
(n=18)
CHB:5/13
(中/轻)
170.11±
165.56
43.39±
6.20
49.67±
29.13
882.9±
1438
P值
, 百拇医药
0.3888
0.7464
0.4060
>0.05
二、治疗方案
胸腺肽α1(Tα1,日达仙,美国赛生公司),干扰素-α1b(IFN-α1b,上海生物制品研究所)。A组(联合),Tα1 1.6mg皮下注射,一日1次,连用4天后改为1.6mg一周2次,共6个月,于Tα1应用后4天,联用IFN-α1b 3MU肌内注射,一日1次,联用10天后改为3MU,每周3次,共6个月。B组(单用)Tα1用法同A组。
三、观察指标
患者于治疗前,治疗期间每个月1次和治疗结束后3个月、6个月随访临床和生化指标。包括症状、体征和药物不良反应、ALT和A/G等。HBV病毒学指标,采用Abbott MEIA(IMX仪)检测HBV感染指标,检测时间为治疗前、治疗开始3个月、6个月,停药后6个月,采用bDNA信号扩增试验检测HBV DNA,检测时间为治疗前、治疗结束和停药后6个月。
, http://www.100md.com
四、统计方法
采用Log配对t检验。结果
一、两组治疗前后生化指标的比较
治疗后ALT复常率A、B两组分别为44%(8/18,6个月)和50%(9/ 18,6个月),治疗前后ALT水平比较,A组于6个月、12个月时平均下降了161.2±223.5和153±225(U/ L)(P=0.0001和0.0003),B组于6个月、12个月时平均下降了88.0±197.2和89.1±178.9(U/ L)。结果表明,两组治疗后ALT水平均有明显下降,见表2。两组ALT水平的动态变化表明ALT治疗3个月已下降至较低水平,6个月下降至最低水平。停药后ALT水平轻度回升,12个月又下降并接近正常水平。B组ALT水平治疗后下降较缓慢,停药后也有回升,但不如A组明显(图1)。血浆白蛋白、球蛋白和A/ G在两组中治疗前后均无明显变化。
, http://www.100md.com 表2 两组治疗前后ALT的比较(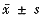 ,U/L) 组别
,U/L) 组别
治疗前
治疗后
治疗后下降
6个月
12个月
A组
226.72±219.39
65.5±34.15*
73.67±37.89*
, 百拇医药
153.06±225.02
B组
170.11±165.56
80.33±76.22
72.06±47.74
98.06±178.87
与治疗前比较:P<0.01。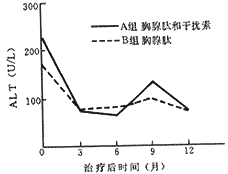
图1 A、B二组ALT水平动态变化
, http://www.100md.com 二、两组治疗前后病毒学指标比较
A、B两组治疗后HBV DNA水平均有明显下降。若以≤5mEq/ ml为病毒清除反应界限,A组病毒清除反应率分别为22.2%(4/ 18,6个月)和44.4%(8/ 18,12个月),B组为22.2%(4/ 18,6个月)和38.8%(7/ 18,12个月)。A组中HBV DNA平均下降(314.7±804.9)mEq/ ml(6个月)和(676.9±1251)mEq/ ml(12个月)(P=0.048和0.009),B组平均下降(126.1±1025)mEq/ ml(6个月)和(579.7±1256)mEq/ml(12个月)(P=0.176和0.019)。表明A、B两组治疗前后HBV DNA水平均有显著下降,且于停药后病毒水平继续下降(见表3)。
表3 两组治疗前后HBV DNA水平(mEq/ ml,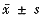 ) 组别
) 组别
, 百拇医药
治疗前
治疗后
治疗后下降
6个月
12个月
A组
807.2±1222.7
465.4±978.4
130.2±283.6**
676.97±1251
B组
882.9±1438
, 百拇医药
1009±1872
373.3±825.8*
509.72±1256
Log配对t检验与治疗前比较:*P<0.05;**P<0.01。
三、药物治疗的反应模式
动态观察ALT、HBV DNA指标,发现治疗的反应模式不一,大致可分为(1)完全反应(33.3%),治疗后ALT水平迅速下降至正常范围,病毒滴度由高水平下降至中等滴度,停药后继续下降。(2)部分反应(43%),一种表现为ALT明显下降并持续正常,但HBV DNA水平无变化,或一度降至中等水平,停药后又反跳至原来水平,也有少数患者病毒滴度明显下降,但未达到正常范围,ALT始终不正常。(3)无反应(23.7%),指ALT和HBV DNA均无明显变化。
, 百拇医药
四、不良反应
A组18例中有38%的患者于注射第一天出现发热和流感样症状,体温均未超过38°C。有1例出现典型过敏性紫癜,于注射双臀部、双下肢,躯干部见红色丘疹,逐渐增大,三天后融合成大片紫癜,但血小板计数在正常范围。立即停用IFN,继续应用Tα1,并用地塞米松治疗,5天后改为强的松,逐渐减量在2周后停用,由于一直应用Tα1,分析过敏性紫癜与IFN-α1b 有关。B组未见发热、皮疹、血白细胞或血小板减少等不良反应。
讨论
我国是HBV感染的高发病率国家,青壮年中HBsAg阳性率为8%~10%左右,随着感染时间的延长,多数开始或已经进入CHB阶段。这些可表现为肝功能的反复异常,HBsAg和HBV DNA呈阳性,另有一部分人则为感染HBeAg缺陷的变异株,虽然无HBeAg分泌,但病毒仍处于复制活跃状态[8,9]。对这些CHB患者如何提高机体免疫功能,使病毒复制活跃状态转为非复制状态,从而减轻机体清除病毒时对肝脏的损害,减轻CHB向肝纤维化,延缓肝细胞肝癌的发生进程是急需解决的问题。
, 百拇医药
IFN-α1b是治疗CHB较为有效的药物,近期疗效为50%左右,但复发率很高[7-9],因此需要寻找新的有效的药物或新的疗法以提高疗效。Tα1能促进T细胞成熟和影响免疫调节细胞的功能,近年来,Tα1开始用于CHB的治疗[6],美国二期和三期的结论不尽一致,其反应率分别为75%和25%。意大利的1b资料表明,停药后1~5个月内仍可使78%病例保持疗效。我们通过随机化和生化,病毒学定性、定量资料相结合的研究方法,对Tα1联合IFN-α1b、单用Tα1治疗CHB作出评价。比较6个月和12个月时的ALT复常率,A组与B组结果相近(44%~50%),总体治疗反应率为76.3%,表明单用Tα1或联合IFN-α1b治疗CHB均有较好的效果。初步的结果表明,两组治疗方案均能使ALT和HBV DNA水平下降,A组比B组效果为佳。值得注意的是,中国HBV感染者中HBV DNA水平处于中高水平,两组治疗后均有显著下降趋势,在B组中有8例HBV DNA下降幅度特别大,最高1例由>5 000mEq/ ml下降至<0.7mEq/ ml。这表明Tα1能提高机体免疫功能,可能有利于清除病毒。
, 百拇医药
本研究结果提示:(1)单用Tα1及联合IFN-α1b治疗CHB,以ALT和HBV DNA指标下降考核,疗效相近,A组中病毒的清除较B组有效。联合IFN-α治疗可能有一定的优点,这样既可利用Tα1提高细胞免疫功能的特点,又可利用IFN-α抑制病毒复制的双重作用达到提高疗效的目的。(2)Tα1是一个副作用较少的药物,单独治疗CHB可使ALT和HBV DNA水平下降,因此它的治疗对象较IFN更广泛,可以治疗体质较弱的患者。(3)对HBsAg携带者或免疫耐受伴HBeAg和HBV DNA阳性者,可先应用Tα1提高机体免疫功能,再采用IFN治疗,这是值得探索的问题。(4) Tα1的治疗剂量、疗程和适应证,可利用检测一项或几项免疫功能作为指导用药的辅助指标,使Tα1应用进一步合理化。
参考文献
1 Low TLK, Thurman GB, Mcadoo M, et al. The Chemistry and Biology of Thymosin. J Bio Chem, 1979,254:981-986.
, 百拇医药
2 Low TLK and Goldstein AL. The Chemistry and Biology of Thymosin. J Bio Chem, 1979, 254: 987-995.
3 Frasca D, Adorini L, Doria G. Enhanced Frequency of Mitogen-responsive T-cell Precursors in Old Mice. Eur J Immunol, 1987, 17:727-730.
4 Frasca D, Adorini L, Doria G. Enhancement of Helper and Suppressor T Cell Activities by Thymosin α1 Injection in Old Mice. Immunophar,1985,10:41-49.
5 Goso C, Frasca D and Doria G. Effect of Synthetic Thymic Humoral Factor(THF-γ2) on T Cell. Clin Exp Immunol,1992,87:346-351.
, 百拇医药
6 Mutchnick MG, Appelman HD, Chung HT, et al. Thymosin treatment of chronic hepatitis B: A placebo-controlled pilot trial. Hepatology, 1991,14:409-415.
7 Fattovich G, Farci P, Rugge M, et al. A randomized controlled trial of lymphoblastiold interferon-alpha in patients with chronic hepatitis B lacking HBeAg. Hepatology, 1992,15:584-589.
8 Pastore G, Santantonio T, Milella M, et al. Anti-Hbe-posotive chronic hepatitis B with HBV DNA in the serum response to a 6-month course of lymphoblastiold interferon. J Hepatol, 1992,14:221-225.
9 Hadziyannis S, Bramou T, Makris, et al. Interferon alpha-2b treatment of HBeAg negative/serum HBV DNA positive chronic active hepatitis type B. J Hepatol, 1990,11(suppl):133-136.
(收稿:1997-10-10 修回:1998-07-08), 百拇医药
单位:陆志檬、高健 200025 上海第二医科大学附属瑞金医院;姚光弼、计焱焱 上海市静安区中心医院;邬祥惠、张清波 上海医科大学华山医院
关键词:慢性乙型肝炎;胸腺肽;干扰素
中华传染病杂志990107 【摘要】 目的 研究单用胸腺肽α1(Tα1)及联合应用干扰素(IFN)对慢性乙型肝炎(CHB)的治疗作用。方法 36例CHB患者随机分为A、B两组,A组采用Tα1和IFN联合治疗;B组单用Tα1,疗程均为6个月。结果 治疗后6月时ALT水平在A、B两组分别下降至(72.1±4.77)U/L和(73.7±37.9)U/L,较治疗前(226.7±219.4)U/L和(170.1±165.6)U/L明显下降(P=0.0027和0.0003)。HBV DNA水平在A、B两组分别下降到(130±283)mEq/ml和(373±825)mEq/ml,较治疗前(807±1222)mEq/ml和(883±1438)mEq/ml明显下降(P=0.0019和0.019)。治疗后6月时,具有ALT完全反应者,A组和B组分别为8例(44%)和9例(50%),具有HBV清除反应者A组为8例(44.4%),B组为7例(38.8%)。结论 采用Tα1或Tα1联合IFN-α1b治疗CHB均能取得较好的效果。
, http://www.100md.com
A comparative trial of thymosin-α1 vs. thymosin-α1 combined with interferon-α1b in the treatment of chronic hepatitis B
LU Zhimeng, YAO Guangbi, WU Xianghui, et al.
Ruijin Hospital, Shanghai Second Medical University, Shanghai 200025
【Abstract】 Objective To observe the efficacy and safety of Tα1 vs. Tα1 combined with IFN-α in the treatment of chronic hepatitis B. Methods Thirty-eight patients with chronic hepatitis B were randomly divided into group A and B. Patients in both groups received Tα1 for six months. However, patients in group A received IFN-α coincidently for six months. Results At the end of treatment, ALT level decreased in the patients of both group A and group B(P=0.0043 and P=0.0036, respectively), which decreased 96.6±38.3IU/L(P=0.00189) in group A and 81.93±56.39IU/L in group B respectively. HBV DNA level decreased 130±283 mEq/ml(P=0.0019) in group A and 373±825 mEq/ml in group B(P=0.019).Conclusion The Tα1 or Tα1 combined with IFN-α is efficient to treat patients with chronic hepatitis B.
, 百拇医药
【Key words】 Chronic hepatitis B Thymosin Interferon
研究表明,IFN-α1b能较有效地治疗乙型肝炎(HB),但疗效在个体间有明显差异,其ALT复常率和HBV DNA阴转率为30%~50%左右,探讨慢性乙肝(CHB)的治疗仍是广受关注的问题。胸腺肽α1(Tα1)是由28个氨基酸(aa)组成的多肽,是胸腺提取物第五组份(TF5)中的主要活性成份[1,2]。Tα1主要促使T细胞的分化及成熟[3],增加T细胞前体数量[4],使IL-2生成及IL-2高亲和力受体的表达增加,增强Th细胞的功能使机体能有效的发挥免疫防护功能[5]。基于Tα1这方面的作用,近年来采用Tα1治疗CHB已取得初步疗效[6]。本研究对Tα1和Tα1+IFN-α1b治疗CHB的疗效及不良反应作了观察,初步报告如下。
材料与方法
, 百拇医药
一、病例来源
36例CHB患者来自瑞金医院20例,华山医院8例,静安区中心医院8例。入选对象符合1995年全国传染病与寄生虫病学术会议修订的CHB诊断标准。36例患者随机分为A、B两组,每组18例,两组基本情况见表1。治疗前心电图、肾功能、白细胞和血小板均正常。这些患者近6个月内未接受过IFN-α或其它免疫调节剂治疗。
表1 36例CHB患者基本情况(
疾病分级
ALT(U/L)
A(g/L)
, 百拇医药
γ-GT
HBV DNA
A组
(n=18)
CHB:5/13
226.72±
219.39
43.94±
3.65
59.18±
38.65
807.2±
1222.7
, 百拇医药
B组
(n=18)
CHB:5/13
(中/轻)
170.11±
165.56
43.39±
6.20
49.67±
29.13
882.9±
1438
P值
, 百拇医药
0.3888
0.7464
0.4060
>0.05
二、治疗方案
胸腺肽α1(Tα1,日达仙,美国赛生公司),干扰素-α1b(IFN-α1b,上海生物制品研究所)。A组(联合),Tα1 1.6mg皮下注射,一日1次,连用4天后改为1.6mg一周2次,共6个月,于Tα1应用后4天,联用IFN-α1b 3MU肌内注射,一日1次,联用10天后改为3MU,每周3次,共6个月。B组(单用)Tα1用法同A组。
三、观察指标
患者于治疗前,治疗期间每个月1次和治疗结束后3个月、6个月随访临床和生化指标。包括症状、体征和药物不良反应、ALT和A/G等。HBV病毒学指标,采用Abbott MEIA(IMX仪)检测HBV感染指标,检测时间为治疗前、治疗开始3个月、6个月,停药后6个月,采用bDNA信号扩增试验检测HBV DNA,检测时间为治疗前、治疗结束和停药后6个月。
, http://www.100md.com
四、统计方法
采用Log配对t检验。结果
一、两组治疗前后生化指标的比较
治疗后ALT复常率A、B两组分别为44%(8/18,6个月)和50%(9/ 18,6个月),治疗前后ALT水平比较,A组于6个月、12个月时平均下降了161.2±223.5和153±225(U/ L)(P=0.0001和0.0003),B组于6个月、12个月时平均下降了88.0±197.2和89.1±178.9(U/ L)。结果表明,两组治疗后ALT水平均有明显下降,见表2。两组ALT水平的动态变化表明ALT治疗3个月已下降至较低水平,6个月下降至最低水平。停药后ALT水平轻度回升,12个月又下降并接近正常水平。B组ALT水平治疗后下降较缓慢,停药后也有回升,但不如A组明显(图1)。血浆白蛋白、球蛋白和A/ G在两组中治疗前后均无明显变化。
, http://www.100md.com 表2 两组治疗前后ALT的比较(
治疗前
治疗后
治疗后下降
6个月
12个月
A组
226.72±219.39
65.5±34.15*
73.67±37.89*
, 百拇医药
153.06±225.02
B组
170.11±165.56
80.33±76.22
72.06±47.74
98.06±178.87
与治疗前比较:P<0.01。

图1 A、B二组ALT水平动态变化
, http://www.100md.com 二、两组治疗前后病毒学指标比较
A、B两组治疗后HBV DNA水平均有明显下降。若以≤5mEq/ ml为病毒清除反应界限,A组病毒清除反应率分别为22.2%(4/ 18,6个月)和44.4%(8/ 18,12个月),B组为22.2%(4/ 18,6个月)和38.8%(7/ 18,12个月)。A组中HBV DNA平均下降(314.7±804.9)mEq/ ml(6个月)和(676.9±1251)mEq/ ml(12个月)(P=0.048和0.009),B组平均下降(126.1±1025)mEq/ ml(6个月)和(579.7±1256)mEq/ml(12个月)(P=0.176和0.019)。表明A、B两组治疗前后HBV DNA水平均有显著下降,且于停药后病毒水平继续下降(见表3)。
表3 两组治疗前后HBV DNA水平(mEq/ ml,
, 百拇医药
治疗前
治疗后
治疗后下降
6个月
12个月
A组
807.2±1222.7
465.4±978.4
130.2±283.6**
676.97±1251
B组
882.9±1438
, 百拇医药
1009±1872
373.3±825.8*
509.72±1256
Log配对t检验与治疗前比较:*P<0.05;**P<0.01。
三、药物治疗的反应模式
动态观察ALT、HBV DNA指标,发现治疗的反应模式不一,大致可分为(1)完全反应(33.3%),治疗后ALT水平迅速下降至正常范围,病毒滴度由高水平下降至中等滴度,停药后继续下降。(2)部分反应(43%),一种表现为ALT明显下降并持续正常,但HBV DNA水平无变化,或一度降至中等水平,停药后又反跳至原来水平,也有少数患者病毒滴度明显下降,但未达到正常范围,ALT始终不正常。(3)无反应(23.7%),指ALT和HBV DNA均无明显变化。
, 百拇医药
四、不良反应
A组18例中有38%的患者于注射第一天出现发热和流感样症状,体温均未超过38°C。有1例出现典型过敏性紫癜,于注射双臀部、双下肢,躯干部见红色丘疹,逐渐增大,三天后融合成大片紫癜,但血小板计数在正常范围。立即停用IFN,继续应用Tα1,并用地塞米松治疗,5天后改为强的松,逐渐减量在2周后停用,由于一直应用Tα1,分析过敏性紫癜与IFN-α1b 有关。B组未见发热、皮疹、血白细胞或血小板减少等不良反应。
讨论
我国是HBV感染的高发病率国家,青壮年中HBsAg阳性率为8%~10%左右,随着感染时间的延长,多数开始或已经进入CHB阶段。这些可表现为肝功能的反复异常,HBsAg和HBV DNA呈阳性,另有一部分人则为感染HBeAg缺陷的变异株,虽然无HBeAg分泌,但病毒仍处于复制活跃状态[8,9]。对这些CHB患者如何提高机体免疫功能,使病毒复制活跃状态转为非复制状态,从而减轻机体清除病毒时对肝脏的损害,减轻CHB向肝纤维化,延缓肝细胞肝癌的发生进程是急需解决的问题。
, 百拇医药
IFN-α1b是治疗CHB较为有效的药物,近期疗效为50%左右,但复发率很高[7-9],因此需要寻找新的有效的药物或新的疗法以提高疗效。Tα1能促进T细胞成熟和影响免疫调节细胞的功能,近年来,Tα1开始用于CHB的治疗[6],美国二期和三期的结论不尽一致,其反应率分别为75%和25%。意大利的1b资料表明,停药后1~5个月内仍可使78%病例保持疗效。我们通过随机化和生化,病毒学定性、定量资料相结合的研究方法,对Tα1联合IFN-α1b、单用Tα1治疗CHB作出评价。比较6个月和12个月时的ALT复常率,A组与B组结果相近(44%~50%),总体治疗反应率为76.3%,表明单用Tα1或联合IFN-α1b治疗CHB均有较好的效果。初步的结果表明,两组治疗方案均能使ALT和HBV DNA水平下降,A组比B组效果为佳。值得注意的是,中国HBV感染者中HBV DNA水平处于中高水平,两组治疗后均有显著下降趋势,在B组中有8例HBV DNA下降幅度特别大,最高1例由>5 000mEq/ ml下降至<0.7mEq/ ml。这表明Tα1能提高机体免疫功能,可能有利于清除病毒。
, 百拇医药
本研究结果提示:(1)单用Tα1及联合IFN-α1b治疗CHB,以ALT和HBV DNA指标下降考核,疗效相近,A组中病毒的清除较B组有效。联合IFN-α治疗可能有一定的优点,这样既可利用Tα1提高细胞免疫功能的特点,又可利用IFN-α抑制病毒复制的双重作用达到提高疗效的目的。(2)Tα1是一个副作用较少的药物,单独治疗CHB可使ALT和HBV DNA水平下降,因此它的治疗对象较IFN更广泛,可以治疗体质较弱的患者。(3)对HBsAg携带者或免疫耐受伴HBeAg和HBV DNA阳性者,可先应用Tα1提高机体免疫功能,再采用IFN治疗,这是值得探索的问题。(4) Tα1的治疗剂量、疗程和适应证,可利用检测一项或几项免疫功能作为指导用药的辅助指标,使Tα1应用进一步合理化。
参考文献
1 Low TLK, Thurman GB, Mcadoo M, et al. The Chemistry and Biology of Thymosin. J Bio Chem, 1979,254:981-986.
, 百拇医药
2 Low TLK and Goldstein AL. The Chemistry and Biology of Thymosin. J Bio Chem, 1979, 254: 987-995.
3 Frasca D, Adorini L, Doria G. Enhanced Frequency of Mitogen-responsive T-cell Precursors in Old Mice. Eur J Immunol, 1987, 17:727-730.
4 Frasca D, Adorini L, Doria G. Enhancement of Helper and Suppressor T Cell Activities by Thymosin α1 Injection in Old Mice. Immunophar,1985,10:41-49.
5 Goso C, Frasca D and Doria G. Effect of Synthetic Thymic Humoral Factor(THF-γ2) on T Cell. Clin Exp Immunol,1992,87:346-351.
, 百拇医药
6 Mutchnick MG, Appelman HD, Chung HT, et al. Thymosin treatment of chronic hepatitis B: A placebo-controlled pilot trial. Hepatology, 1991,14:409-415.
7 Fattovich G, Farci P, Rugge M, et al. A randomized controlled trial of lymphoblastiold interferon-alpha in patients with chronic hepatitis B lacking HBeAg. Hepatology, 1992,15:584-589.
8 Pastore G, Santantonio T, Milella M, et al. Anti-Hbe-posotive chronic hepatitis B with HBV DNA in the serum response to a 6-month course of lymphoblastiold interferon. J Hepatol, 1992,14:221-225.
9 Hadziyannis S, Bramou T, Makris, et al. Interferon alpha-2b treatment of HBeAg negative/serum HBV DNA positive chronic active hepatitis type B. J Hepatol, 1990,11(suppl):133-136.
(收稿:1997-10-10 修回:1998-07-08), 百拇医药