一种简便快捷的端粒酶活性原位检测法
作者:冯德云 郑辉 程瑞雪 沈明
单位:冯德云 郑辉 程瑞雪 沈明(湖南医科大学病理学教研室,长沙 410078)
关键词:端粒酶;肿瘤免疫酶技术
一种简便快捷的端粒酶活性原位检测法中国图书分类号 R345;R730.3
文献标识码 A 文章编号 1001-7399(1999)02-0176-02
端粒酶是一种特殊的逆转录酶,其由RNA和蛋白质组成,并以本身RNA为模板催化端粒的合成和延伸〔1〕。在体细胞中除成人生殖细胞、胚胎细胞和造血干细胞外,绝大多数正常体细胞该酶呈失活状态,而大多数癌细胞和永生化细胞具有端粒酶活性。目前认为端粒酶激活与肿瘤发生、发展密切相关,已成为医学研究领域的热门课题。既往检测端粒酶活性一般采用端粒重复扩增分析法(TRAP),但该法不能把端粒酶活性与组织细胞的形态结构结合起来研究;1997年Ohyashiki〔2〕在TRAP法的基础上利用原位PCR在原位检测了单层培养细胞和游离细胞的端粒酶活性,但该法亦存在许多问题,如在冰冻切片上未获成功。笔者在实验中通过反复摸索发展了一种操作十分简便、结果稳定、特别是能够在冰冻切片上原位检测端粒酶活性的方法,现介绍如下。
, http://www.100md.com
1 材料与方法
1.1 标本 收集本校附属湘雅医院和附属第二医院外科手术切除的肝细胞癌(HCC)24例、大肠癌20例及耳鼻喉科活检的鼻咽癌(NPC)18例。所有组织均分为2部分,一部分用10%福尔马林固定,作
病理诊断;另一部分于液氮中速冻,-76℃超低温冰箱保存备用。
1.2 试剂 端粒酶活性原位检测试剂盒(引物TS和CX,缓冲液A,缓冲液B,Bio-dNTPs, Taq酶,蛋白酶K,马血清,Avidin-HRP)购自北京医科大学病理系;S-P试剂盒和显色试剂盒系福州迈新生物技术开发公司产品;RNase购自上海华美生物工程公司。
1.3 方法 所有超低温保存的组织在Leica冰冻切片机上切取6 μm的切片,粘贴于多聚赖氨酸处理的载玻片上,端粒酶活性的原位检测按下列2种方法进行。①按试剂盒说明书操作,步骤如下:于冰冻切片上滴加端粒酶反应液(引物TS 0.5 μl,2×缓冲液A 5 μl,2 mmol.L-1 Bio-dNTPs 2 μl H2O 12.5 μl)30℃孵育60 min→PBS洗1×3 min→4%多聚甲醛固定10 min→PBS洗2×3 min后,蛋白酶K消化10 min→PBS洗2×3 min后,80%乙醇浸泡2 min→加PCR反应液(引物TS和CX各0.5 μl,2 mmol.L-1 Bio-dNTPs 2 μl,10×缓冲液1 μl,Taq酶2 U,H2O 11 μl)→加消毒硅化盖玻片→石蜡油封固→PCR扩增(95℃ 1 min,50℃ 1 min,72℃ 1 min)35个循环→氯仿和无水乙醇各洗1次,除去盖片和石蜡油→PBS洗4×5 min→正常马血清封闭60 min→滴加ABC液37℃ 60 min→PBS洗3×5 min后,DAB显色。②按我们改进的方法操作,步骤如下:在6 μm的冰冻切片上滴加反应液(引物TS和C×各0.5 μl,2×缓冲液A 5 μl, 2 mmol.L-1 Bio-dNTPs 2 μl,10×缓冲液B 1 μl,H2O 11 μl)→加消毒硅化盖玻片,于30℃孵育60 min→PBS洗1×3 min→4%多聚甲醛固定10 min→PBS洗2×3min后,80%乙醇浸泡2min→3%H2O2阻断过氧化物酶20 min→正常羊血清封闭60 min→Streptavidin-peroxidase(即用型)37℃ 60 min→PBS洗3×5 min后,DAB显色。
, 百拇医药
1.4 对照:①反应液中用H2O代替引物或Bio-dNTPs作空白对照;②切片预先用RNase于37℃消化60 min以除去端粒酶RNA模板或切片于95℃加热10 min灭活端粒酶作阴性对照;③用试剂盒所附阳性细胞片作阳性对照。
2 结果
2.1 端粒酶HCC、NPC和直肠腺癌中的阳性信号形态 在HCC中端粒酶阳性信号以核型为主,少数细胞呈核浆或全浆型,阳性细胞呈片状或簇状分布(图1,2);NPC中阳性产物基本位于核内(图3),个别细胞为胞浆弱阳性,阳性细胞呈小巢状或小片状。大肠癌组织中阳性信号主要为核型,极少数细胞呈核浆型。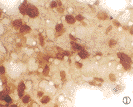
图1 肝癌细胞端粒酶呈核阳性。改进法,×400
, http://www.100md.com
图2 肝癌细胞端粒酶呈核浆型阳性。改进法,×400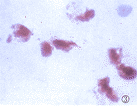
图3 鼻咽癌细胞端粒酶呈核阳性。改进法,×400
2.2 两种方法所获结果的比较 利用我们的方法检测端粒酶活性,其阳性信号的定位、形态及阳性细胞的分布等与按试剂盒说明书操作所获结果均无差别,但组织细胞的形态结构保存更好,背景更清晰。
阳性对照组阳性;阴性对照和空白对照组均阴性。
3 讨论
既往检测组织细胞端粒酶活性所采用的TRAP法是从新鲜组织匀浆中提取端粒酶成分,利用该酶的逆转录酶功能合成cDNA,再通过PCR扩增以检测端粒酶活性〔3~6〕。该法不能把酶活性和细胞形态结构有机地结合起来,而且操作亦较复杂。Ohyashiki等〔2〕利用荧光素标记引物,再经原位PCR扩增发展的原位TRAP法只适用于培养细胞片和游离细胞,在冰冻切片上未获预期结果。
, 百拇医药
鉴于端粒酶是一种逆转录酶,并以自身RNA为模板和合成端粒。根据分子生物学理论,如果该酶有活性,加入引物和合成cDNA的原料dNTPs,在适宜的条件下,它就能够合成cDNA,由于dNTP已用生物素(Biotin)标记,再用Streptavidin-peroxidase与Biotin结合,经DAB显色,即可判断端粒酶的活性。由于Streptavidin与Biotin的结合具有信号放大作用,故原位检测端粒酶活性并不一定要通过PCR扩增。这样,一方面使操作方法十分简便快捷;另一方面因不进行PCR扩增,组织细胞结构保存良好,且背景清晰,特别是该法不但适应于培养细胞爬片和游离细胞涂片,而且适应于冰冻组织切片,故值得推广。
根据本文体会,为获得满意结果,在操作过程中还应注意:①所用盖玻片、微量进样枪吸头、镊子及配反应液所用蒸溜水均应高温消毒;②反应液孵育后的清洗时间不能过长,且动作应轻,由于逆转录合成的cDNA未固定,粘附不牢,如果清洗时间太长或动作过重,容易洗掉,出现假阴性;③为防止脱片载玻片一定要用多聚赖氨酸处理。
, http://www.100md.com
基金项目:卫生部基金资助课题(No 98-1-110)
作者简介:冯德云,男,34岁,硕士,助理研究员。研究方向:肝脏病理
参考文献
1 Nakayama J, Tahara H, Tahara E et al. Telomerase activation by hTRT in human normal fibroblast and hepatocellular carcinomas. Nat Genet, 1998;18:65~68
2 Ohyashiki K, Ohyashiki JH, Nishimaki J et al. Cytological detection of telomerase activity using an in situ telomeric repeat amplification protocol assay. Cancer Res, 1997;57:2100~2103
, http://www.100md.com
3 Nouso K, Urabe Y, Higashi T et al. telomerase as a tool for the differential diagnosis of human hepatocellular carcinoma. Cancer, 1996;78(2):232~236
4 Miura N, Horikawa I, Nishimoto A et al. Progressive telomere shortening and telomerase reactivity during hepatocellular carcinogenesis. Cancer Genet Cytogenet, 1997;93:56~62
5 杨仕明,房殿春,罗元辉等. 胃癌及癌前组织中端粒酶活性的检测. 中华医学杂志,1998;78(3):207~209
6 吴 珊,刘宗石,李晓明等. 原发性肝癌及慢性肝脏病变端粒酶活性的研究. 中华病理学杂志,1998;27(2):91~93
收稿日期:1998-06-26, 百拇医药
单位:冯德云 郑辉 程瑞雪 沈明(湖南医科大学病理学教研室,长沙 410078)
关键词:端粒酶;肿瘤免疫酶技术
一种简便快捷的端粒酶活性原位检测法中国图书分类号 R345;R730.3
文献标识码 A 文章编号 1001-7399(1999)02-0176-02
端粒酶是一种特殊的逆转录酶,其由RNA和蛋白质组成,并以本身RNA为模板催化端粒的合成和延伸〔1〕。在体细胞中除成人生殖细胞、胚胎细胞和造血干细胞外,绝大多数正常体细胞该酶呈失活状态,而大多数癌细胞和永生化细胞具有端粒酶活性。目前认为端粒酶激活与肿瘤发生、发展密切相关,已成为医学研究领域的热门课题。既往检测端粒酶活性一般采用端粒重复扩增分析法(TRAP),但该法不能把端粒酶活性与组织细胞的形态结构结合起来研究;1997年Ohyashiki〔2〕在TRAP法的基础上利用原位PCR在原位检测了单层培养细胞和游离细胞的端粒酶活性,但该法亦存在许多问题,如在冰冻切片上未获成功。笔者在实验中通过反复摸索发展了一种操作十分简便、结果稳定、特别是能够在冰冻切片上原位检测端粒酶活性的方法,现介绍如下。
, http://www.100md.com
1 材料与方法
1.1 标本 收集本校附属湘雅医院和附属第二医院外科手术切除的肝细胞癌(HCC)24例、大肠癌20例及耳鼻喉科活检的鼻咽癌(NPC)18例。所有组织均分为2部分,一部分用10%福尔马林固定,作
病理诊断;另一部分于液氮中速冻,-76℃超低温冰箱保存备用。
1.2 试剂 端粒酶活性原位检测试剂盒(引物TS和CX,缓冲液A,缓冲液B,Bio-dNTPs, Taq酶,蛋白酶K,马血清,Avidin-HRP)购自北京医科大学病理系;S-P试剂盒和显色试剂盒系福州迈新生物技术开发公司产品;RNase购自上海华美生物工程公司。
1.3 方法 所有超低温保存的组织在Leica冰冻切片机上切取6 μm的切片,粘贴于多聚赖氨酸处理的载玻片上,端粒酶活性的原位检测按下列2种方法进行。①按试剂盒说明书操作,步骤如下:于冰冻切片上滴加端粒酶反应液(引物TS 0.5 μl,2×缓冲液A 5 μl,2 mmol.L-1 Bio-dNTPs 2 μl H2O 12.5 μl)30℃孵育60 min→PBS洗1×3 min→4%多聚甲醛固定10 min→PBS洗2×3 min后,蛋白酶K消化10 min→PBS洗2×3 min后,80%乙醇浸泡2 min→加PCR反应液(引物TS和CX各0.5 μl,2 mmol.L-1 Bio-dNTPs 2 μl,10×缓冲液1 μl,Taq酶2 U,H2O 11 μl)→加消毒硅化盖玻片→石蜡油封固→PCR扩增(95℃ 1 min,50℃ 1 min,72℃ 1 min)35个循环→氯仿和无水乙醇各洗1次,除去盖片和石蜡油→PBS洗4×5 min→正常马血清封闭60 min→滴加ABC液37℃ 60 min→PBS洗3×5 min后,DAB显色。②按我们改进的方法操作,步骤如下:在6 μm的冰冻切片上滴加反应液(引物TS和C×各0.5 μl,2×缓冲液A 5 μl, 2 mmol.L-1 Bio-dNTPs 2 μl,10×缓冲液B 1 μl,H2O 11 μl)→加消毒硅化盖玻片,于30℃孵育60 min→PBS洗1×3 min→4%多聚甲醛固定10 min→PBS洗2×3min后,80%乙醇浸泡2min→3%H2O2阻断过氧化物酶20 min→正常羊血清封闭60 min→Streptavidin-peroxidase(即用型)37℃ 60 min→PBS洗3×5 min后,DAB显色。
, 百拇医药
1.4 对照:①反应液中用H2O代替引物或Bio-dNTPs作空白对照;②切片预先用RNase于37℃消化60 min以除去端粒酶RNA模板或切片于95℃加热10 min灭活端粒酶作阴性对照;③用试剂盒所附阳性细胞片作阳性对照。
2 结果
2.1 端粒酶HCC、NPC和直肠腺癌中的阳性信号形态 在HCC中端粒酶阳性信号以核型为主,少数细胞呈核浆或全浆型,阳性细胞呈片状或簇状分布(图1,2);NPC中阳性产物基本位于核内(图3),个别细胞为胞浆弱阳性,阳性细胞呈小巢状或小片状。大肠癌组织中阳性信号主要为核型,极少数细胞呈核浆型。

图1 肝癌细胞端粒酶呈核阳性。改进法,×400

, http://www.100md.com
图2 肝癌细胞端粒酶呈核浆型阳性。改进法,×400

图3 鼻咽癌细胞端粒酶呈核阳性。改进法,×400
2.2 两种方法所获结果的比较 利用我们的方法检测端粒酶活性,其阳性信号的定位、形态及阳性细胞的分布等与按试剂盒说明书操作所获结果均无差别,但组织细胞的形态结构保存更好,背景更清晰。
阳性对照组阳性;阴性对照和空白对照组均阴性。
3 讨论
既往检测组织细胞端粒酶活性所采用的TRAP法是从新鲜组织匀浆中提取端粒酶成分,利用该酶的逆转录酶功能合成cDNA,再通过PCR扩增以检测端粒酶活性〔3~6〕。该法不能把酶活性和细胞形态结构有机地结合起来,而且操作亦较复杂。Ohyashiki等〔2〕利用荧光素标记引物,再经原位PCR扩增发展的原位TRAP法只适用于培养细胞片和游离细胞,在冰冻切片上未获预期结果。
, 百拇医药
鉴于端粒酶是一种逆转录酶,并以自身RNA为模板和合成端粒。根据分子生物学理论,如果该酶有活性,加入引物和合成cDNA的原料dNTPs,在适宜的条件下,它就能够合成cDNA,由于dNTP已用生物素(Biotin)标记,再用Streptavidin-peroxidase与Biotin结合,经DAB显色,即可判断端粒酶的活性。由于Streptavidin与Biotin的结合具有信号放大作用,故原位检测端粒酶活性并不一定要通过PCR扩增。这样,一方面使操作方法十分简便快捷;另一方面因不进行PCR扩增,组织细胞结构保存良好,且背景清晰,特别是该法不但适应于培养细胞爬片和游离细胞涂片,而且适应于冰冻组织切片,故值得推广。
根据本文体会,为获得满意结果,在操作过程中还应注意:①所用盖玻片、微量进样枪吸头、镊子及配反应液所用蒸溜水均应高温消毒;②反应液孵育后的清洗时间不能过长,且动作应轻,由于逆转录合成的cDNA未固定,粘附不牢,如果清洗时间太长或动作过重,容易洗掉,出现假阴性;③为防止脱片载玻片一定要用多聚赖氨酸处理。
, http://www.100md.com
基金项目:卫生部基金资助课题(No 98-1-110)
作者简介:冯德云,男,34岁,硕士,助理研究员。研究方向:肝脏病理
参考文献
1 Nakayama J, Tahara H, Tahara E et al. Telomerase activation by hTRT in human normal fibroblast and hepatocellular carcinomas. Nat Genet, 1998;18:65~68
2 Ohyashiki K, Ohyashiki JH, Nishimaki J et al. Cytological detection of telomerase activity using an in situ telomeric repeat amplification protocol assay. Cancer Res, 1997;57:2100~2103
, http://www.100md.com
3 Nouso K, Urabe Y, Higashi T et al. telomerase as a tool for the differential diagnosis of human hepatocellular carcinoma. Cancer, 1996;78(2):232~236
4 Miura N, Horikawa I, Nishimoto A et al. Progressive telomere shortening and telomerase reactivity during hepatocellular carcinogenesis. Cancer Genet Cytogenet, 1997;93:56~62
5 杨仕明,房殿春,罗元辉等. 胃癌及癌前组织中端粒酶活性的检测. 中华医学杂志,1998;78(3):207~209
6 吴 珊,刘宗石,李晓明等. 原发性肝癌及慢性肝脏病变端粒酶活性的研究. 中华病理学杂志,1998;27(2):91~93
收稿日期:1998-06-26, 百拇医药