乙型肝炎病毒X基因转基因小鼠的初步建立
作者:朱焕章 史景泉 成国祥 陈建泉 旷双运 孙强 成勇 张新立 李厚达 徐少甫 钱耕荪 顾建人
单位:朱焕章 史景泉 张新立 第三军医大学基础医学部病理学教研室 重庆,400038;成国祥 陈建泉 孙强 成勇 李厚达 徐少甫 扬州大学农学院江苏省生物工程重点实验室 旷双运 钱耕荪 顾建人 上海肿瘤研究所 上海,200032
关键词:乙型肝炎病毒X基因;转基因小鼠
Prelimenary establishment of transgenic mice harboring gene X of hepatitis B virusPrelimenary establishment of transgenic mice harboring gene X of hepatitis B virus
中图法分类号 R512.62
, 百拇医药
HBx基因为HBV基因组上的一个开放读框,可编码具有转录反式激活作用的蛋白(HBxAg)。已证实在体外HBxAg可使哺乳细胞株发生恶性转化[1]。为了探索在体内HBxAg转化细胞的作用,国外数个实验室已相继建立了HBx转基因鼠模型[2,3]。为研究HBx基因在肝细胞癌变过程中的确切作用提供有效的动物模型,我们初步建立了携带乙型肝炎病毒X基因的转基因小鼠,现报道如下。
1 材料与方法
C57BL/6(清洁级)小鼠购自上海实验动物中心。
限制性内切酶EcoRⅠ、HindⅢ、BamHⅠ、T4 DNA连接酶、dNTP、Taq DNA聚合酶及MMLV反逆录酶等分别为Promega、 Sangon和Sigma公司产品。
采用DNA重组技术,获得了含有X基因(HBV adr亚型)的重组逆转录病毒载体质粒PXSHD42,长6 787 bp,见图1。
, 百拇医药
图1 重组质粒PXSHD42的结构
Fig 1 Structure of recombinant plasmid PXSHD42
X:HBx gene; ↓:BamH Ⅰ
1.1 HBx转基因小鼠的产生
重组质粒PXSHD42经酶切、纯化后用显微注射方法[4]导入小鼠受精卵的雄性原核,然后移入假孕母鼠的输卵管内,生产仔鼠。
1.2 转基因整合的鉴定
DNA的准备:将2~3周龄的转基因小鼠尾(长1~1.5 mm)组织,按Sambrook[5]方法进行DNA抽提。
, 百拇医药 Nested-PCR:据人类HBV亚型X基因序列进行引物设计,引物由美国赛百胜公司合成。引物序列如下:
外引物1∶5′-CATGGCTGCTCGGGTGTGCT-3′
2∶5′-ATTAGGCAGAGCTGAAAAG-3′
内引物3∶5′-CTTTGTCTACGTCCCGTCGGCGTCGAATG-3′
4∶5′-CATTCTTTGAAGTATGCCTCAAGGTCGGT-3′
PCR反应总体积为50 μl(含10×Buffer 5 μl,25 mmol/L Mg2+3 μl,15 mmol/L dNTP 3 μl, 20 pmol外引物1、2各1.5 μl,Taq DNA聚合酶2 U,DNA样品1 μg)。PCR反应Ⅰ程序为:首先95℃变性5 min,然后进行30个循环,循环参数为94℃ 50 s,55℃60 s,72℃60 s。PCR反应Ⅱ体系包括10×Buffer 5 μl,25 mmol/L Mg2+ 3 μl, 15 mmol/L dNTP 3 μl, 10 pmol内引物3、4各3 μl, Taq DNA聚合酶2.5 U, PCR反应Ⅰ 1~2 μl。 PCR反应Ⅱ为:94℃变性5 min,然后进行30个循环,循环参数为94℃ 50 s,60℃ 50 s,72℃ 60 s;最后,72℃延伸10 min。以PCRⅡ产物10 μl在1.8%凝胶上点样,电泳70 min,观察电泳结果。
, 百拇医药
1.3 转基因表达的检测
将8周龄整合的F1代转基因小鼠的肝脏取出,冻存于液氮中,按Sambrook[5]方法进行总RNA抽提。
RT-PCR:前述外引物1、2做为RT-PCR的引物序列。第Ⅰ链cDNA合成按如下程序:RT反应总体积为50 μl(含RNA 1 μg, 10×Buffer 5 μl, 15 mmol/L dNTP 3 μl, RNasin (80 U/μl) 1 μl, 10 pmol外引物1或22 μl, MM LV 1 μl)。RT反应37℃ 1 h。RT反应产物被直接用于PCR反应,再加Taq DNA聚合酶2 U,10 pmol外引物1、2各3 μl。PCR反应程序按上述PCRI的条件。
2 结果
重组逆转录DNA片断被显微注入514枚C57BL/6的雄性原核,存活的368枚被植入假孕受体小鼠的输卵管内,其中8只受体小鼠怀孕并产生20只仔鼠。合子存活率分别为71%(368/514)和5.4%(20/368),对20只仔鼠尾组织进行抽提DNA和PCR扩增的整合检测,结果显示4只雄性和2只雌性小鼠有外源基因的整合,见图2。4只雄性小鼠被命名为首建鼠,X1,X5,X9和X15。总的整合率和转基因的有效率分别为30%(6/20)和1.1%(6/514)。
, 百拇医药
为了产生F1代,将首建鼠X1,X5,X9和X15分别与近交C57BL/6或转基因的同窝杂交,X1产生20只F1仔鼠,用PCR方法进行整合检测显示有9只整合;X5产生18只F1仔鼠,有8只整合;X9产生17只F1仔鼠,有7只整合;但首建鼠X15的F1代仔鼠,用PCR进行整合检则,均为阴性。
应用RT-PCR检测HBx基因在首建鼠X1、X5和X9的F1代整合小鼠肝组织的表达情况,显示PCR产物(439 bp)表达于X1、X9的F1代小鼠,而在X5的F1代小鼠则未见阳性产物,见图2。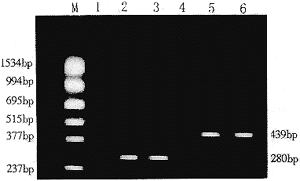
图2 Nested PCR, RT-PCR扩增产物电泳分析
1:正常小鼠尾组织DNA(阴性对照);2、3:转基因小鼠尾组织DNA显阳性带(280 bp);4:正常小鼠肝组织cDNA;5、6:转基因小鼠肝组织cDNA显阳性带(439 bp);M:PCR标准Marker(SABC产品)。
, 百拇医药
Fig 2 Electrophoresis analysis of Nested PCRand RT-PCR products
lane 1:normal mouse tail tissue DNA(negative control);lane 2 and 3:transgenic mice tail tissue DNA showed positive bands(280 bp); Lane 4:normal mouse liver tissue cDNA(negative control);lane 5 and 6:transgenic mice liver tissue cDNA showed positive bands(439 bp); M:PCR standard marker(SABC).
3 讨论
本实验将含有X基因(HBVadr亚型)及其调控元件的重组逆转录病毒载体质粒的DNA片段,用显微注射方法导入肝癌自发率较低的近交C57 BL/6品系的受精卵,其合子存活率和生育率分别为71%和5.4%,转基因的有效率是1.1%。在本研究中,多数首建鼠的F1代小鼠,其整合检测的结果论证了外源基因能稳定地按孟德尔规则传递到下代。至于在首建鼠X15的F1代仔鼠中,未见HBx基因的整合,认为首建鼠X15可能是一个嵌合体。
, 百拇医药
本研究中,HBx基因是处于逆转录病毒的长末端重复序列的启动子/增强子和SV40启动子的调控之下,并在部分转基因小鼠的肝脏表达。此结果说明了调控序列的有效性以及HBx基因的表达可能受整合位点等因素的影响。
国家“九五”攻关项目,No.969060107 军队医药科研基金资助项目,No.96M092 江苏省重点开放实验室基金资助项目
作者简介:朱焕章,男,34岁,讲师,博士
参考文献
1 Feitelson M A, Duan L X. Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma. Am J Pathol, 1997,150(4):1141
, 百拇医药
2 Kim C M, Koike K, Saito I, et al. HBx gene of hepatitis B virus induces liver cancer in transgenic mice. Nature, 1991,351(3):317
3 Koike K, Moriya K, Iino S, et al. High-level expression of hepatitis B virus HBx gene and hepatocarcinogenesis in transgenic mice. Hepatology, 1994,19(6):810
4 Hhogen B, Costantini F, Lacy E. Manipulating the mouse embryo: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press, 1986.80~82
5 Sambrook J, Fristch E F, Maniatris T. Molecular cloning: a laboratory manual. 2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989.112~115
(收稿:1998-08-10;修回:1998-12-27)
(编辑 冷怀明), http://www.100md.com
单位:朱焕章 史景泉 张新立 第三军医大学基础医学部病理学教研室 重庆,400038;成国祥 陈建泉 孙强 成勇 李厚达 徐少甫 扬州大学农学院江苏省生物工程重点实验室 旷双运 钱耕荪 顾建人 上海肿瘤研究所 上海,200032
关键词:乙型肝炎病毒X基因;转基因小鼠
Prelimenary establishment of transgenic mice harboring gene X of hepatitis B virusPrelimenary establishment of transgenic mice harboring gene X of hepatitis B virus
中图法分类号 R512.62
, 百拇医药
HBx基因为HBV基因组上的一个开放读框,可编码具有转录反式激活作用的蛋白(HBxAg)。已证实在体外HBxAg可使哺乳细胞株发生恶性转化[1]。为了探索在体内HBxAg转化细胞的作用,国外数个实验室已相继建立了HBx转基因鼠模型[2,3]。为研究HBx基因在肝细胞癌变过程中的确切作用提供有效的动物模型,我们初步建立了携带乙型肝炎病毒X基因的转基因小鼠,现报道如下。
1 材料与方法
C57BL/6(清洁级)小鼠购自上海实验动物中心。
限制性内切酶EcoRⅠ、HindⅢ、BamHⅠ、T4 DNA连接酶、dNTP、Taq DNA聚合酶及MMLV反逆录酶等分别为Promega、 Sangon和Sigma公司产品。
采用DNA重组技术,获得了含有X基因(HBV adr亚型)的重组逆转录病毒载体质粒PXSHD42,长6 787 bp,见图1。

, 百拇医药
图1 重组质粒PXSHD42的结构
Fig 1 Structure of recombinant plasmid PXSHD42
X:HBx gene; ↓:BamH Ⅰ
1.1 HBx转基因小鼠的产生
重组质粒PXSHD42经酶切、纯化后用显微注射方法[4]导入小鼠受精卵的雄性原核,然后移入假孕母鼠的输卵管内,生产仔鼠。
1.2 转基因整合的鉴定
DNA的准备:将2~3周龄的转基因小鼠尾(长1~1.5 mm)组织,按Sambrook[5]方法进行DNA抽提。
, 百拇医药 Nested-PCR:据人类HBV亚型X基因序列进行引物设计,引物由美国赛百胜公司合成。引物序列如下:
外引物1∶5′-CATGGCTGCTCGGGTGTGCT-3′
2∶5′-ATTAGGCAGAGCTGAAAAG-3′
内引物3∶5′-CTTTGTCTACGTCCCGTCGGCGTCGAATG-3′
4∶5′-CATTCTTTGAAGTATGCCTCAAGGTCGGT-3′
PCR反应总体积为50 μl(含10×Buffer 5 μl,25 mmol/L Mg2+3 μl,15 mmol/L dNTP 3 μl, 20 pmol外引物1、2各1.5 μl,Taq DNA聚合酶2 U,DNA样品1 μg)。PCR反应Ⅰ程序为:首先95℃变性5 min,然后进行30个循环,循环参数为94℃ 50 s,55℃60 s,72℃60 s。PCR反应Ⅱ体系包括10×Buffer 5 μl,25 mmol/L Mg2+ 3 μl, 15 mmol/L dNTP 3 μl, 10 pmol内引物3、4各3 μl, Taq DNA聚合酶2.5 U, PCR反应Ⅰ 1~2 μl。 PCR反应Ⅱ为:94℃变性5 min,然后进行30个循环,循环参数为94℃ 50 s,60℃ 50 s,72℃ 60 s;最后,72℃延伸10 min。以PCRⅡ产物10 μl在1.8%凝胶上点样,电泳70 min,观察电泳结果。
, 百拇医药
1.3 转基因表达的检测
将8周龄整合的F1代转基因小鼠的肝脏取出,冻存于液氮中,按Sambrook[5]方法进行总RNA抽提。
RT-PCR:前述外引物1、2做为RT-PCR的引物序列。第Ⅰ链cDNA合成按如下程序:RT反应总体积为50 μl(含RNA 1 μg, 10×Buffer 5 μl, 15 mmol/L dNTP 3 μl, RNasin (80 U/μl) 1 μl, 10 pmol外引物1或22 μl, MM LV 1 μl)。RT反应37℃ 1 h。RT反应产物被直接用于PCR反应,再加Taq DNA聚合酶2 U,10 pmol外引物1、2各3 μl。PCR反应程序按上述PCRI的条件。
2 结果
重组逆转录DNA片断被显微注入514枚C57BL/6的雄性原核,存活的368枚被植入假孕受体小鼠的输卵管内,其中8只受体小鼠怀孕并产生20只仔鼠。合子存活率分别为71%(368/514)和5.4%(20/368),对20只仔鼠尾组织进行抽提DNA和PCR扩增的整合检测,结果显示4只雄性和2只雌性小鼠有外源基因的整合,见图2。4只雄性小鼠被命名为首建鼠,X1,X5,X9和X15。总的整合率和转基因的有效率分别为30%(6/20)和1.1%(6/514)。
, 百拇医药
为了产生F1代,将首建鼠X1,X5,X9和X15分别与近交C57BL/6或转基因的同窝杂交,X1产生20只F1仔鼠,用PCR方法进行整合检测显示有9只整合;X5产生18只F1仔鼠,有8只整合;X9产生17只F1仔鼠,有7只整合;但首建鼠X15的F1代仔鼠,用PCR进行整合检则,均为阴性。
应用RT-PCR检测HBx基因在首建鼠X1、X5和X9的F1代整合小鼠肝组织的表达情况,显示PCR产物(439 bp)表达于X1、X9的F1代小鼠,而在X5的F1代小鼠则未见阳性产物,见图2。

图2 Nested PCR, RT-PCR扩增产物电泳分析
1:正常小鼠尾组织DNA(阴性对照);2、3:转基因小鼠尾组织DNA显阳性带(280 bp);4:正常小鼠肝组织cDNA;5、6:转基因小鼠肝组织cDNA显阳性带(439 bp);M:PCR标准Marker(SABC产品)。
, 百拇医药
Fig 2 Electrophoresis analysis of Nested PCRand RT-PCR products
lane 1:normal mouse tail tissue DNA(negative control);lane 2 and 3:transgenic mice tail tissue DNA showed positive bands(280 bp); Lane 4:normal mouse liver tissue cDNA(negative control);lane 5 and 6:transgenic mice liver tissue cDNA showed positive bands(439 bp); M:PCR standard marker(SABC).
3 讨论
本实验将含有X基因(HBVadr亚型)及其调控元件的重组逆转录病毒载体质粒的DNA片段,用显微注射方法导入肝癌自发率较低的近交C57 BL/6品系的受精卵,其合子存活率和生育率分别为71%和5.4%,转基因的有效率是1.1%。在本研究中,多数首建鼠的F1代小鼠,其整合检测的结果论证了外源基因能稳定地按孟德尔规则传递到下代。至于在首建鼠X15的F1代仔鼠中,未见HBx基因的整合,认为首建鼠X15可能是一个嵌合体。
, 百拇医药
本研究中,HBx基因是处于逆转录病毒的长末端重复序列的启动子/增强子和SV40启动子的调控之下,并在部分转基因小鼠的肝脏表达。此结果说明了调控序列的有效性以及HBx基因的表达可能受整合位点等因素的影响。
国家“九五”攻关项目,No.969060107 军队医药科研基金资助项目,No.96M092 江苏省重点开放实验室基金资助项目
作者简介:朱焕章,男,34岁,讲师,博士
参考文献
1 Feitelson M A, Duan L X. Hepatitis B virus X antigen in the pathogenesis of chronic infections and the development of hepatocellular carcinoma. Am J Pathol, 1997,150(4):1141
, 百拇医药
2 Kim C M, Koike K, Saito I, et al. HBx gene of hepatitis B virus induces liver cancer in transgenic mice. Nature, 1991,351(3):317
3 Koike K, Moriya K, Iino S, et al. High-level expression of hepatitis B virus HBx gene and hepatocarcinogenesis in transgenic mice. Hepatology, 1994,19(6):810
4 Hhogen B, Costantini F, Lacy E. Manipulating the mouse embryo: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press, 1986.80~82
5 Sambrook J, Fristch E F, Maniatris T. Molecular cloning: a laboratory manual. 2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989.112~115
(收稿:1998-08-10;修回:1998-12-27)
(编辑 冷怀明), http://www.100md.com