细胞生长抑制测定TGF-β1生物活性
作者:李勇 韩本立 李昆 王会信 龙建银
单位:李勇 韩本立 李昆 第三军医大学附属西南医院肝胆外科中心 重庆,400038;王会信 龙建银 军事医学科学院基础医学研究所 北京,100000
关键词:肺上皮细胞;转化生长因子;3H-TdR法;MTT法
第三军医大学学报990224 Measuring bioactive TGF-β1 by cell growth inhibition
提要 目的:选择检测转化生长因子β1(Transforming growth factor β1,TGF-β1)的灵敏可靠的方法。方法:用水貂肺上皮细胞(CCL-64)作为抑制细胞,结合3H-TdR掺入法和MTT法,对照标准含量之TGF-β1,分别对上述方法性能进行了比较。结果:3H-TdR掺入法较MTT法灵敏度高,稳定性好。结论:3H-TdR掺入法测定TGF-β1活性,简便实用,经济可靠,适于推广使用。
, 百拇医药
中图法分类号 R446.1
转化生长因子β1(Transforming growth factor,TGF-β1)是一种多功能细胞生长调节蛋白[1],它参与了胚胎的发育、损伤组织的修复、肿瘤的发生和发展等生理病理过程,是目前众多学科的研究热点[2]。因此,研究和探索TGF-β1生物活性测定方法具有重要的意义。本研究以细胞生长抑制法为基础,分别对3H-TdR和MTT测定方法的灵敏性、稳定性进行了比较,其检测结果报告如下。
1 材料和方法
1.1 材料
水貂肺上皮细胞株(CCL-64):引自美国ATCC细胞保藏中心,军事医学科学院基础所陆应麟研究员惠赠;RPMI1640培养基培养、人TGF-β1标准品购自Promega公司,3H-TdR原液(1 mCi/ml,放射比强度25 Ci.mmol-1.L-1),中国原子能研究所,MTT试剂盒购自Promega公司。
, 百拇医药
1.2 方法[3]
1.2.1 CCL-64细胞培养 常规复苏细胞,待细胞生长贴壁后换新鲜含10%小牛血清的1640培养液,选择生长旺盛,细胞形态好的对数生长期CCL-64细胞用于TGF-β1活性测定(下称测活)。
1.2.2 3H-TdR掺入测定法 用测活培养液(RPMI1640+2%小牛血清),将待测样品液(标准TGF-β1)倍比稀释(1∶1、1∶2、1∶4、1∶8),取各稀释液50 μl分别加于96孔板(三孔重复),同时收获对数生长期CCL-64细胞,以105/ml的细胞密度重悬于测活培养液中,按每孔50 μl接种于已加入待测样品的96孔板中,设置空白对照孔(CCL-64细胞+测活液),于37℃、5%CO2条件下培养48 h,培养结束前6 h每孔加入3H-TdR 0.5 μCi,至48 h弃培养液,D′Hank液洗涤2次,以0.25%胰酶、0.2%EDTA消化分散细胞后,用多通道细胞收获仪(浙江东浦仪器厂)将CCL-64细胞收获于玻璃纤维滤纸上,烤箱内烤干滤纸后,分放于测闪瓶,加入5 ml闪烁液,于β-液体闪烁仪(LKB-1217)上测定共3H-TdR掺入量(Bq)。
, 百拇医药
其生长抑制率计算按下式进行:
采用抑制百分数对稀释倍数的对照值作图,计算样品中的TGF-β1相对浓度[4]。
1.2.3 MTT测定法 (参阅试剂盒说明书)CCL-64细胞悬液调整至1×105/ml,接种于96孔板(50 μl/孔),同时加入倍比稀释的TGF-β1标准品和测活培养液(50 μl/孔),于37℃,5%CO2中孵育48 h,每孔加入15 μl染色液,继续孵育4 h,加入100 μl终止反应液,室温下过夜,于酶联仪(Bio-Rad450)570 nm处测定每孔Dλ值,细胞生长抑制率按下式计算: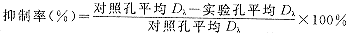
, 百拇医药
2 结果
2.1 3H-TdR和MTT方法灵敏性比较
以标准品人TGF-β1定量倍比稀释的对数为横坐标,分别以3H-TdR和MTT方法所得CCL-64细胞生长抑制率(Bq%、Dλ%)为纵坐标作图,见两法所得结果一致,均反映了CCL-64细胞生长抑制与TGF-β1量的负相关性。以直接回归法求得各自函数方程:
3H-TdR法:Y=99.9004-0.8630X
MTT法:Y=58.0339-0.5864X
两方程回归系数分别为0.8630和0.5864,经回归系数假设检验证实二者差异显著(P<0.05),说明3H-TdR方法较MTT灵敏度高。
, http://www.100md.com
2.2 3H-TdR和MTT方法稳定性比较
将定量的标准品人TGF-β1(1.5 ng/ml、4.5 ng/ml)分别用两法测定,以其抑制率理论计算值( )、实际测定值(Y)和实际TGF-β1含量计算值(X)见表1,依表计算3H-TdR误差率较MTT法低。
)、实际测定值(Y)和实际TGF-β1含量计算值(X)见表1,依表计算3H-TdR误差率较MTT法低。
表1 3H-TdR和MTT方法测定TGF-β1活性稳定性比较
1.5 ng/ml
4.5 ng/ml
, http://www.100md.com
Y
X
Y
X
3H-TdR
98.6059
98.567
1.545
96.0169
96.048
4.463
, http://www.100md.com MTT
57.1543
57.258
1.322
55.3951
55.475
4.364
3 讨论
TGF-β测定方法一般分为生物学、免疫学和放射受体测定法[3]。生物学测定法是通过TGF-β刺激或抑制敏感细胞株增殖、调节细胞基质形成、抗原表达程度来确定其活性和含量,该方法灵敏度高,比较真实反映了TGF-β生物活性特点,直观、可靠。一般常用大鼠肾成纤维细胞软琼脂克隆法和MV-1-Lu水貂肺上皮细胞(CCL-64)生长抑制法[5,6],所结合的3H-TdR和MTT法理论依据分别是:MTT法主要原理是线粒体琥珀酸脱氢酶能催化四甲基偶氮唑盐(MTT)形成蓝色甲,其形成量与细胞数量和功能状态呈正相关,用酶联仪在570 nm处测定Dλ值可以反映甲形成量,亦反映细胞的增殖量及状态。3H-TdR方法基于细胞增殖周期中DNA、RNA合成增加,3H-TdR能被作为原料摄入细胞,测定细胞内3H-TdR放射量,反映了细胞增殖情况,从而计算出抑制率与TGF-β活性含量的关系。
, 百拇医药
免疫学测定法基于TGF-β是蛋白质这一特点,用单抗或多克隆抗体结合ELISA或放射免疫测定法,一般操作简便,专一性强,且能区别不同亚型TGF-β的存在[7,8],该方法所反映的是全部TGF-β的情况,不能客观显示活性TGF-β的量,且不够稳定。放射受体测定法基于受体-配体结合的原理,测定包括潜活形式在内的各型TGF-β,极具专一性,但有接触同位素及重复性差等缺点[9]。
本研究选用水貂肺上皮细胞(CCL-64)生长抑制法测定活性TGF-β1,并将其3H-TdR掺入法与MTT法进行了比较,证明3H-TdR方法较MTT法灵敏度高、稳定性好,经济实惠,易于在TGF-β1检测方法中推广。
(本文得到第三军医大学医学统计学教研室尹全焕教授的指导和帮助,特此致谢!)
, 百拇医药 作者简介:李勇,男,31岁,主治医师,讲师,博士
参考文献
1 Roberts A B, Sporn M B. The transforming growth factor-beta. In: Sporn M B eds. Peptide growth fatcors and their receptors. Berlin: Springer Verlag,1990.417~419
2 李 勇,韩本立.TGF-β与器官移植.国外医学:创伤与外科基本问题分册,1995,16(4):196
3 虞冠华,许祥裕,丁树标.转化生长因子-β的测定.上海免疫学杂志,1995,15(2):116
4 龙建银,王会信,张宏权.人转化生长因子-β1 cDNA在COS-7细胞中的表达.生物化学杂志,1995,11(4):396
, http://www.100md.com
5 Rizzino A. Soft agar growth assays for transforming growth factors and mitogenic peptides. Methods Enxzymol,1987,146:341
6 Van Zoelen E J J, Van Oostward T M J, De Last S W. PDGF-like growth factor induces EGF-potentiated phenotypic transformign of normal rat kidney cells in the absence of TGF-β. Biochem Biophys Res Comm,1986,141(3):1229
7 Flanders K C, Roberts A B, Ling N, et al. Antibodies to peptide determinants in TGF-β and their applications. Biochem,1988,27(2):739
, http://www.100md.com
8 Ksander G A, Gerhardt C O, Dadch J R, et al. A novel polyconal antibody(CL-Bl/29) for immunoloculization of TGF-β in adult mouse. J Histochem Cytochem,1990,38(12):1831
9 Boyd F T, Cheifetz S, Andres J, et al. Transforming growth factor-β receptors and binding proteoglycans. J Cell Sci,1990,13(Suppl):131
(收稿:1998-09-05;修回:1998-12-29), 百拇医药
单位:李勇 韩本立 李昆 第三军医大学附属西南医院肝胆外科中心 重庆,400038;王会信 龙建银 军事医学科学院基础医学研究所 北京,100000
关键词:肺上皮细胞;转化生长因子;3H-TdR法;MTT法
第三军医大学学报990224 Measuring bioactive TGF-β1 by cell growth inhibition
提要 目的:选择检测转化生长因子β1(Transforming growth factor β1,TGF-β1)的灵敏可靠的方法。方法:用水貂肺上皮细胞(CCL-64)作为抑制细胞,结合3H-TdR掺入法和MTT法,对照标准含量之TGF-β1,分别对上述方法性能进行了比较。结果:3H-TdR掺入法较MTT法灵敏度高,稳定性好。结论:3H-TdR掺入法测定TGF-β1活性,简便实用,经济可靠,适于推广使用。
, 百拇医药
中图法分类号 R446.1
转化生长因子β1(Transforming growth factor,TGF-β1)是一种多功能细胞生长调节蛋白[1],它参与了胚胎的发育、损伤组织的修复、肿瘤的发生和发展等生理病理过程,是目前众多学科的研究热点[2]。因此,研究和探索TGF-β1生物活性测定方法具有重要的意义。本研究以细胞生长抑制法为基础,分别对3H-TdR和MTT测定方法的灵敏性、稳定性进行了比较,其检测结果报告如下。
1 材料和方法
1.1 材料
水貂肺上皮细胞株(CCL-64):引自美国ATCC细胞保藏中心,军事医学科学院基础所陆应麟研究员惠赠;RPMI1640培养基培养、人TGF-β1标准品购自Promega公司,3H-TdR原液(1 mCi/ml,放射比强度25 Ci.mmol-1.L-1),中国原子能研究所,MTT试剂盒购自Promega公司。
, 百拇医药
1.2 方法[3]
1.2.1 CCL-64细胞培养 常规复苏细胞,待细胞生长贴壁后换新鲜含10%小牛血清的1640培养液,选择生长旺盛,细胞形态好的对数生长期CCL-64细胞用于TGF-β1活性测定(下称测活)。
1.2.2 3H-TdR掺入测定法 用测活培养液(RPMI1640+2%小牛血清),将待测样品液(标准TGF-β1)倍比稀释(1∶1、1∶2、1∶4、1∶8),取各稀释液50 μl分别加于96孔板(三孔重复),同时收获对数生长期CCL-64细胞,以105/ml的细胞密度重悬于测活培养液中,按每孔50 μl接种于已加入待测样品的96孔板中,设置空白对照孔(CCL-64细胞+测活液),于37℃、5%CO2条件下培养48 h,培养结束前6 h每孔加入3H-TdR 0.5 μCi,至48 h弃培养液,D′Hank液洗涤2次,以0.25%胰酶、0.2%EDTA消化分散细胞后,用多通道细胞收获仪(浙江东浦仪器厂)将CCL-64细胞收获于玻璃纤维滤纸上,烤箱内烤干滤纸后,分放于测闪瓶,加入5 ml闪烁液,于β-液体闪烁仪(LKB-1217)上测定共3H-TdR掺入量(Bq)。
, 百拇医药
其生长抑制率计算按下式进行:

采用抑制百分数对稀释倍数的对照值作图,计算样品中的TGF-β1相对浓度[4]。
1.2.3 MTT测定法 (参阅试剂盒说明书)CCL-64细胞悬液调整至1×105/ml,接种于96孔板(50 μl/孔),同时加入倍比稀释的TGF-β1标准品和测活培养液(50 μl/孔),于37℃,5%CO2中孵育48 h,每孔加入15 μl染色液,继续孵育4 h,加入100 μl终止反应液,室温下过夜,于酶联仪(Bio-Rad450)570 nm处测定每孔Dλ值,细胞生长抑制率按下式计算:
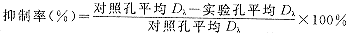
, 百拇医药
2 结果
2.1 3H-TdR和MTT方法灵敏性比较
以标准品人TGF-β1定量倍比稀释的对数为横坐标,分别以3H-TdR和MTT方法所得CCL-64细胞生长抑制率(Bq%、Dλ%)为纵坐标作图,见两法所得结果一致,均反映了CCL-64细胞生长抑制与TGF-β1量的负相关性。以直接回归法求得各自函数方程:
3H-TdR法:Y=99.9004-0.8630X
MTT法:Y=58.0339-0.5864X
两方程回归系数分别为0.8630和0.5864,经回归系数假设检验证实二者差异显著(P<0.05),说明3H-TdR方法较MTT灵敏度高。
, http://www.100md.com
2.2 3H-TdR和MTT方法稳定性比较
将定量的标准品人TGF-β1(1.5 ng/ml、4.5 ng/ml)分别用两法测定,以其抑制率理论计算值(
 )、实际测定值(Y)和实际TGF-β1含量计算值(X)见表1,依表计算3H-TdR误差率较MTT法低。
)、实际测定值(Y)和实际TGF-β1含量计算值(X)见表1,依表计算3H-TdR误差率较MTT法低。表1 3H-TdR和MTT方法测定TGF-β1活性稳定性比较
1.5 ng/ml
4.5 ng/ml

, http://www.100md.com
Y
X

Y
X
3H-TdR
98.6059
98.567
1.545
96.0169
96.048
4.463
, http://www.100md.com MTT
57.1543
57.258
1.322
55.3951
55.475
4.364
3 讨论
TGF-β测定方法一般分为生物学、免疫学和放射受体测定法[3]。生物学测定法是通过TGF-β刺激或抑制敏感细胞株增殖、调节细胞基质形成、抗原表达程度来确定其活性和含量,该方法灵敏度高,比较真实反映了TGF-β生物活性特点,直观、可靠。一般常用大鼠肾成纤维细胞软琼脂克隆法和MV-1-Lu水貂肺上皮细胞(CCL-64)生长抑制法[5,6],所结合的3H-TdR和MTT法理论依据分别是:MTT法主要原理是线粒体琥珀酸脱氢酶能催化四甲基偶氮唑盐(MTT)形成蓝色甲,其形成量与细胞数量和功能状态呈正相关,用酶联仪在570 nm处测定Dλ值可以反映甲形成量,亦反映细胞的增殖量及状态。3H-TdR方法基于细胞增殖周期中DNA、RNA合成增加,3H-TdR能被作为原料摄入细胞,测定细胞内3H-TdR放射量,反映了细胞增殖情况,从而计算出抑制率与TGF-β活性含量的关系。
, 百拇医药
免疫学测定法基于TGF-β是蛋白质这一特点,用单抗或多克隆抗体结合ELISA或放射免疫测定法,一般操作简便,专一性强,且能区别不同亚型TGF-β的存在[7,8],该方法所反映的是全部TGF-β的情况,不能客观显示活性TGF-β的量,且不够稳定。放射受体测定法基于受体-配体结合的原理,测定包括潜活形式在内的各型TGF-β,极具专一性,但有接触同位素及重复性差等缺点[9]。
本研究选用水貂肺上皮细胞(CCL-64)生长抑制法测定活性TGF-β1,并将其3H-TdR掺入法与MTT法进行了比较,证明3H-TdR方法较MTT法灵敏度高、稳定性好,经济实惠,易于在TGF-β1检测方法中推广。
(本文得到第三军医大学医学统计学教研室尹全焕教授的指导和帮助,特此致谢!)
, 百拇医药 作者简介:李勇,男,31岁,主治医师,讲师,博士
参考文献
1 Roberts A B, Sporn M B. The transforming growth factor-beta. In: Sporn M B eds. Peptide growth fatcors and their receptors. Berlin: Springer Verlag,1990.417~419
2 李 勇,韩本立.TGF-β与器官移植.国外医学:创伤与外科基本问题分册,1995,16(4):196
3 虞冠华,许祥裕,丁树标.转化生长因子-β的测定.上海免疫学杂志,1995,15(2):116
4 龙建银,王会信,张宏权.人转化生长因子-β1 cDNA在COS-7细胞中的表达.生物化学杂志,1995,11(4):396
, http://www.100md.com
5 Rizzino A. Soft agar growth assays for transforming growth factors and mitogenic peptides. Methods Enxzymol,1987,146:341
6 Van Zoelen E J J, Van Oostward T M J, De Last S W. PDGF-like growth factor induces EGF-potentiated phenotypic transformign of normal rat kidney cells in the absence of TGF-β. Biochem Biophys Res Comm,1986,141(3):1229
7 Flanders K C, Roberts A B, Ling N, et al. Antibodies to peptide determinants in TGF-β and their applications. Biochem,1988,27(2):739
, http://www.100md.com
8 Ksander G A, Gerhardt C O, Dadch J R, et al. A novel polyconal antibody(CL-Bl/29) for immunoloculization of TGF-β in adult mouse. J Histochem Cytochem,1990,38(12):1831
9 Boyd F T, Cheifetz S, Andres J, et al. Transforming growth factor-β receptors and binding proteoglycans. J Cell Sci,1990,13(Suppl):131
(收稿:1998-09-05;修回:1998-12-29), 百拇医药