尿生殖窦间质诱导的鼠前列腺增生模型制备
作者:余帆 宋波 熊恩庆
单位:第三军医大学附属西南医院泌尿外科 重庆,400038
关键词:良性前列腺增生;疾病模型;动物
第三军医大学学报990220 Preparation of mice BPH model induced by urogenital sinus mesenchyme
提要 目的:探讨尿生殖窦间质对上皮生长的影响及诱导的鼠前列腺增生模型的研究。方法:应用前列腺增生中的间质-上皮相互作用理论,将BALB/C鼠胚胎尿生窦间质种植于同系成年雄鼠腹侧前列腺内。结果:形态学观察到前列腺湿重明显增加。病理呈良性前列腺增生改变。结论:本实验成功地制备了鼠前列腺增生模型。
中图法分类号 R332
, 百拇医药
良性前列腺增生(Benign prostate hyperplasia,BPH)是人类男性常见疾病,动物模型对其病因学研究及临床防治有重要意义。本实验用鼠胚胎尿生殖窦间质(Urogenital sinus mesenchyme,UGM)诱导鼠前列腺增生,建立BPH动物模型,探讨间质对上皮生长的影响并应用此模型进行深入研究。
1 材料和方法
1.1 尿生殖窦间质(UGM)的制备
方法:孕16~18 d的近交系BALB/C小鼠经脱颈离断处死,取出胚胎,在含在青霉素和链霉素的0℃~4℃ Dehank液中,于立体显微镜下微解剖,修剪掉胚胎膀胱,Wolffian和Mullerian管,剩下完整的尿生殖窦(Urogenital sinus,UGS)。将UGS置入1%的胰蛋白酶溶液中,4℃,消化120 min,以去掉上皮成分保留UGM。用含50%的小牛血清培养液清洗,终止胰蛋白酶的消化作用。制备好的UGM保存于Dehank培养液中,3 h内使用。整个操作过程均在无菌条件下进行[1]。
, 百拇医药
为验证制备的UGM符合本实验要求,将UGM作如下研究:①解剖显微镜下,观察UGM是否残留有Wolffian和Mullerian管等附属结构;②UGM连续切片,HE染色观察是否残存上皮成分;③为进一步证明消化后的UGM无上皮成分并具有活性,将UGM种植于同系雄鼠肾包膜下,四周后切取移植物,作连续切片,HE染色观察。
1.2 动物接种
成年雄性近交系BALB/C小鼠30只,随机分为:正常对照组,假手术组,UGM种殖组,每组10只。乙醚吸入麻醉,妥善将鼠固定于操作台。腹正中切开,暴露膀胱及腹侧前列腺,将制备好的UGM种植于腹侧前列腺内。假手术组除不种植UGM外,余步骤同上。
1.3 观察方法
接种后,普通喂养,30 d处死动物,取出腹侧前列腺,称其湿重,计算出各组前列腺湿重的平均值。前列腺标本用10%甲醛固定,石蜡包埋,切片,HE染色。
, http://www.100md.com
1.4 统计学处理
各组前列腺湿重以x±s表示,均数间比较采用t检验。
2 结果
2.1 制备的UGM
制备的UGM在解剖显微镜及下HE染色观察,无残存附属结构,无上皮细胞存在,见图1。UGM在肾包膜下长生四周后,切取并作HE染色观察,细胞形态与接种前一致,无腺样结构。进一步说明无上皮成分,并具有活性,符合本实验要求。
图1 制备的鼠UGM,无上皮成分 (HE×400)
2.2 前列腺生长情况,见表1
表1 各组前列腺生长对照 组别
, 百拇医药
小鼠
体重(g)
前列腺湿重(mg)
对照组
10
24.58±0.42
7.44±1.14
假手术组
10
24.46±0.56
7.56±1.16
UGM种植组
, http://www.100md.com 10
24.9±0.74
15.83±1.89△
△:P<0.01与对照及假手术组比较
2.3 HE染色观察
对照及假手术组病理表现基本相同,腺上皮呈单层低柱状,较小乳头状突起。腺体显管状,腺腔内少许分泌物,纤维间质较少。UGM种植组腺体及纤维组织增生,以腺体增生为主,腺腔圆形,腺上皮高柱状,有增生,形成较多乳头凸入腔内,腺腔内分泌物增多,纤维间质有增生,见图2。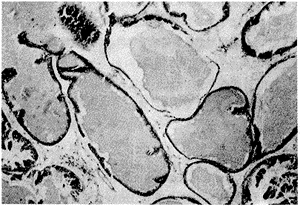
图2 UGM种植后前列腺 (HE×200)
, http://www.100md.com
3 讨论
3.1 BPH动物模型的构建
BPH动物模型对深入研究良性前列腺增生发病机制及防治有重要的意义。但在自然发生中,只有人和犬在随年龄变化中可能发生BPH。在以犬作BPH模型时,发现有以下不足:①犬的前列腺结构与人类有较大差别,如无腺体和平滑肌混合区域等;②在犬BPH中,仅含上皮成分的增生,无结节形成,无类似胚胎间质的基质改变,无形态学证据证明犬的BPH是胚胎重醒过程;③且诱导BPH时间较长[2]。Lee[3]在对鼠的腹侧前列腺研究时发现其导管系统可分为远段、中段、近段。远段的上皮为高柱状,基质单层平滑肌,而近端上皮为高平或低柱状,基质平滑肌数层。由于间质环境和上皮的这种区域性差异,构成了间质-上皮相互作用时,对雄激素的反应不同。远段腺上皮表现为增生,而近段上皮表现为凋亡。其结构特征和对雄激素的反应性与人尿道周围区和移行区有相似之处。而以鼠胚胎UGM诱导BPH发生的过程,又类似于人类BPH发生的胚胎重醒并能反应BPH发生中的间质-上皮相互作用机制[4]。因此以鼠BPH作为动物模型,可能较好地反应人BPH的发生,且其简便易行,重复性好,诱导时间短,对BPH病因探讨和防治研究有更好的价值。
, 百拇医药
3.2 本实验的特点及意义
本实验从胚胎鼠解剖分离出尿生殖窦,经胰蛋白酶消化后,去掉上皮成分保留UGM,经病理切片证实为间质细胞而无上皮细胞污染,将UGM种植于同系雄鼠肾包膜下一月,种植物切片观察,仍保持其间质细胞形态,未形成平滑肌和腺组织。制备的UGM符合本实验要求即具有胚胎特征和活性。当UGM种植于同系雄鼠腹侧前列腺即与前列腺上皮相联系时,在雄激素作用下,腺上皮表现出明显的增生,分泌活动增强,腺腔中分泌物明显增多。同时纤维间质也有增生。湿重增加。与正常鼠前列腺在形态学和组织学方面有显著差异。
本实验正是基于间质-上皮相互作用的理论,将具有胚胎诱导活性,且不含上皮成分的UGM种植于同系鼠腹侧前列腺内诱导其前列腺增生,成功地制备了前列腺增生的动物模型。同时也说明间质-上皮相互作用在BPH发生中有重要意义。
本实验所制备的动物模型对于理解BPH发生中的间质-上皮相互作用有其价值。对于BPH的防治研究也有其意义。相信随着研究的深入,动物模型的不断完善,BPH的病因揭示和防治将会取得更大进展。
, 百拇医药
作者简介:余帆,34岁,主治医师
参考文献
1 Miuer G J, Runner M N, Chung L W. Tissue interactions and prostatic growth Ⅱ:Morphological and biochemical characterization of adult mouse prostatic hyperplasia induced by fetal urogenital sinus implants. Prostate,1985,6(3):241
2 McNeal J E. Pathology of benign prostate hyperplasia:insight into etiology. Uro Clin North Amer,1990,17(5):477
, http://www.100md.com
3 Lee C, Seniba J A, Dudek S M, et al. Prostatic ductal system in rats regional variation in morphological and functional activities, Biol Reprrod,1990,43(6):1079
4 Cunha G R, Alarid E T, Turner T, et al. Normal and abnormal development of maleurogenifal tract: role of androgens, mesenchymal-epithelia interactions, and growth factors. J Androl,1992,13(6):465
(收稿:1998-07-04;修回:1998-12-10), 百拇医药
单位:第三军医大学附属西南医院泌尿外科 重庆,400038
关键词:良性前列腺增生;疾病模型;动物
第三军医大学学报990220 Preparation of mice BPH model induced by urogenital sinus mesenchyme
提要 目的:探讨尿生殖窦间质对上皮生长的影响及诱导的鼠前列腺增生模型的研究。方法:应用前列腺增生中的间质-上皮相互作用理论,将BALB/C鼠胚胎尿生窦间质种植于同系成年雄鼠腹侧前列腺内。结果:形态学观察到前列腺湿重明显增加。病理呈良性前列腺增生改变。结论:本实验成功地制备了鼠前列腺增生模型。
中图法分类号 R332
, 百拇医药
良性前列腺增生(Benign prostate hyperplasia,BPH)是人类男性常见疾病,动物模型对其病因学研究及临床防治有重要意义。本实验用鼠胚胎尿生殖窦间质(Urogenital sinus mesenchyme,UGM)诱导鼠前列腺增生,建立BPH动物模型,探讨间质对上皮生长的影响并应用此模型进行深入研究。
1 材料和方法
1.1 尿生殖窦间质(UGM)的制备
方法:孕16~18 d的近交系BALB/C小鼠经脱颈离断处死,取出胚胎,在含在青霉素和链霉素的0℃~4℃ Dehank液中,于立体显微镜下微解剖,修剪掉胚胎膀胱,Wolffian和Mullerian管,剩下完整的尿生殖窦(Urogenital sinus,UGS)。将UGS置入1%的胰蛋白酶溶液中,4℃,消化120 min,以去掉上皮成分保留UGM。用含50%的小牛血清培养液清洗,终止胰蛋白酶的消化作用。制备好的UGM保存于Dehank培养液中,3 h内使用。整个操作过程均在无菌条件下进行[1]。
, 百拇医药
为验证制备的UGM符合本实验要求,将UGM作如下研究:①解剖显微镜下,观察UGM是否残留有Wolffian和Mullerian管等附属结构;②UGM连续切片,HE染色观察是否残存上皮成分;③为进一步证明消化后的UGM无上皮成分并具有活性,将UGM种植于同系雄鼠肾包膜下,四周后切取移植物,作连续切片,HE染色观察。
1.2 动物接种
成年雄性近交系BALB/C小鼠30只,随机分为:正常对照组,假手术组,UGM种殖组,每组10只。乙醚吸入麻醉,妥善将鼠固定于操作台。腹正中切开,暴露膀胱及腹侧前列腺,将制备好的UGM种植于腹侧前列腺内。假手术组除不种植UGM外,余步骤同上。
1.3 观察方法
接种后,普通喂养,30 d处死动物,取出腹侧前列腺,称其湿重,计算出各组前列腺湿重的平均值。前列腺标本用10%甲醛固定,石蜡包埋,切片,HE染色。
, http://www.100md.com
1.4 统计学处理
各组前列腺湿重以x±s表示,均数间比较采用t检验。
2 结果
2.1 制备的UGM
制备的UGM在解剖显微镜及下HE染色观察,无残存附属结构,无上皮细胞存在,见图1。UGM在肾包膜下长生四周后,切取并作HE染色观察,细胞形态与接种前一致,无腺样结构。进一步说明无上皮成分,并具有活性,符合本实验要求。

图1 制备的鼠UGM,无上皮成分 (HE×400)
2.2 前列腺生长情况,见表1
表1 各组前列腺生长对照 组别
, 百拇医药
小鼠
体重(g)
前列腺湿重(mg)
对照组
10
24.58±0.42
7.44±1.14
假手术组
10
24.46±0.56
7.56±1.16
UGM种植组
, http://www.100md.com 10
24.9±0.74
15.83±1.89△
△:P<0.01与对照及假手术组比较
2.3 HE染色观察
对照及假手术组病理表现基本相同,腺上皮呈单层低柱状,较小乳头状突起。腺体显管状,腺腔内少许分泌物,纤维间质较少。UGM种植组腺体及纤维组织增生,以腺体增生为主,腺腔圆形,腺上皮高柱状,有增生,形成较多乳头凸入腔内,腺腔内分泌物增多,纤维间质有增生,见图2。

图2 UGM种植后前列腺 (HE×200)
, http://www.100md.com
3 讨论
3.1 BPH动物模型的构建
BPH动物模型对深入研究良性前列腺增生发病机制及防治有重要的意义。但在自然发生中,只有人和犬在随年龄变化中可能发生BPH。在以犬作BPH模型时,发现有以下不足:①犬的前列腺结构与人类有较大差别,如无腺体和平滑肌混合区域等;②在犬BPH中,仅含上皮成分的增生,无结节形成,无类似胚胎间质的基质改变,无形态学证据证明犬的BPH是胚胎重醒过程;③且诱导BPH时间较长[2]。Lee[3]在对鼠的腹侧前列腺研究时发现其导管系统可分为远段、中段、近段。远段的上皮为高柱状,基质单层平滑肌,而近端上皮为高平或低柱状,基质平滑肌数层。由于间质环境和上皮的这种区域性差异,构成了间质-上皮相互作用时,对雄激素的反应不同。远段腺上皮表现为增生,而近段上皮表现为凋亡。其结构特征和对雄激素的反应性与人尿道周围区和移行区有相似之处。而以鼠胚胎UGM诱导BPH发生的过程,又类似于人类BPH发生的胚胎重醒并能反应BPH发生中的间质-上皮相互作用机制[4]。因此以鼠BPH作为动物模型,可能较好地反应人BPH的发生,且其简便易行,重复性好,诱导时间短,对BPH病因探讨和防治研究有更好的价值。
, 百拇医药
3.2 本实验的特点及意义
本实验从胚胎鼠解剖分离出尿生殖窦,经胰蛋白酶消化后,去掉上皮成分保留UGM,经病理切片证实为间质细胞而无上皮细胞污染,将UGM种植于同系雄鼠肾包膜下一月,种植物切片观察,仍保持其间质细胞形态,未形成平滑肌和腺组织。制备的UGM符合本实验要求即具有胚胎特征和活性。当UGM种植于同系雄鼠腹侧前列腺即与前列腺上皮相联系时,在雄激素作用下,腺上皮表现出明显的增生,分泌活动增强,腺腔中分泌物明显增多。同时纤维间质也有增生。湿重增加。与正常鼠前列腺在形态学和组织学方面有显著差异。
本实验正是基于间质-上皮相互作用的理论,将具有胚胎诱导活性,且不含上皮成分的UGM种植于同系鼠腹侧前列腺内诱导其前列腺增生,成功地制备了前列腺增生的动物模型。同时也说明间质-上皮相互作用在BPH发生中有重要意义。
本实验所制备的动物模型对于理解BPH发生中的间质-上皮相互作用有其价值。对于BPH的防治研究也有其意义。相信随着研究的深入,动物模型的不断完善,BPH的病因揭示和防治将会取得更大进展。
, 百拇医药
作者简介:余帆,34岁,主治医师
参考文献
1 Miuer G J, Runner M N, Chung L W. Tissue interactions and prostatic growth Ⅱ:Morphological and biochemical characterization of adult mouse prostatic hyperplasia induced by fetal urogenital sinus implants. Prostate,1985,6(3):241
2 McNeal J E. Pathology of benign prostate hyperplasia:insight into etiology. Uro Clin North Amer,1990,17(5):477
, http://www.100md.com
3 Lee C, Seniba J A, Dudek S M, et al. Prostatic ductal system in rats regional variation in morphological and functional activities, Biol Reprrod,1990,43(6):1079
4 Cunha G R, Alarid E T, Turner T, et al. Normal and abnormal development of maleurogenifal tract: role of androgens, mesenchymal-epithelia interactions, and growth factors. J Androl,1992,13(6):465
(收稿:1998-07-04;修回:1998-12-10), 百拇医药