麝香酮的人工合成进展与展望
作者:陈望忠 焦克芳
单位:军事医学科学院毒物药物研究所, 北京,100850
关键词:麝香酮;2;15-十六烷二酮;环十二烷酮;环十五烷酮
摘要摘要:对1990年以来有关麝香酮的合成进展和今后的展望作一概述。
中图分类号:R965.2
有关麝香酮合成的文献几可汇集成卷[1],但其合成主要通过三条途径实现:(1) a ,w -双官能团化合物的分子内关环;(2) 环十二烷酮扩环;(3) 环十五烷酮的甲基化。现就1990年以来在这三方面合成进展和今后的展望作一概述。
, http://www.100md.com
1 a ,w -双官能团化合物的分子内关环
这是合成麝香酮较早也是较常用的方法,由于使用的双官能团化合物的制备步骤多及分子内环合时方位选择性低等原因,总产率往往较低。
1.1 消旋麝香酮的合成 由于10-十一碳烯酸来源于价廉易得的蓖麻油的主要水解产物,Mhaskar等[2]以它为起始原料合成消旋麝香酮(1)。但该反应步骤长,自由基加成和环合反应的产率较低,且其间所需的试剂制备较困难,总产率也只有7.7%。李全等[3]以10-十一烯酸和丙酮为原料合成2,15-十六烷二酮(2),整条路线较简短,但产率较低(14% )。Takahashi等[4]用双阴离子的分子内环合方法合成1,但反应步骤长,起始原料不易获得,分子中双键的位置、构型对环合收率有很大影响。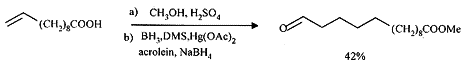
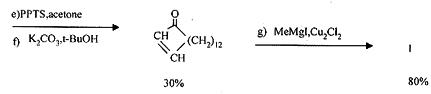
, 百拇医药
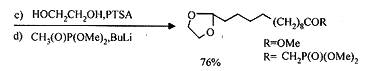
有关a ,w -双官能团化合物的分子内环合合成麝香酮的反应中,最受关注的是由Stoll[5]提出以1,10-二溴癸烷和乙酰乙酸乙酯为原料合成2,再将2经分子内醛醇缩合合成麝香酮的路线。因为在环合获得十五元环的同时在3位引入了甲基,且原料价廉易得,步骤简短,所以很具吸引力。但存在2的合成反应时间长、产率低(30%)以及环合反应条件苛刻等问题,曾限制了它的应用。我们[6,7] 通过对反应机理的分析,改进了反应条件,使2的产率达到了82% 以上,原料价廉易得,操作安全简单,较好地解决了已存在了四十多年的2的合成困难问题。
对于2的分子内环合,以前基本采用镁、铝、锌的有机金属试剂作关环试剂,但该类反应使用大稀释的方法,对溶剂的无水条件要求苛刻,不适合工业化生产。我们[8]以Al2O3为催化剂进行2的分子内环合,建立了一种新的非均相催化合成麝香酮的方法,反应条件温和,但转化率有待于进一步提高。
, 百拇医药
1.2 光活性麝香酮的合成 利用不对称催化环合、非对映选择共轭加成合成光活性的麝香酮是近年来报道的双官能团化合物环合的一种新方法。已报道手性的反式-1,2-环己二醇与a ,b -不饱和酸形成的酯在有机铜试剂作用下,能进行非对映选择性高的共轭加成,如发生分子内反应,则可非对映选择性地合成反式加成的环合产物。
Ogawa等[9]以十四二酸二乙酯和(R,R)-环己-1,2-二醇为原料生成20员环的a ,b -不饱和酯,再经分子内缩合等反应合成3。利用硼烷与炔烃的加成生成反式单取代的烯烃,再与二乙基锌生成(E)-(1-烯基)乙基锌化合物,在手性诱导剂作用下,它与醛C=O的p 平面对映选择加成生成光学活性的醇。Oppolzer等[10]利用(1S)-(+)-(二甲胺基)异冰片(DAIB)的手性诱导作用,催化w -炔醛的烯基乙基锌化合物的分子内环合,再经一系列反应合成3。
2 环十二烷酮的扩环
, 百拇医药
三碳扩环是由Firmenich实验室发展起来的巧
妙方法,它包括由环十二烷酮(4)形成的二环[10.3.0]十五烷(或十五烯)化合物的桥键断裂。鉴于4为石油工业副产品,价廉易得,以它为原料在其a 位引入一个取代的异丁基(或甲基丙烯)结构侧链再进行扩环的研究很活跃,特别是选择手性的异丁基侧链进行麝香酮的不对称合成更是一个热门课题。
以3-氯-2-甲基丙烯为构建侧链模块与3反应,先转化为碘化物,再用三(正丁基)氢化锡引发碘化物的自由基扩环等反应合成1,由于存在此碘化物被直接还原的竞争反应,此自由基扩环反应的产率很低[11]。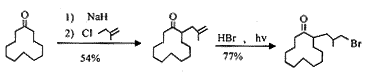

, http://www.100md.com
如以(S)-3-溴-2-甲基丙醇为构建侧链模块可合成化合物3[11]。
由于C-Se键能较C-I键能低,更易于形成自由基,王大升等[12]使用相应的苯硒基侧链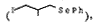 经自由基扩环合成1和3,总产率分别提高到51%和32%。该反应的缺点是苯硒基侧链的合成成本较高和扩环一步要求无水和隔绝空气。
经自由基扩环合成1和3,总产率分别提高到51%和32%。该反应的缺点是苯硒基侧链的合成成本较高和扩环一步要求无水和隔绝空气。
3 环十五烷酮甲基化
Tanaka等[13]以手性的有机铜试剂对(E)-2-环十五烯-1-酮进行对映选择性高的甲基化,生成R-麝香酮(3), 手性的有机铜试剂由D-樟脑与CuI等合成。研究发现,如加入少量的THF到手性试剂中[14],可获得近100%的对映体过量(e.e)。如以L-樟脑生成的有机铜配合物催化,则可得到S-(+)-麝香酮。(E)-2-环十五烯-1-酮可由文献方法制备[15]。
, http://www.100md.com
在消旋麝香酮的合成中,可以将得到的中间体 3-甲基环十五-2-烯酮的两种顺反异构体通过硅胶柱层析分离[16],使用Ru-手性膦配合物作不对称氢化催化剂对(E)-3-甲基环十五-2-烯酮进行不对称氢化得到R-1,产率为95%,这不失为一个好的合成光活性麝香酮的方法[17]。
以环十五烷酮为原料经溴化、脱溴化氢、甲基化三步反应得1,总产率为85%[18]。
4 展望
麝香酮的人工合成历史悠久,前景广阔。有关的新试剂,新合成技巧的不断出现,丰富和发展了有机化学的理论和方法。a ,w -双官能团化合物的分子内环合反应研究仍很热门,除2,15-十六烷二酮的合成以外,以前存在的有关 a ,w -双官能团化合物的合成步骤长、产率低等问题仍然没有得到解决。在2,15-十六烷二酮的合成取得突破以后,发展新的环合试剂研究它的分子内醛醇缩合有更加重要的理论意义和实际应用价值; 由于环十二烷酮的价格较便宜,利用三碳扩环合成麝香酮的方法具有一定的发展前景,探索简单、经济地合成易进行自由基扩环的侧链模块(building blocks)和避免使用昂贵的扩环试剂是环十二烷酮扩环走向工业化的关键;尽管环十五烷酮的来源逐渐丰富,但到目前为止其价格仍然很高,研究其甲基化在理论上有重要意义,而其实际应用价值仍受制于环十五烷酮的来源和价格。在环十五烷酮尤其是环十二烷酮来源逐渐丰富、新的手性有机金属试剂不断出现的背景下,三碳扩环方法和不对称催化氢化均将取得更具实用性的进展。
, 百拇医药
参考文献
陈望忠, 陈邦华, 焦克芳.人工合成麝香酮进展. 中国医药工业杂志,1992, 23(1):37Mhaskar SY, Subbarao R. Synthesis of (R,S)-muscone from 10-undecenoic acid.J Am Oil Chem Soc, 1992, 69(8):837 李 全,刘复初. 麝香酮合成的新路线. 合成化学, 1997, 5(增刊):350Takahashi T, Yamade H, Haino T et al. Dianion methodology for the construction of large-membered ring synthesis: Application to the synthesis of muscone. Tetra Lett, 1992, 33(49):7561Stoll M, Rouve A. New synthesis of muscone. Helv Chim Acta, 1947,30:2019(CA42:3742d) 焦克芳, 陈望忠, 李新胜. 2,15 - 十六烷二酮的合成方法. 中国专利, ZL 91109897 陈望忠, 焦子夏, 焦克芳. 2,15- 十六烷二酮的合成. 化学通报, 1998,3:42 陈望忠, 焦克芳. 麝香酮合成的新方法. 化学通报, 1998,2:44Ogawa T, Fang CL, Suemune H. Asymmetric syntheses of (R)-(-)-muscone based on diastereoselective conjugate addition. J Chem. Soc Chem Commun, 1991,20:1438Oppolzer W, Radinov RN. Synthesis of R-(-)-muscone by an asymmetrically catalyzed macrocyclization of an w -alkynal. J Am Chem Soc, 1993,115:1593Dowd P, Choi SC. Homologation of large rings. Tetra, 1992,48(23):4773 王大升, 王道全, 周长海. ( + ) 麝香酮和(R)-麝香酮的自由基扩环合成法. 化学学报, 1995,53:909Tanaka K, Ushio H. Asymmetric synthesis of (R)-muscone by enantioselective addition of chiral methyl cuprate to (E)-2-cyclopen-tadecen-1-one. J Chem Soc Chem Commun, 1990,11:795Tanaka K, Matsui J, Suzuki H. Chiral amplication and the catalytic process in the enantioselective conjugate addition of chiral alkoxyolimethylcuprate to(E)-cyclopentadec-2-en-1-one. J Chem Soc Perkin trans 1,1993,1:153Tanaka K, Ushio H, Kawabata Y et al. Asymmetric synthesis of (R)-(-) and (S)-(+)-muscone by enantioselective conjugate addition of chiral dimethylcuprate to (E)-cyclopentadec-2-en-1-one. J Chem Soc Perkin trans 1,1991,6:1445 陈望忠, 焦克芳, 谢云德. 2,15-十六烷二酮环合反应的研究. 中国医药工业杂志, 1997, 28(9):421Saneji O, Takeshi Y. Prepn. of optically-active muscone using rutheniumphosphine complexes as asymmetric hydrogenation catalysts. Jpn. Kokai Tokkyo Koho JP 06,192,161[94,192,161]Im DS, Shin DH, Park DK. Newer short synthesis of (+)-muscone. J Korean Chem Soc, 1996,40(4):243 (Korean)(收稿日期:1998-11-06), 百拇医药
单位:军事医学科学院毒物药物研究所, 北京,100850
关键词:麝香酮;2;15-十六烷二酮;环十二烷酮;环十五烷酮
摘要摘要:对1990年以来有关麝香酮的合成进展和今后的展望作一概述。
中图分类号:R965.2
有关麝香酮合成的文献几可汇集成卷[1],但其合成主要通过三条途径实现:(1) a ,w -双官能团化合物的分子内关环;(2) 环十二烷酮扩环;(3) 环十五烷酮的甲基化。现就1990年以来在这三方面合成进展和今后的展望作一概述。

, http://www.100md.com
1 a ,w -双官能团化合物的分子内关环
这是合成麝香酮较早也是较常用的方法,由于使用的双官能团化合物的制备步骤多及分子内环合时方位选择性低等原因,总产率往往较低。
1.1 消旋麝香酮的合成 由于10-十一碳烯酸来源于价廉易得的蓖麻油的主要水解产物,Mhaskar等[2]以它为起始原料合成消旋麝香酮(1)。但该反应步骤长,自由基加成和环合反应的产率较低,且其间所需的试剂制备较困难,总产率也只有7.7%。李全等[3]以10-十一烯酸和丙酮为原料合成2,15-十六烷二酮(2),整条路线较简短,但产率较低(14% )。Takahashi等[4]用双阴离子的分子内环合方法合成1,但反应步骤长,起始原料不易获得,分子中双键的位置、构型对环合收率有很大影响。
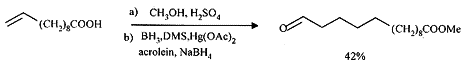

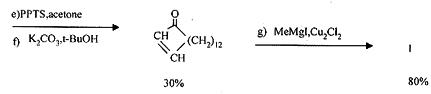
, 百拇医药
有关a ,w -双官能团化合物的分子内环合合成麝香酮的反应中,最受关注的是由Stoll[5]提出以1,10-二溴癸烷和乙酰乙酸乙酯为原料合成2,再将2经分子内醛醇缩合合成麝香酮的路线。因为在环合获得十五元环的同时在3位引入了甲基,且原料价廉易得,步骤简短,所以很具吸引力。但存在2的合成反应时间长、产率低(30%)以及环合反应条件苛刻等问题,曾限制了它的应用。我们[6,7] 通过对反应机理的分析,改进了反应条件,使2的产率达到了82% 以上,原料价廉易得,操作安全简单,较好地解决了已存在了四十多年的2的合成困难问题。
对于2的分子内环合,以前基本采用镁、铝、锌的有机金属试剂作关环试剂,但该类反应使用大稀释的方法,对溶剂的无水条件要求苛刻,不适合工业化生产。我们[8]以Al2O3为催化剂进行2的分子内环合,建立了一种新的非均相催化合成麝香酮的方法,反应条件温和,但转化率有待于进一步提高。

, 百拇医药
1.2 光活性麝香酮的合成 利用不对称催化环合、非对映选择共轭加成合成光活性的麝香酮是近年来报道的双官能团化合物环合的一种新方法。已报道手性的反式-1,2-环己二醇与a ,b -不饱和酸形成的酯在有机铜试剂作用下,能进行非对映选择性高的共轭加成,如发生分子内反应,则可非对映选择性地合成反式加成的环合产物。
Ogawa等[9]以十四二酸二乙酯和(R,R)-环己-1,2-二醇为原料生成20员环的a ,b -不饱和酯,再经分子内缩合等反应合成3。利用硼烷与炔烃的加成生成反式单取代的烯烃,再与二乙基锌生成(E)-(1-烯基)乙基锌化合物,在手性诱导剂作用下,它与醛C=O的p 平面对映选择加成生成光学活性的醇。Oppolzer等[10]利用(1S)-(+)-(二甲胺基)异冰片(DAIB)的手性诱导作用,催化w -炔醛的烯基乙基锌化合物的分子内环合,再经一系列反应合成3。
2 环十二烷酮的扩环
, 百拇医药
三碳扩环是由Firmenich实验室发展起来的巧
妙方法,它包括由环十二烷酮(4)形成的二环[10.3.0]十五烷(或十五烯)化合物的桥键断裂。鉴于4为石油工业副产品,价廉易得,以它为原料在其a 位引入一个取代的异丁基(或甲基丙烯)结构侧链再进行扩环的研究很活跃,特别是选择手性的异丁基侧链进行麝香酮的不对称合成更是一个热门课题。
以3-氯-2-甲基丙烯为构建侧链模块与3反应,先转化为碘化物,再用三(正丁基)氢化锡引发碘化物的自由基扩环等反应合成1,由于存在此碘化物被直接还原的竞争反应,此自由基扩环反应的产率很低[11]。


, http://www.100md.com
如以(S)-3-溴-2-甲基丙醇为构建侧链模块可合成化合物3[11]。
由于C-Se键能较C-I键能低,更易于形成自由基,王大升等[12]使用相应的苯硒基侧链
3 环十五烷酮甲基化
Tanaka等[13]以手性的有机铜试剂对(E)-2-环十五烯-1-酮进行对映选择性高的甲基化,生成R-麝香酮(3), 手性的有机铜试剂由D-樟脑与CuI等合成。研究发现,如加入少量的THF到手性试剂中[14],可获得近100%的对映体过量(e.e)。如以L-樟脑生成的有机铜配合物催化,则可得到S-(+)-麝香酮。(E)-2-环十五烯-1-酮可由文献方法制备[15]。
, http://www.100md.com
在消旋麝香酮的合成中,可以将得到的中间体 3-甲基环十五-2-烯酮的两种顺反异构体通过硅胶柱层析分离[16],使用Ru-手性膦配合物作不对称氢化催化剂对(E)-3-甲基环十五-2-烯酮进行不对称氢化得到R-1,产率为95%,这不失为一个好的合成光活性麝香酮的方法[17]。
以环十五烷酮为原料经溴化、脱溴化氢、甲基化三步反应得1,总产率为85%[18]。
4 展望
麝香酮的人工合成历史悠久,前景广阔。有关的新试剂,新合成技巧的不断出现,丰富和发展了有机化学的理论和方法。a ,w -双官能团化合物的分子内环合反应研究仍很热门,除2,15-十六烷二酮的合成以外,以前存在的有关 a ,w -双官能团化合物的合成步骤长、产率低等问题仍然没有得到解决。在2,15-十六烷二酮的合成取得突破以后,发展新的环合试剂研究它的分子内醛醇缩合有更加重要的理论意义和实际应用价值; 由于环十二烷酮的价格较便宜,利用三碳扩环合成麝香酮的方法具有一定的发展前景,探索简单、经济地合成易进行自由基扩环的侧链模块(building blocks)和避免使用昂贵的扩环试剂是环十二烷酮扩环走向工业化的关键;尽管环十五烷酮的来源逐渐丰富,但到目前为止其价格仍然很高,研究其甲基化在理论上有重要意义,而其实际应用价值仍受制于环十五烷酮的来源和价格。在环十五烷酮尤其是环十二烷酮来源逐渐丰富、新的手性有机金属试剂不断出现的背景下,三碳扩环方法和不对称催化氢化均将取得更具实用性的进展。
, 百拇医药
参考文献
陈望忠, 陈邦华, 焦克芳.人工合成麝香酮进展. 中国医药工业杂志,1992, 23(1):37Mhaskar SY, Subbarao R. Synthesis of (R,S)-muscone from 10-undecenoic acid.J Am Oil Chem Soc, 1992, 69(8):837 李 全,刘复初. 麝香酮合成的新路线. 合成化学, 1997, 5(增刊):350Takahashi T, Yamade H, Haino T et al. Dianion methodology for the construction of large-membered ring synthesis: Application to the synthesis of muscone. Tetra Lett, 1992, 33(49):7561Stoll M, Rouve A. New synthesis of muscone. Helv Chim Acta, 1947,30:2019(CA42:3742d) 焦克芳, 陈望忠, 李新胜. 2,15 - 十六烷二酮的合成方法. 中国专利, ZL 91109897 陈望忠, 焦子夏, 焦克芳. 2,15- 十六烷二酮的合成. 化学通报, 1998,3:42 陈望忠, 焦克芳. 麝香酮合成的新方法. 化学通报, 1998,2:44Ogawa T, Fang CL, Suemune H. Asymmetric syntheses of (R)-(-)-muscone based on diastereoselective conjugate addition. J Chem. Soc Chem Commun, 1991,20:1438Oppolzer W, Radinov RN. Synthesis of R-(-)-muscone by an asymmetrically catalyzed macrocyclization of an w -alkynal. J Am Chem Soc, 1993,115:1593Dowd P, Choi SC. Homologation of large rings. Tetra, 1992,48(23):4773 王大升, 王道全, 周长海. ( + ) 麝香酮和(R)-麝香酮的自由基扩环合成法. 化学学报, 1995,53:909Tanaka K, Ushio H. Asymmetric synthesis of (R)-muscone by enantioselective addition of chiral methyl cuprate to (E)-2-cyclopen-tadecen-1-one. J Chem Soc Chem Commun, 1990,11:795Tanaka K, Matsui J, Suzuki H. Chiral amplication and the catalytic process in the enantioselective conjugate addition of chiral alkoxyolimethylcuprate to(E)-cyclopentadec-2-en-1-one. J Chem Soc Perkin trans 1,1993,1:153Tanaka K, Ushio H, Kawabata Y et al. Asymmetric synthesis of (R)-(-) and (S)-(+)-muscone by enantioselective conjugate addition of chiral dimethylcuprate to (E)-cyclopentadec-2-en-1-one. J Chem Soc Perkin trans 1,1991,6:1445 陈望忠, 焦克芳, 谢云德. 2,15-十六烷二酮环合反应的研究. 中国医药工业杂志, 1997, 28(9):421Saneji O, Takeshi Y. Prepn. of optically-active muscone using rutheniumphosphine complexes as asymmetric hydrogenation catalysts. Jpn. Kokai Tokkyo Koho JP 06,192,161[94,192,161]Im DS, Shin DH, Park DK. Newer short synthesis of (+)-muscone. J Korean Chem Soc, 1996,40(4):243 (Korean)(收稿日期:1998-11-06), 百拇医药