急性坏死性胰腺炎早期肠源性感染的实验研究*
作者:吴承堂 黎沾良 黄祥成 齐德林 张志凌
单位:第一军医大学1南方医院普外科,广州,510515;解放军304医院外科,北京,100037;中医系外科教研室,广州,510515
关键词:急性坏死性胰腺炎;细菌移位;肠屏障功能;质粒;胰腺感染
第一军医大学学报990204 摘要:目的 通过PUC18质粒载体菌(JM109)示踪法,观察急性坏死性胰腺炎(ANP)时肠屏障损伤与肠道细菌移位情况,探讨ANP继发感染的机理。方法 杂种犬15只于定植PUC18质粒菌JM109后,分ANP组(n=8)和对照组(n=7)。采用气相色谱法测定尿中甘露醇和乳果糖的含量;测定血中二胺氧化酶(DAO)活性和内毒素(LPS)浓度;每日血培养;第7天活杀后,各组脏器标本作细菌培养,肠粘膜菌群分析,所有耐氨苄青霉素菌作质粒DNA分析。结果 ANP犬肠粘膜上皮绒毛破损,肠通透性显著增加,血浆DAO活性下降,肠道微生态出现明显紊乱,血和脏器出现细菌移位,血中LPS浓度升高1~3倍,ANP犬胰腺中PUC18质粒菌移位率为87.5%。结论 本研究提示,ANP后肠屏障功能严重受损,发生肠道细菌移位,肠源性感染是ANP继发感染的根源。
, 百拇医药
中图分类号:R576
An experimental study on the pathogenesis of enteric infection complicating impairment of the gut barrier function in acute necrotizing pancreatitis
Wu Chengtang1, Li Zhanliang2, Huang Xiangcheng1, Qi Delin1, Zhang Zhiling3
1Department of General Surgery, Nanfang Hospital, First Military Medical University, Guangzhou, 510515; 2 Department of General Surgery of 304th Hospital of PLA, Beijing, 100037; 3Surgical Department of Traditional Chinese Medicine Faculty, First Military Medical University, Guangzhou, 510515
, 百拇医药
Abstract: Objective To observe the injury of gut barrier function and intestinal bacterial translocation (BT) subsequent to acute necrotizing pancreatitis (ANP). Methods Fifteen dogs were colonized with a strain of E.coli JM109 bearing ampicillin-resistance plasmid PUC18 and then divided into two groups. In ANP group (n=8), acute necrotizing pancreatitis was induced, while in the control group (n=7), there was simple laparotomy only. Gas chromatography was applied to determine the levels of lactulose and mannitol in the urine. Blood samples were cultured every day. The level of diamine oxidase, LPS and amylase in blood were studied. All animals were sacrificed on day 7. Tissues of organs were collected for histological and microbiological studies. PUC18 plasmid vector tracing with restriction map analysis was used for ampicillin-resistance germ. Results It was shown that ANP induced impairment of the gut barrier function, the manifestation of which included damage of epithelial villi of the mucosa, significant increase in intestinal permeability, a decrease of diamine oxidase activity in blood, and microecologic disorder in the gut with overgrowth of gram-negative germs, especially E.coli, and reversed bifidobacterium/E.coli (B/E) ratio, as a result, bacterial translocation was found in organs and blood. The levels of plasma LPS increased 1-3 times. E.coli JM109 refound in pancreas of ANP group in 87.5%. Conclusion The results suggest that injury of the intestinal mucosa might take place soon after the onset of ANP, which could lead to BT from the intestine to pancreas and other organs, and become the source of pancreatic infection.
, http://www.100md.com
Key words: acute necrotizing pancreatitis; bacterial translocation; pancreatic infection; plasmid; gut barrier function
自Fitz于1889年提出胰腺感染以来,由于其发病凶险,死亡率高而受到人们的广泛关注。据统计,目前临床上因胰腺炎死亡的病人80%是由于感染所致[1] 。临床和实验研究均已证实,从感染胰腺中培养出来的细菌与肠道细菌相一致,肠道细菌移位可能是胰腺感染的根源[2,3]。胰腺感染最早出现在胰腺炎发病后1~2周[3],但有关胰腺炎早期肠粘膜屏障功能状况与肠道细菌移位关系尚未见报道。本研究采用PUC18质粒载体(JM109)示踪加限制性内切酶指纹图谱分析方法,探讨ANP后肠粘膜屏障功能变化与肠道细菌移位情况,旨在从分子水平上阐明急性坏死性胰腺炎(ANP)早期肠源性感染的发生机理。
, 百拇医药
1 材料与方法
1.1 动物分组与模型制作 杂种犬15只,体质量(15±2)kg,雌雄不拘。所有犬购进后粪便培养未见耐氨苄青霉素药菌生长,给予庆大霉素(2万U.kg-1..d-1×2 d)喂服,第3天起喂服浓度为1012 CFU/L的示踪菌PUC18质粒菌JM109 (对氨苄青霉素耐药的大肠杆菌,军事医学科学院沈倍奋院士惠赠),连喂2 d (20 ml.kg-1..d-1),服菌期间动物自由饮水(含氨苄青霉素100 mg/L),第5天起连续3 d采集粪便标本在含氨苄青霉素(100 mg/L)培养基上培养,对生长的耐药菌进行质粒分析,证实质粒菌已定植肠道。随后将犬随机分为对照组(n=7)和ANP组(n=8)。硫苯妥钠(30 mg/kg)静脉麻醉后,无菌下经上腹正中切口入腹,暴露十二指肠并向后翻转,沿其系膜缘找到主胰管。对照组仅用手触及胰腺,ANP组以7.64 kPa恒定压力经主胰管注入5%牛磺胆酸钠(0.5 ml/kg)和胰蛋白酶(3 000 U/kg),复制ANP模型。
, 百拇医药
1.2 检测指标
1.2.1 肠通透性 分别于手术后第1、2、4、7天各给犬灌服5%甘露醇和10%乳果糖混合液100 ml,收集6 h尿,参照Dumas法[4],对尿中乳果糖和甘露醇作肟化和硅烷化处理后,采用气相色谱法测定尿中两种糖的含量,并以尿中乳果糖/甘露醇(L/M)表示肠通透性的大小[5] 。
1.2.2 血浆二胺氧化酶(DAO)活性和血清胰淀粉酶(AMY) 血浆DAO采用分光光度法、血清AMY采用碘-淀粉法测定。
1.2.3 血浆内毒素(LPS)测定 鲎试剂基质显色定量测定血中内毒素浓度。
1.2.4 病理学检查 切取胰腺及回肠组织,作光镜和电镜观察。
1.3 细菌培养与鉴定1.3.1 细菌培养 术后每天抽血2 ml作细菌培养。1.3.2 细菌鉴定 第7天活杀后,无菌剪取肝、胰、脾、肺、肾及肠系膜淋巴结(MLN),匀浆后作细菌培养;无菌剪取空、回、盲肠标本,匀浆,取10μl接种至E.coli、肠球菌、双歧杆菌、类杆菌和乳杆菌5种选择性平板;需氧菌37℃培养24 h、厌氧菌37℃厌氧箱中培养48 h后计数;根据细菌生长的特点、菌落和生化反应等分别鉴定需氧菌和厌氧菌。1.4 质粒检测 血及各脏器匀浆后在含氨苄青霉素(100 mg/L)的LB培养基中振荡培养24 h,培养阳性者采用碱裂解法提取细菌质粒DNA(示踪菌JM109一起作阳性对照),提取物用限制性内切酶ECORⅠ(美国Sigma公司产品)于37℃水浴中消化1 h,取10μl消化产物用0.8%琼脂糖凝胶电泳(λDNA/HindⅢ为美国Sigma公司产品),溴化乙锭核酸染色,长波紫外线下观察并摄像[6]。
, http://www.100md.com
1.5 统计学处理 数据作t检验,结果以
 ±s表示。
±s表示。
2 结果
2.1 病理 ANP组大体所见,胰腺明显肿大、变硬,有暗黑或灰白坏死区。光镜下胰腺腺泡细胞大片出血、坏死,部分胞核溶解消失,坏死胰腺组织周围有大量中性白细胞浸润。回肠标本大体可见肠粘膜糜烂,粘膜散在出血点,光镜下可见明显的粘膜出血、水肿,绒毛部分脱落,上皮破损处见大量细菌侵入(图1)。对照组胰腺及肠粘膜未见异常,肠粘膜绒毛完整,未见细菌侵入(图2)。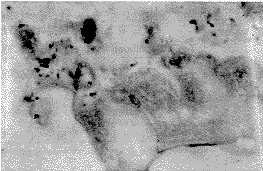
图1 ANP组犬肠粘膜绒毛破损,上皮脱落处可见细菌侵入
, http://www.100md.com
Fig. 1 Villus of intestinal mucosa was destructive and bacteria were found to invade in ANP dog (Goodpasteur×1000)
图2 对照组犬肠粘膜绒毛完整,未见细菌侵入
Fig. 2 Villus of intestinal mucosa was intact and bacteria were not found to invade in control dog (Goodpasteur×1000)
2.2 肠通透性 胰腺炎组发病后第1、2、4、7天尿中乳果糖均明显高于对照组(P<0.01),各天L/M比值高出对照组2~12倍,以第2天最为明显,至7 d后逐渐下降(表1)。
, http://www.100md.com
表1 尿中乳果糖和甘露醇含量(mg)及乳果糖/甘露醇比值(L/M)t
Tab. 1 Levels of lactulose, mannitol and ratio of lactulose/manniol(L/M) in urine Groups
Lactulose
Mannitol
L/M
Control
d 1
7.22±1.83
239.57±23.39
, http://www.100md.com
0.029±0.006
d 2
7.80±1.93
227.10±32.12
0.035±0.009
d 4
6.83±1.11
222.19±26.45
0.031±0.007
d 7
8.19±1.79
234.71±16.91
, 百拇医药
0.033±0.007
ANP
d 1
51.14±14.34**
172.50±26.92*
0.231±0.073**
d 2
81.74±20.95**
209.55±29.34
0.472±0.118**
d 4
49.68±19.44**
, 百拇医药
219.25±39.58
0.251±0.062**
d 7
27.94±8.87**
222.37±34.19
0.105±0.024*
* P<0.05 ** P <0.01 vs the control group
2.3 肠道微生态 粘膜菌群中的大肠杆菌计数比对照组增加10~300倍,以空、回肠粘膜为明显(P<0.01);而双歧杆菌及乳杆菌的计数则明显下降,以回、盲肠粘膜为甚(P<0.01);空、回和盲肠粘膜条件致病菌-类杆菌亦见显著增加;空、回、盲肠粘膜B/E比值严重倒置(P<0.05)(表2)。
, http://www.100md.com
表2 肠粘膜菌群计数(CFUlogn/g)及双歧杆菌/大肠杆菌比值(B/E)
Tab. 2 Population levels of mucosal (CFU log n/g) and ratio of bifidobacterium/E.Coli (B/E)
Content
Group
E.coli
Enterococcus
Bacteriod
Bifidobacterium
Lactobacillus
, 百拇医药
B/E
Jejunum
Control
1.91±0.49
1.69±0.79
2.23±0.92
2.35±0.79
1.83±0.64
1.23±0.53
ANP
3.42±0.93**
0**
, 百拇医药
3.75±0.77*
1.75±0.95*
1.13±0.80
0.51±0.76*
Ileum
Control
3.51±0.84
2.05±0.44
3.61±1.06
3.87±1.05
3.79±1.11
1.16±0.82
, http://www.100md.com
ANP
5.80±1.27**
1.17±0.95*
4.35±0.98*
2.89±0.86*
1.78±0.79**
0.62±0.68*
Cecum
Control
4.74±0.93
2.61±0.77
3.54±0.99
, 百拇医药
4.89±0.87
3.24±0.84
1.03±0.63
ANP
5.88±1.18*
1.27±1.04*
4.01±1.10
2.70±0.88**
2.81±0.73*
0.46±0.44*
* P<0.05, ** P<0.01 vs the control group
, 百拇医药
2.4 血浆LPS ANP组各时间点血浆LPS均明显高于对照组(表3)。
表3 血浆LPS变化(Eu/L)
Tab.3 The changes of plasma LPS
Groups
d 1
d 2
d 4
d 7
Control
68±5
74±8
, 百拇医药
64±9
66±7
ANP
217±85**
346±127**
268±54**
107±64*
* P<0.05, ** P <0.01 vs the control group
2.5 细菌移位 血及脏器细菌培养,胰腺炎犬全部脏器均发生细菌移位(表4)。血培养全部阳性,发病后第1、2天(6/8和5/8)阳性率最高。
表4 各脏器细菌移位阳性犬数(只)
, http://www.100md.com
Tab.4 Positive rate of bacteria translocated to dog organs
Groups
n
Pancreas
Liver
Lung
Kidney
Spleen
MLN
Control
7
, 百拇医药
0
0
0
0
0
2(0)
ANP
8
7(6)
7(4)
6(3)
6(3)
4(0)
, 百拇医药 8(2)
(n) means that E.coli JM109 bearing plasmid PUC18 was positive
2.6 质粒DNA分析 胰腺炎犬全部均能分离出耐氨苄青霉素的大肠杆菌,经质粒DNA提取和限制性内切酶分析,肠粘膜和肝、胰、肺及肠系膜淋巴结分离出的耐氨苄青霉素菌株具有相同的质粒DNA图谱(图3)。
图3 质粒PUC18的DNA限制性内切酶分析图谱
Fig. 3 DNA restriction map of plasmid PUC181: E.coli JM109; 2: E.coli bearing plasmid PUC18; 3, 4, 5, 10: E.coli bearing plasmid PUC18 separated from ileum mucosa, liver, pancreas and MLN respectively; 12: λDNA/Hind Ⅲ
, 百拇医药
2.7 血浆DAO活性 与对照组比较,ANP组血浆DAO的活性,第1、2 天增加1~2倍,而第4、7天则明显降低(P<0.01),即先升高后下降;第7天DAO活性只相当于对照组的1/3。
2.8 血清AMY水平 两组各时相点血胰淀粉酶比较,ANP组高于对照组2~6倍,以发病后第1、2天最为明显。差异极显著(P <0.01)。
3 讨论
随着对急性胰腺炎病理生理认识的不断深入,诊断技术和外科监护、治疗水平的进步,ANP病人早期死于循环、呼吸衰竭者已大为减少,但晚期所发生的继发性胰腺感染仍严重威胁着病人的生命。以往对ANP后胰腺感染的临床和实验研究大多局限于对人或动物的胰腺坏死组织进行培养和回顾性分析[3] ,未能就ANP时肠屏障功能损害和细菌移位的关系进行研究,继发性胰腺感染的发生机理也未能完全阐明。本实验通过采用PUC18质粒载体示踪加质粒DNA限制性内切酶指纹图谱分析方法,对此进行了深入探讨。
, 百拇医药
肠屏障功能包括机械屏障、生物屏障和免疫屏障功能,通常情况下能有效地阻止肠道内细菌和毒素侵入体内。本研究证明,ANP时肠屏障功能遭到严重损害,表现为以下4个方面:(1)肠粘膜上皮绒毛破坏:以粘膜微绒毛坏死脱落、萎缩为主要表现,而肠粘膜结构的破坏,将导致肠屏障功能的严重削弱,使肠道细菌易于突破受损的粘膜上皮而发生移位;(2)肠通透性出现病理性升高:ANP发病后48 h肠通透性增高且与血培养阳性率相一致,提示ANP早期肠粘膜屏障即遭到严重破坏,而此时肠道细菌迁移的概率也最大;(3)血浆DAO活性下降:外周血中DAO活性能可靠地反映肠上皮细胞成熟度和完整性,其变化可反映肠粘膜屏障的功能状态[7] 。肠组织缺血、缺氧或营养障碍会引起肠粘膜DAO活性下降,继而导致血浆DAO活性下降。但肠粘膜遭到严重损伤时,由于上皮破坏,致DAO大量释放入血,反可引起血中DAO活性一过性增高。DAO活性的下降,提示ANP早期由于肠粘膜上皮破坏,DAO入血造成血中DAO活性短暂增高,随后的下降,则是DAO耗竭的结果,反映了肠屏障功能处于低下状态;(4)生物屏障受损:肠道微生态紊乱,表现为以大肠杆菌为主的肠道条件致病菌大量繁殖,厌氧菌受到抑制,破坏了正常的菌膜结构,B/E比值严重倒置,厌氧菌的定植抗力大为减弱。肠屏障功能损害的结果,使肠道细菌、内毒素易于突破损伤的粘膜屏障而发生移位。本研究发现,对照组血、脏器(除MLN)培养均为阴性;而ANP组各脏器细菌培养均为阳性,逐日血培养阳性结果为8/8,发病后48 h内最易发生。且每只犬都能检出质粒菌JM109,以胰腺检出为高(6/8),经质粒DNA限制性内切酶指纹图谱分析,证实这些移位的氨苄青霉素耐药菌与事先人工定植于肠道的质粒菌同出一源,从而从分子水平上证实ANP时移位细菌确实来自肠道。
, 百拇医药
研究结果表明,ANP时由于机体全身及局部均发生了一系列重要的病理生理变化,使肠道这一极为敏感的应激器官遭受严重损害,大大削弱了其正常的屏障功能,以大肠杆菌为代表的肠道细菌得以突破粘膜屏障入侵组织,并越过MLN移位到远处器官,受炎症严重困扰和打击的胰腺本身,自然成为细菌居留和繁殖的理想场所,从而继发胰腺感染。本研究提示,ANP早期肠屏障功能即遭到严重损伤,发生肠道细菌、内毒素移位,肠源性感染是ANP继发感染的主要根源。
参考文献
1 Widdison AL, Karanjia ND. Pancreatic infection complicating acute pancreatitis. Br J Surg, 1993, 80:148
2 Gianotti L, Munda R, Alexcuder JW et al.Bacterial translocation: A potential source for infection in acute pancreatitis. Pancreas, 1993, 8(5):551
, 百拇医药
3 Foitzik T, Castillo CF, Ferraro MJ et al. Pathogenesis and prevention of early pancreatic infection in experimental acute necrotizing pancreatitis. Ann Surg, 1995, 222:179
4 Dumas F, Aussel C, Pemet P et al. Gas chromatography applied to the lactulose-mannitol intestinal permeability test. J Chromatogr B, 1994, 654:276
5 吴承堂, 黎沾良. 急性坏死性胰腺炎并发感染的机理研究. 中华外科杂志, 1998, 36(4):230
6 萨姆布鲁克 J, 弗里奇 E F, 曼尼阿蒂斯 T. 分子克隆实验指南. 第2版.北京:科学出版社, 1995.16~19
7 Lok GD. Plasma postheparin diamine oxidase. J Clin Invest, 1983, 71(5):1308
(收稿日期:1998-10-30), 百拇医药
单位:第一军医大学1南方医院普外科,广州,510515;解放军304医院外科,北京,100037;中医系外科教研室,广州,510515
关键词:急性坏死性胰腺炎;细菌移位;肠屏障功能;质粒;胰腺感染
第一军医大学学报990204 摘要:目的 通过PUC18质粒载体菌(JM109)示踪法,观察急性坏死性胰腺炎(ANP)时肠屏障损伤与肠道细菌移位情况,探讨ANP继发感染的机理。方法 杂种犬15只于定植PUC18质粒菌JM109后,分ANP组(n=8)和对照组(n=7)。采用气相色谱法测定尿中甘露醇和乳果糖的含量;测定血中二胺氧化酶(DAO)活性和内毒素(LPS)浓度;每日血培养;第7天活杀后,各组脏器标本作细菌培养,肠粘膜菌群分析,所有耐氨苄青霉素菌作质粒DNA分析。结果 ANP犬肠粘膜上皮绒毛破损,肠通透性显著增加,血浆DAO活性下降,肠道微生态出现明显紊乱,血和脏器出现细菌移位,血中LPS浓度升高1~3倍,ANP犬胰腺中PUC18质粒菌移位率为87.5%。结论 本研究提示,ANP后肠屏障功能严重受损,发生肠道细菌移位,肠源性感染是ANP继发感染的根源。
, 百拇医药
中图分类号:R576
An experimental study on the pathogenesis of enteric infection complicating impairment of the gut barrier function in acute necrotizing pancreatitis
Wu Chengtang1, Li Zhanliang2, Huang Xiangcheng1, Qi Delin1, Zhang Zhiling3
1Department of General Surgery, Nanfang Hospital, First Military Medical University, Guangzhou, 510515; 2 Department of General Surgery of 304th Hospital of PLA, Beijing, 100037; 3Surgical Department of Traditional Chinese Medicine Faculty, First Military Medical University, Guangzhou, 510515
, 百拇医药
Abstract: Objective To observe the injury of gut barrier function and intestinal bacterial translocation (BT) subsequent to acute necrotizing pancreatitis (ANP). Methods Fifteen dogs were colonized with a strain of E.coli JM109 bearing ampicillin-resistance plasmid PUC18 and then divided into two groups. In ANP group (n=8), acute necrotizing pancreatitis was induced, while in the control group (n=7), there was simple laparotomy only. Gas chromatography was applied to determine the levels of lactulose and mannitol in the urine. Blood samples were cultured every day. The level of diamine oxidase, LPS and amylase in blood were studied. All animals were sacrificed on day 7. Tissues of organs were collected for histological and microbiological studies. PUC18 plasmid vector tracing with restriction map analysis was used for ampicillin-resistance germ. Results It was shown that ANP induced impairment of the gut barrier function, the manifestation of which included damage of epithelial villi of the mucosa, significant increase in intestinal permeability, a decrease of diamine oxidase activity in blood, and microecologic disorder in the gut with overgrowth of gram-negative germs, especially E.coli, and reversed bifidobacterium/E.coli (B/E) ratio, as a result, bacterial translocation was found in organs and blood. The levels of plasma LPS increased 1-3 times. E.coli JM109 refound in pancreas of ANP group in 87.5%. Conclusion The results suggest that injury of the intestinal mucosa might take place soon after the onset of ANP, which could lead to BT from the intestine to pancreas and other organs, and become the source of pancreatic infection.
, http://www.100md.com
Key words: acute necrotizing pancreatitis; bacterial translocation; pancreatic infection; plasmid; gut barrier function
自Fitz于1889年提出胰腺感染以来,由于其发病凶险,死亡率高而受到人们的广泛关注。据统计,目前临床上因胰腺炎死亡的病人80%是由于感染所致[1] 。临床和实验研究均已证实,从感染胰腺中培养出来的细菌与肠道细菌相一致,肠道细菌移位可能是胰腺感染的根源[2,3]。胰腺感染最早出现在胰腺炎发病后1~2周[3],但有关胰腺炎早期肠粘膜屏障功能状况与肠道细菌移位关系尚未见报道。本研究采用PUC18质粒载体(JM109)示踪加限制性内切酶指纹图谱分析方法,探讨ANP后肠粘膜屏障功能变化与肠道细菌移位情况,旨在从分子水平上阐明急性坏死性胰腺炎(ANP)早期肠源性感染的发生机理。
, 百拇医药
1 材料与方法
1.1 动物分组与模型制作 杂种犬15只,体质量(15±2)kg,雌雄不拘。所有犬购进后粪便培养未见耐氨苄青霉素药菌生长,给予庆大霉素(2万U.kg-1..d-1×2 d)喂服,第3天起喂服浓度为1012 CFU/L的示踪菌PUC18质粒菌JM109 (对氨苄青霉素耐药的大肠杆菌,军事医学科学院沈倍奋院士惠赠),连喂2 d (20 ml.kg-1..d-1),服菌期间动物自由饮水(含氨苄青霉素100 mg/L),第5天起连续3 d采集粪便标本在含氨苄青霉素(100 mg/L)培养基上培养,对生长的耐药菌进行质粒分析,证实质粒菌已定植肠道。随后将犬随机分为对照组(n=7)和ANP组(n=8)。硫苯妥钠(30 mg/kg)静脉麻醉后,无菌下经上腹正中切口入腹,暴露十二指肠并向后翻转,沿其系膜缘找到主胰管。对照组仅用手触及胰腺,ANP组以7.64 kPa恒定压力经主胰管注入5%牛磺胆酸钠(0.5 ml/kg)和胰蛋白酶(3 000 U/kg),复制ANP模型。
, 百拇医药
1.2 检测指标
1.2.1 肠通透性 分别于手术后第1、2、4、7天各给犬灌服5%甘露醇和10%乳果糖混合液100 ml,收集6 h尿,参照Dumas法[4],对尿中乳果糖和甘露醇作肟化和硅烷化处理后,采用气相色谱法测定尿中两种糖的含量,并以尿中乳果糖/甘露醇(L/M)表示肠通透性的大小[5] 。
1.2.2 血浆二胺氧化酶(DAO)活性和血清胰淀粉酶(AMY) 血浆DAO采用分光光度法、血清AMY采用碘-淀粉法测定。
1.2.3 血浆内毒素(LPS)测定 鲎试剂基质显色定量测定血中内毒素浓度。
1.2.4 病理学检查 切取胰腺及回肠组织,作光镜和电镜观察。
1.3 细菌培养与鉴定1.3.1 细菌培养 术后每天抽血2 ml作细菌培养。1.3.2 细菌鉴定 第7天活杀后,无菌剪取肝、胰、脾、肺、肾及肠系膜淋巴结(MLN),匀浆后作细菌培养;无菌剪取空、回、盲肠标本,匀浆,取10μl接种至E.coli、肠球菌、双歧杆菌、类杆菌和乳杆菌5种选择性平板;需氧菌37℃培养24 h、厌氧菌37℃厌氧箱中培养48 h后计数;根据细菌生长的特点、菌落和生化反应等分别鉴定需氧菌和厌氧菌。1.4 质粒检测 血及各脏器匀浆后在含氨苄青霉素(100 mg/L)的LB培养基中振荡培养24 h,培养阳性者采用碱裂解法提取细菌质粒DNA(示踪菌JM109一起作阳性对照),提取物用限制性内切酶ECORⅠ(美国Sigma公司产品)于37℃水浴中消化1 h,取10μl消化产物用0.8%琼脂糖凝胶电泳(λDNA/HindⅢ为美国Sigma公司产品),溴化乙锭核酸染色,长波紫外线下观察并摄像[6]。
, http://www.100md.com
1.5 统计学处理 数据作t检验,结果以

 ±s表示。
±s表示。2 结果
2.1 病理 ANP组大体所见,胰腺明显肿大、变硬,有暗黑或灰白坏死区。光镜下胰腺腺泡细胞大片出血、坏死,部分胞核溶解消失,坏死胰腺组织周围有大量中性白细胞浸润。回肠标本大体可见肠粘膜糜烂,粘膜散在出血点,光镜下可见明显的粘膜出血、水肿,绒毛部分脱落,上皮破损处见大量细菌侵入(图1)。对照组胰腺及肠粘膜未见异常,肠粘膜绒毛完整,未见细菌侵入(图2)。

图1 ANP组犬肠粘膜绒毛破损,上皮脱落处可见细菌侵入
, http://www.100md.com
Fig. 1 Villus of intestinal mucosa was destructive and bacteria were found to invade in ANP dog (Goodpasteur×1000)

图2 对照组犬肠粘膜绒毛完整,未见细菌侵入
Fig. 2 Villus of intestinal mucosa was intact and bacteria were not found to invade in control dog (Goodpasteur×1000)
2.2 肠通透性 胰腺炎组发病后第1、2、4、7天尿中乳果糖均明显高于对照组(P<0.01),各天L/M比值高出对照组2~12倍,以第2天最为明显,至7 d后逐渐下降(表1)。
, http://www.100md.com
表1 尿中乳果糖和甘露醇含量(mg)及乳果糖/甘露醇比值(L/M)t
Tab. 1 Levels of lactulose, mannitol and ratio of lactulose/manniol(L/M) in urine Groups
Lactulose
Mannitol
L/M
Control
d 1
7.22±1.83
239.57±23.39
, http://www.100md.com
0.029±0.006
d 2
7.80±1.93
227.10±32.12
0.035±0.009
d 4
6.83±1.11
222.19±26.45
0.031±0.007
d 7
8.19±1.79
234.71±16.91
, 百拇医药
0.033±0.007
ANP
d 1
51.14±14.34**
172.50±26.92*
0.231±0.073**
d 2
81.74±20.95**
209.55±29.34
0.472±0.118**
d 4
49.68±19.44**
, 百拇医药
219.25±39.58
0.251±0.062**
d 7
27.94±8.87**
222.37±34.19
0.105±0.024*
* P<0.05 ** P <0.01 vs the control group
2.3 肠道微生态 粘膜菌群中的大肠杆菌计数比对照组增加10~300倍,以空、回肠粘膜为明显(P<0.01);而双歧杆菌及乳杆菌的计数则明显下降,以回、盲肠粘膜为甚(P<0.01);空、回和盲肠粘膜条件致病菌-类杆菌亦见显著增加;空、回、盲肠粘膜B/E比值严重倒置(P<0.05)(表2)。
, http://www.100md.com
表2 肠粘膜菌群计数(CFUlogn/g)及双歧杆菌/大肠杆菌比值(B/E)
Tab. 2 Population levels of mucosal (CFU log n/g) and ratio of bifidobacterium/E.Coli (B/E)
Content
Group
E.coli
Enterococcus
Bacteriod
Bifidobacterium
Lactobacillus
, 百拇医药
B/E
Jejunum
Control
1.91±0.49
1.69±0.79
2.23±0.92
2.35±0.79
1.83±0.64
1.23±0.53
ANP
3.42±0.93**
0**
, 百拇医药
3.75±0.77*
1.75±0.95*
1.13±0.80
0.51±0.76*
Ileum
Control
3.51±0.84
2.05±0.44
3.61±1.06
3.87±1.05
3.79±1.11
1.16±0.82
, http://www.100md.com
ANP
5.80±1.27**
1.17±0.95*
4.35±0.98*
2.89±0.86*
1.78±0.79**
0.62±0.68*
Cecum
Control
4.74±0.93
2.61±0.77
3.54±0.99
, 百拇医药
4.89±0.87
3.24±0.84
1.03±0.63
ANP
5.88±1.18*
1.27±1.04*
4.01±1.10
2.70±0.88**
2.81±0.73*
0.46±0.44*
* P<0.05, ** P<0.01 vs the control group

, 百拇医药
2.4 血浆LPS ANP组各时间点血浆LPS均明显高于对照组(表3)。
表3 血浆LPS变化(Eu/L)
Tab.3 The changes of plasma LPS
Groups
d 1
d 2
d 4
d 7
Control
68±5
74±8
, 百拇医药
64±9
66±7
ANP
217±85**
346±127**
268±54**
107±64*
* P<0.05, ** P <0.01 vs the control group
2.5 细菌移位 血及脏器细菌培养,胰腺炎犬全部脏器均发生细菌移位(表4)。血培养全部阳性,发病后第1、2天(6/8和5/8)阳性率最高。
表4 各脏器细菌移位阳性犬数(只)
, http://www.100md.com
Tab.4 Positive rate of bacteria translocated to dog organs
Groups
n
Pancreas
Liver
Lung
Kidney
Spleen
MLN
Control
7
, 百拇医药
0
0
0
0
0
2(0)
ANP
8
7(6)
7(4)
6(3)
6(3)
4(0)
, 百拇医药 8(2)
(n) means that E.coli JM109 bearing plasmid PUC18 was positive
2.6 质粒DNA分析 胰腺炎犬全部均能分离出耐氨苄青霉素的大肠杆菌,经质粒DNA提取和限制性内切酶分析,肠粘膜和肝、胰、肺及肠系膜淋巴结分离出的耐氨苄青霉素菌株具有相同的质粒DNA图谱(图3)。
图3 质粒PUC18的DNA限制性内切酶分析图谱
Fig. 3 DNA restriction map of plasmid PUC181: E.coli JM109; 2: E.coli bearing plasmid PUC18; 3, 4, 5, 10: E.coli bearing plasmid PUC18 separated from ileum mucosa, liver, pancreas and MLN respectively; 12: λDNA/Hind Ⅲ
, 百拇医药
2.7 血浆DAO活性 与对照组比较,ANP组血浆DAO的活性,第1、2 天增加1~2倍,而第4、7天则明显降低(P<0.01),即先升高后下降;第7天DAO活性只相当于对照组的1/3。
2.8 血清AMY水平 两组各时相点血胰淀粉酶比较,ANP组高于对照组2~6倍,以发病后第1、2天最为明显。差异极显著(P <0.01)。
3 讨论
随着对急性胰腺炎病理生理认识的不断深入,诊断技术和外科监护、治疗水平的进步,ANP病人早期死于循环、呼吸衰竭者已大为减少,但晚期所发生的继发性胰腺感染仍严重威胁着病人的生命。以往对ANP后胰腺感染的临床和实验研究大多局限于对人或动物的胰腺坏死组织进行培养和回顾性分析[3] ,未能就ANP时肠屏障功能损害和细菌移位的关系进行研究,继发性胰腺感染的发生机理也未能完全阐明。本实验通过采用PUC18质粒载体示踪加质粒DNA限制性内切酶指纹图谱分析方法,对此进行了深入探讨。
, 百拇医药
肠屏障功能包括机械屏障、生物屏障和免疫屏障功能,通常情况下能有效地阻止肠道内细菌和毒素侵入体内。本研究证明,ANP时肠屏障功能遭到严重损害,表现为以下4个方面:(1)肠粘膜上皮绒毛破坏:以粘膜微绒毛坏死脱落、萎缩为主要表现,而肠粘膜结构的破坏,将导致肠屏障功能的严重削弱,使肠道细菌易于突破受损的粘膜上皮而发生移位;(2)肠通透性出现病理性升高:ANP发病后48 h肠通透性增高且与血培养阳性率相一致,提示ANP早期肠粘膜屏障即遭到严重破坏,而此时肠道细菌迁移的概率也最大;(3)血浆DAO活性下降:外周血中DAO活性能可靠地反映肠上皮细胞成熟度和完整性,其变化可反映肠粘膜屏障的功能状态[7] 。肠组织缺血、缺氧或营养障碍会引起肠粘膜DAO活性下降,继而导致血浆DAO活性下降。但肠粘膜遭到严重损伤时,由于上皮破坏,致DAO大量释放入血,反可引起血中DAO活性一过性增高。DAO活性的下降,提示ANP早期由于肠粘膜上皮破坏,DAO入血造成血中DAO活性短暂增高,随后的下降,则是DAO耗竭的结果,反映了肠屏障功能处于低下状态;(4)生物屏障受损:肠道微生态紊乱,表现为以大肠杆菌为主的肠道条件致病菌大量繁殖,厌氧菌受到抑制,破坏了正常的菌膜结构,B/E比值严重倒置,厌氧菌的定植抗力大为减弱。肠屏障功能损害的结果,使肠道细菌、内毒素易于突破损伤的粘膜屏障而发生移位。本研究发现,对照组血、脏器(除MLN)培养均为阴性;而ANP组各脏器细菌培养均为阳性,逐日血培养阳性结果为8/8,发病后48 h内最易发生。且每只犬都能检出质粒菌JM109,以胰腺检出为高(6/8),经质粒DNA限制性内切酶指纹图谱分析,证实这些移位的氨苄青霉素耐药菌与事先人工定植于肠道的质粒菌同出一源,从而从分子水平上证实ANP时移位细菌确实来自肠道。
, 百拇医药
研究结果表明,ANP时由于机体全身及局部均发生了一系列重要的病理生理变化,使肠道这一极为敏感的应激器官遭受严重损害,大大削弱了其正常的屏障功能,以大肠杆菌为代表的肠道细菌得以突破粘膜屏障入侵组织,并越过MLN移位到远处器官,受炎症严重困扰和打击的胰腺本身,自然成为细菌居留和繁殖的理想场所,从而继发胰腺感染。本研究提示,ANP早期肠屏障功能即遭到严重损伤,发生肠道细菌、内毒素移位,肠源性感染是ANP继发感染的主要根源。
参考文献
1 Widdison AL, Karanjia ND. Pancreatic infection complicating acute pancreatitis. Br J Surg, 1993, 80:148
2 Gianotti L, Munda R, Alexcuder JW et al.Bacterial translocation: A potential source for infection in acute pancreatitis. Pancreas, 1993, 8(5):551
, 百拇医药
3 Foitzik T, Castillo CF, Ferraro MJ et al. Pathogenesis and prevention of early pancreatic infection in experimental acute necrotizing pancreatitis. Ann Surg, 1995, 222:179
4 Dumas F, Aussel C, Pemet P et al. Gas chromatography applied to the lactulose-mannitol intestinal permeability test. J Chromatogr B, 1994, 654:276
5 吴承堂, 黎沾良. 急性坏死性胰腺炎并发感染的机理研究. 中华外科杂志, 1998, 36(4):230
6 萨姆布鲁克 J, 弗里奇 E F, 曼尼阿蒂斯 T. 分子克隆实验指南. 第2版.北京:科学出版社, 1995.16~19
7 Lok GD. Plasma postheparin diamine oxidase. J Clin Invest, 1983, 71(5):1308
(收稿日期:1998-10-30), 百拇医药