中华眼镜蛇毒组份M抑制血小板聚集作用机制初探
作者:孙林光 余清声 廖兆全 赵路宁 管锦霞
单位:孙林光 余清声 赵路宁 管锦霞 广州医学院广州蛇毒研究所;廖兆全 广州医学院生化教研室,广州 510182
关键词:眼镜蛇毒;血小板聚集;抑制作用;肌动蛋白
广州医学院学报990201
提要 目的:探讨中华眼镜蛇毒组份M抑制血小板聚集作用机制;方法:运用卵磷脂法、剩余可凝纤维蛋白原法、纤维蛋白平板法等分别测定了中华眼镜蛇毒组份M中磷脂酶A2(PLA2),纤维蛋白原溶解酶及纤维蛋白溶解等与血小板聚集相关的酶活性,并运用十二烷基磺酸钠-聚丙烯酰胺凝胶垂直板电泳(SDS-PAGE)分析了组份M对血小板内细胞骨架蛋白的影响;结果:组份M不含PLA2活性,无纤维蛋白(原)溶解酶活性,亦无ADP酶和5′-核苷酸酶活性,不影响正常人血浆乳酸脱氢酶的含量,但对ADP诱导的血小板细胞内肌动蛋白微丝聚合物的形成有明显抑制作用;结论:中华眼镜蛇毒组份M对血小板聚集所依赖的血小板内细胞骨架系统的功能有抑制作用。
, http://www.100md.com
中图分类号 R311.143
Preliminary Study on the Mechanism of Inhibitory
Effect of Fraction M from Naja naja atra
Snake Venom on Platelet Aggregation
Sun Linguang,Yu Qingsheng,1Liao Zhaoquan,et al
(Guangzhou Research Institute of Snake Venom,Guangzhou Medical College,Guangzhou 510182;
1Department of Biochemistry)
, http://www.100md.com
Objective:To explore the mechanism of platelet aggregation-inhibitory effect induced by frac-tion M from the venom of Naja atra snake.Method:By using the test of lecithin hydrolysis,the test of residual clotted fibrinogen and that of fibrin plate,the activity of phospholipase A2(PLA2),the activity of fibrinogenolytic enzyme and the fibrinolysis,which are related to platelet aggrega-tion,were detected.furthermore,SDS-PAGE electrophoresis technique was used to investingate the effect of fraction M on platelet cytoskeleton proteins.results:Fraction M was free of PLA2 active-ty,fibrino(geno)lytic activity,ADPase,or 5'-nucleotidase,and it exerted no effect on the content of plasma lactic dehydrogenase from normal human.However,an obvious inhibitory effect of fraction M on the formation of actin filament polymer in platelet induced by ADP was observed.Conclu-sion:Fraction M could inhibit the function of platelet cytoskeleton on which the aggregation of platelet depends.
, http://www.100md.com
Key words Cobra venom;Platelet aggregation;Inhibition;Actin
蛇毒抑制血小板聚集存在着复杂的作用机制。我们在对中华眼镜蛇毒抑制血小板聚集组份M生物学活性及生化性质进行分析的基础上,就组份M的作用机制进行了初步探讨,兹报道如下。
1 材料与方法
1.1 中华眼镜蛇毒(Naja naja atra)及中华眼镜蛇毒抑制血小板聚集组份M(SDS-PAGE 纯,MW14,000Da)由广州蛇毒研究所提供及研制;ADP,电泳用低分子量标准品:上海东风试剂公司生产;人纤维蛋白原,牛纤维蛋白原:中国医学科学院天津血液学研究所生产;冻干人凝血酶:上海医科大学附属华山医院生产;全自动生化分析仪:HITACHI公司出品。DF-808型数字pH/离子计:广州市登峰仪器厂出品。其它试剂均为国产分析纯。
, http://www.100md.com
1.2 中华眼镜蛇毒及组份M磷脂酶A2活力的测定
用卵磷脂法[1]测定PLA2的活性。称取200mg卵磷脂加入2ml乙醚溶解,加8ml水混匀,于60℃水中保温20min,用玻璃棒将残余物搅拌成乳浊液。取出2ml乳浊液置于25ml小烧杯内,加入1mol/L NaCL 1ml,0.01mol/L去氧胆酸钠1ml,0.01mol/L CaCl2 1ml,加水至10ml。用DF-808型数字pH/离子计测上述溶液的pH值,并用0.02mol/L KOH调pH至8.0,恒温40℃。加入0.1ml 蛇毒溶液(原毒或组份M,1mg/mL),用0.02mol/L KOH调整,使溶液pH值保持8.0不变。记录不同时间消耗的KOH体积数,换算成脂肪酸的微克分子数,绘成活力曲线,计算PLA2活性。
1.3 纤维蛋白原溶解酶活性测定
, 百拇医药
参照Moran等[2]剩余可凝纤维蛋白原法测定。
实验分眼镜蛇毒和组份M两个样品组,每组取试管6支,编号,加入人纤维蛋白原溶液1.6ml(1mg/mL)。及浓度为(2mg/mL)的眼镜蛇毒或1mg/mL的组份M各100μl,混合后测A280nm值,置37℃水浴温育,分别于0、15、30、60、90、120min在各管内加入100IU/mL的凝血酶20μl,继续温育 10min,4000rpm×10min离心,测上清液A280nm值。可凝纤维蛋白原百分含量为:
1.4 纤维蛋白溶解活性的测定
接纤维蛋白平板法[3]将1.6%琼脂糖溶液与0.4%牛纤维蛋白原溶液在52℃左右混匀。取混合液10ml倒入内径为9cm水平放置的培养皿中,待凝固后加10IU/mL的凝血酶1ml于其表面,37℃温育30min,蒸溜水洗去剩余凝血酶,于凝胶表面间隔20mm打2.8mm直径的小孔,即成标准纤维蛋白平板,取样品10μl置纤维蛋白平板小孔中,37℃温育24h,测量小孔周围透明溶解圈面积。该面积大小与样品纤维蛋白溶解活力呈正相关。
, http://www.100md.com
1.5 ADP酶和5′-核苷酸酶活性的测定
以ADP为底物,取0.2ml原毒或组份M(6mg/mL)溶于1.2×10-2mol/L的氯化镁,0.05mol/L甘氨酸,pH8.8的缓冲液中,加入1ml3.6×10-2mol/L的ADP溶液,置37℃水浴温育2h,立即加入10%三氯醋酸1ml终止反应。3000rpm离心15min,取上清液,用752分光光度计680nm比色,测定无机磷生成量[4]。
配制不同浓度的眼镜蛇毒原毒和组份M,用日立全自动生化分析仪测定不同浓度的原毒及组份M 5′-核苷酸酶活性。
1.6 对人血浆乳酸脱氢酶含量的影响
于200μl,人血PRP中分别加不同浓度的眼镜蛇毒或组份M20μl,正常对照组加生理盐水20μl、37℃孵育30min,3000rpm×20min离心,日立全自动生化分析仪测定各样品组上清液中乳酸脱氢酶的活性[4]。
, http://www.100md.com
1.7 对血小板内细胞骨架蛋白的影响[5]
配制ADP液(1.2mg/mL)和TEB液(2%Triton X-100,0.01 mol/L EDTA,0.1mol/L Tris-HCl,pH7.4)。将人血PRP等分成3份每份1ml,于阴性对照管加生理盐水;阳性对照管加ADP;实验组加组份M,静置37℃保温30min,加入等体积的TEB混合,溶解血小板细胞,10000g×4min离心,沉淀物经电泳样品液(含2%SDS,8 mol/L尿素,5%二巯基乙醇和0.01%溴酚兰)复溶,于2.5%的浓缩胶浓缩后在12.5%的分离胶中进行SDS-PAGE分析。分子量标准品含5种成分:兔磷酸化酶B(97400),牛血清白蛋白(66200),兔肌动蛋白(43000),牛碳酸酐酶(31000),鸡蛋清溶菌酶(14400)。
2 结果
2.1 眼镜蛇毒及组份M磷脂酶A2测定结果
, 百拇医药
眼镜蛇毒原毒磷脂酶A2活力曲线如图1,眼镜蛇毒原毒磷脂酶A2比活力为14.50μmol/min/mg,而组份M无明显磷脂酶A2活力。
图1 眼镜蛇毒PLA2活力-时间曲线
2.2 纤维蛋白原溶解活性的测定
对照组可凝纤维蛋白原百分含量为64.82±6.55%,眼镜蛇毒组中可凝纤维蛋白原含量随着温育时间的延长逐渐减少;组份M实验组中各时间点可凝纤维蛋白原百分含量分别为60.59±2.82%、62.41±3.89%、58.67±2.74%、59.68±3.11%、60.15±3.55%、61.69±4.99%,经单因素多均数方差分析,各组均数与对照组均数无统计学差异(n=10,P>0.05),说明组份M在120min内无明显裂解纤维蛋白原的作用。
, 百拇医药
2.3 纤维蛋白溶解活性的测定
眼镜蛇毒可溶解纤维蛋白平板,产生明显的透亮圈,其溶解面积与其剂量的对数值呈正相关(见图2);而组份M不能产生透亮圈,无明显溶解纤维蛋白平板活性。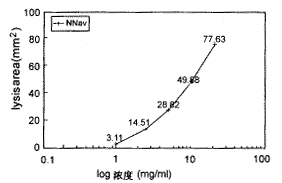
图2 眼镜蛇毒原毒(对数浓度)剂量与
纤维蛋白溶解面积曲线图
2.4 ADP酶和5′-核苷酸酶活性的测定
眼镜蛇毒ADP酶,5′-核苷酸酶活性分别为:0.41μ mol/h/mg,18IU /mg/mg/ml;组份M无ADP酶及5′-核苷酸酶活性。
2.5 人血浆乳酸脱氢酶含量的测定
, 百拇医药
结果见表1,经单因素多均数方差分析,眼镜蛇毒组及组份M组其血浆乳酸脱氢酶均值与生理盐水对照组均值无统计学差异(P>0.05,n=8)。
表1 组份M对人血清LDH酶含量的影响(活性单位:IU) 测定次数
生理盐水
对照组
原毒组
(91mg/ml)
组分
(22.5mg/ml)
组分
(45.5mg/ml)
, http://www.100md.com
组分
(91mg/ml)
1
122
177
107
114
124
2
114
115
107
120
, http://www.100md.com
124
3
110
115
112
108
108
4
109
109
106
106
106
, 百拇医药 5
113
113
106
108
116
6
105
115
108
112
121
7
122
, 百拇医药
123
120
112
112
8
113
109
112
102
121 ±s
±s
113.5±5.9
114.5±4.5
, http://www.100md.com
110.5±4.6
112.25±5.6
116.5±7.13
2.6 组份M对人血小板细胞内骨架蛋白的影响
电泳结果如图3所示,回归分析结果:y=-1.0349x+5.1522,r=-0.9957。
图3 血小板细胞骨架系统
SDS-PAGE电泳图谱
A.H:分子量标准品 B、C、F、G:ADP活化的血小板骨架蛋白 D:阴性对照 E:组份M
, 百拇医药 如图所示,生理盐水阴性对照组及组份M实验组中,分子量约42KDa的区带比ADP阳性对照组要细浅得多,说明这两组中不溶于TEB溶液的F型肌动蛋白聚合体比ADP诱导激活后的阳性组要少得多,提示组份M具有抑制F型肌动蛋白聚合体形成的作用。
3 讨论
血小板聚集是受激活的血小板通过血浆纤维蛋白原的连接而形成的血小板之间的联结,是血栓形成的初始阶段。血小板活化及聚集的调控机制相当复杂,因而抗血小板聚集的机制也很复杂。蛇毒抗血小板聚集目前认为主要有7种途径[6]。
蛇毒纤维蛋白(原)溶解酶及ADP酶,5′-核苷酸酶是通过选择性酶解血浆纤维蛋白原或聚集诱导物ADP等血小板聚集所依赖的外部因素而发挥其聚集抑制作用,这些酶抑制聚集的作用与其酶活性紧密相关。这类聚集抑制作用在蛇毒中比较普遍存在;然而蛇毒磷脂酶A2抑制血小板聚集的作用与其酶活性缺乏紧密的相关性。即某些种类的蛇毒磷脂酶A2有抑制作用,而有些没有。本文对眼镜蛇毒抑制血小板聚集组份M就上述几种与聚集相关的酶活性进行了分析。结果表明该M组份不含上述酶活性。同时,通过测定血浆乳酸脱氢酶活性,我们进一步排除了组份M在30min内直接溶解血小板膜,释放胞内溶酶体血浆乳酸脱氢酶的可能性(诱导血小板聚集实验共需10~15min)。
, 百拇医药
排除了酶解作用这一外部因素影响血小板聚集的可能性。我们开始考虑组份M对血小板自身影响的可能。肌动蛋白是血小板内骨架蛋白的重要组成部分,它对于血小板变形、聚集及收缩等过程是一个重要影响因素。通过实验,我们发现组份M对血小板内肌动蛋白微丝聚合物的形成有显著的抑制作用,这一结果与该组份抑制多种诱导剂的诱聚作用是相一致的。当然这样一个分子量为14,000Da的蛋白质分子进入细胞内是困难的,那么它在血小板膜上是否存在一个特定的作用位点呢?除骨架蛋白外,它对血小板花生四烯酸代谢过程及血小板释放反应有无影响呢?对于这些问题,我们将进一步深入探讨。
基金项目:广东省自然科学基金资助项目(930190)
参考文献
1 张翔,周元聪.蛇毒磷脂酶A2不同测活方法的评估.生命化学,1994;14(2):41~42
, 百拇医药 2 Jeffrey B.Moran,Collis R.Green.Characterization of a fibrinogenase from northern copperhead(Agkistrodon contortrix mokasen) venom,Biochemic et Biophysica Acta,1981;659:161~168
3 管锦霞,赵延德,杨晓光.我国八种常见毒蛇蛇毒对血凝和纤溶的影响.两栖爬行动物研究,1984;3(2):65~71
4 杨振华,曾芝如.血清5′-核苷酸酶连续监测法测定.冯仁丰主编:实用医学检验学.上海:上海科学技术出版社,1996:444~445
5 阮长耿主编.血小板-基础与临床.上海:上海科技科学出版社,1987:27~28
6 孙林光.蛇毒抑制血小板聚集作用机制的研究进展.广州医学院学报,1997,25(2):102~105
(收稿:1999-02-08), http://www.100md.com
单位:孙林光 余清声 赵路宁 管锦霞 广州医学院广州蛇毒研究所;廖兆全 广州医学院生化教研室,广州 510182
关键词:眼镜蛇毒;血小板聚集;抑制作用;肌动蛋白
广州医学院学报990201
提要 目的:探讨中华眼镜蛇毒组份M抑制血小板聚集作用机制;方法:运用卵磷脂法、剩余可凝纤维蛋白原法、纤维蛋白平板法等分别测定了中华眼镜蛇毒组份M中磷脂酶A2(PLA2),纤维蛋白原溶解酶及纤维蛋白溶解等与血小板聚集相关的酶活性,并运用十二烷基磺酸钠-聚丙烯酰胺凝胶垂直板电泳(SDS-PAGE)分析了组份M对血小板内细胞骨架蛋白的影响;结果:组份M不含PLA2活性,无纤维蛋白(原)溶解酶活性,亦无ADP酶和5′-核苷酸酶活性,不影响正常人血浆乳酸脱氢酶的含量,但对ADP诱导的血小板细胞内肌动蛋白微丝聚合物的形成有明显抑制作用;结论:中华眼镜蛇毒组份M对血小板聚集所依赖的血小板内细胞骨架系统的功能有抑制作用。
, http://www.100md.com
中图分类号 R311.143
Preliminary Study on the Mechanism of Inhibitory
Effect of Fraction M from Naja naja atra
Snake Venom on Platelet Aggregation
Sun Linguang,Yu Qingsheng,1Liao Zhaoquan,et al
(Guangzhou Research Institute of Snake Venom,Guangzhou Medical College,Guangzhou 510182;
1Department of Biochemistry)
, http://www.100md.com
Objective:To explore the mechanism of platelet aggregation-inhibitory effect induced by frac-tion M from the venom of Naja atra snake.Method:By using the test of lecithin hydrolysis,the test of residual clotted fibrinogen and that of fibrin plate,the activity of phospholipase A2(PLA2),the activity of fibrinogenolytic enzyme and the fibrinolysis,which are related to platelet aggrega-tion,were detected.furthermore,SDS-PAGE electrophoresis technique was used to investingate the effect of fraction M on platelet cytoskeleton proteins.results:Fraction M was free of PLA2 active-ty,fibrino(geno)lytic activity,ADPase,or 5'-nucleotidase,and it exerted no effect on the content of plasma lactic dehydrogenase from normal human.However,an obvious inhibitory effect of fraction M on the formation of actin filament polymer in platelet induced by ADP was observed.Conclu-sion:Fraction M could inhibit the function of platelet cytoskeleton on which the aggregation of platelet depends.
, http://www.100md.com
Key words Cobra venom;Platelet aggregation;Inhibition;Actin
蛇毒抑制血小板聚集存在着复杂的作用机制。我们在对中华眼镜蛇毒抑制血小板聚集组份M生物学活性及生化性质进行分析的基础上,就组份M的作用机制进行了初步探讨,兹报道如下。
1 材料与方法
1.1 中华眼镜蛇毒(Naja naja atra)及中华眼镜蛇毒抑制血小板聚集组份M(SDS-PAGE 纯,MW14,000Da)由广州蛇毒研究所提供及研制;ADP,电泳用低分子量标准品:上海东风试剂公司生产;人纤维蛋白原,牛纤维蛋白原:中国医学科学院天津血液学研究所生产;冻干人凝血酶:上海医科大学附属华山医院生产;全自动生化分析仪:HITACHI公司出品。DF-808型数字pH/离子计:广州市登峰仪器厂出品。其它试剂均为国产分析纯。
, http://www.100md.com
1.2 中华眼镜蛇毒及组份M磷脂酶A2活力的测定
用卵磷脂法[1]测定PLA2的活性。称取200mg卵磷脂加入2ml乙醚溶解,加8ml水混匀,于60℃水中保温20min,用玻璃棒将残余物搅拌成乳浊液。取出2ml乳浊液置于25ml小烧杯内,加入1mol/L NaCL 1ml,0.01mol/L去氧胆酸钠1ml,0.01mol/L CaCl2 1ml,加水至10ml。用DF-808型数字pH/离子计测上述溶液的pH值,并用0.02mol/L KOH调pH至8.0,恒温40℃。加入0.1ml 蛇毒溶液(原毒或组份M,1mg/mL),用0.02mol/L KOH调整,使溶液pH值保持8.0不变。记录不同时间消耗的KOH体积数,换算成脂肪酸的微克分子数,绘成活力曲线,计算PLA2活性。
1.3 纤维蛋白原溶解酶活性测定
, 百拇医药
参照Moran等[2]剩余可凝纤维蛋白原法测定。
实验分眼镜蛇毒和组份M两个样品组,每组取试管6支,编号,加入人纤维蛋白原溶液1.6ml(1mg/mL)。及浓度为(2mg/mL)的眼镜蛇毒或1mg/mL的组份M各100μl,混合后测A280nm值,置37℃水浴温育,分别于0、15、30、60、90、120min在各管内加入100IU/mL的凝血酶20μl,继续温育 10min,4000rpm×10min离心,测上清液A280nm值。可凝纤维蛋白原百分含量为:

1.4 纤维蛋白溶解活性的测定
接纤维蛋白平板法[3]将1.6%琼脂糖溶液与0.4%牛纤维蛋白原溶液在52℃左右混匀。取混合液10ml倒入内径为9cm水平放置的培养皿中,待凝固后加10IU/mL的凝血酶1ml于其表面,37℃温育30min,蒸溜水洗去剩余凝血酶,于凝胶表面间隔20mm打2.8mm直径的小孔,即成标准纤维蛋白平板,取样品10μl置纤维蛋白平板小孔中,37℃温育24h,测量小孔周围透明溶解圈面积。该面积大小与样品纤维蛋白溶解活力呈正相关。
, http://www.100md.com
1.5 ADP酶和5′-核苷酸酶活性的测定
以ADP为底物,取0.2ml原毒或组份M(6mg/mL)溶于1.2×10-2mol/L的氯化镁,0.05mol/L甘氨酸,pH8.8的缓冲液中,加入1ml3.6×10-2mol/L的ADP溶液,置37℃水浴温育2h,立即加入10%三氯醋酸1ml终止反应。3000rpm离心15min,取上清液,用752分光光度计680nm比色,测定无机磷生成量[4]。
配制不同浓度的眼镜蛇毒原毒和组份M,用日立全自动生化分析仪测定不同浓度的原毒及组份M 5′-核苷酸酶活性。
1.6 对人血浆乳酸脱氢酶含量的影响
于200μl,人血PRP中分别加不同浓度的眼镜蛇毒或组份M20μl,正常对照组加生理盐水20μl、37℃孵育30min,3000rpm×20min离心,日立全自动生化分析仪测定各样品组上清液中乳酸脱氢酶的活性[4]。
, http://www.100md.com
1.7 对血小板内细胞骨架蛋白的影响[5]
配制ADP液(1.2mg/mL)和TEB液(2%Triton X-100,0.01 mol/L EDTA,0.1mol/L Tris-HCl,pH7.4)。将人血PRP等分成3份每份1ml,于阴性对照管加生理盐水;阳性对照管加ADP;实验组加组份M,静置37℃保温30min,加入等体积的TEB混合,溶解血小板细胞,10000g×4min离心,沉淀物经电泳样品液(含2%SDS,8 mol/L尿素,5%二巯基乙醇和0.01%溴酚兰)复溶,于2.5%的浓缩胶浓缩后在12.5%的分离胶中进行SDS-PAGE分析。分子量标准品含5种成分:兔磷酸化酶B(97400),牛血清白蛋白(66200),兔肌动蛋白(43000),牛碳酸酐酶(31000),鸡蛋清溶菌酶(14400)。
2 结果
2.1 眼镜蛇毒及组份M磷脂酶A2测定结果
, 百拇医药
眼镜蛇毒原毒磷脂酶A2活力曲线如图1,眼镜蛇毒原毒磷脂酶A2比活力为14.50μmol/min/mg,而组份M无明显磷脂酶A2活力。

图1 眼镜蛇毒PLA2活力-时间曲线
2.2 纤维蛋白原溶解活性的测定
对照组可凝纤维蛋白原百分含量为64.82±6.55%,眼镜蛇毒组中可凝纤维蛋白原含量随着温育时间的延长逐渐减少;组份M实验组中各时间点可凝纤维蛋白原百分含量分别为60.59±2.82%、62.41±3.89%、58.67±2.74%、59.68±3.11%、60.15±3.55%、61.69±4.99%,经单因素多均数方差分析,各组均数与对照组均数无统计学差异(n=10,P>0.05),说明组份M在120min内无明显裂解纤维蛋白原的作用。
, 百拇医药
2.3 纤维蛋白溶解活性的测定
眼镜蛇毒可溶解纤维蛋白平板,产生明显的透亮圈,其溶解面积与其剂量的对数值呈正相关(见图2);而组份M不能产生透亮圈,无明显溶解纤维蛋白平板活性。

图2 眼镜蛇毒原毒(对数浓度)剂量与
纤维蛋白溶解面积曲线图
2.4 ADP酶和5′-核苷酸酶活性的测定
眼镜蛇毒ADP酶,5′-核苷酸酶活性分别为:0.41μ mol/h/mg,18IU /mg/mg/ml;组份M无ADP酶及5′-核苷酸酶活性。
2.5 人血浆乳酸脱氢酶含量的测定
, 百拇医药
结果见表1,经单因素多均数方差分析,眼镜蛇毒组及组份M组其血浆乳酸脱氢酶均值与生理盐水对照组均值无统计学差异(P>0.05,n=8)。
表1 组份M对人血清LDH酶含量的影响(活性单位:IU) 测定次数
生理盐水
对照组
原毒组
(91mg/ml)
组分
(22.5mg/ml)
组分
(45.5mg/ml)
, http://www.100md.com
组分
(91mg/ml)
1
122
177
107
114
124
2
114
115
107
120
, http://www.100md.com
124
3
110
115
112
108
108
4
109
109
106
106
106
, 百拇医药 5
113
113
106
108
116
6
105
115
108
112
121
7
122
, 百拇医药
123
120
112
112
8
113
109
112
102
121
 ±s
±s113.5±5.9
114.5±4.5
, http://www.100md.com
110.5±4.6
112.25±5.6
116.5±7.13
2.6 组份M对人血小板细胞内骨架蛋白的影响
电泳结果如图3所示,回归分析结果:y=-1.0349x+5.1522,r=-0.9957。

图3 血小板细胞骨架系统
SDS-PAGE电泳图谱
A.H:分子量标准品 B、C、F、G:ADP活化的血小板骨架蛋白 D:阴性对照 E:组份M
, 百拇医药 如图所示,生理盐水阴性对照组及组份M实验组中,分子量约42KDa的区带比ADP阳性对照组要细浅得多,说明这两组中不溶于TEB溶液的F型肌动蛋白聚合体比ADP诱导激活后的阳性组要少得多,提示组份M具有抑制F型肌动蛋白聚合体形成的作用。
3 讨论
血小板聚集是受激活的血小板通过血浆纤维蛋白原的连接而形成的血小板之间的联结,是血栓形成的初始阶段。血小板活化及聚集的调控机制相当复杂,因而抗血小板聚集的机制也很复杂。蛇毒抗血小板聚集目前认为主要有7种途径[6]。
蛇毒纤维蛋白(原)溶解酶及ADP酶,5′-核苷酸酶是通过选择性酶解血浆纤维蛋白原或聚集诱导物ADP等血小板聚集所依赖的外部因素而发挥其聚集抑制作用,这些酶抑制聚集的作用与其酶活性紧密相关。这类聚集抑制作用在蛇毒中比较普遍存在;然而蛇毒磷脂酶A2抑制血小板聚集的作用与其酶活性缺乏紧密的相关性。即某些种类的蛇毒磷脂酶A2有抑制作用,而有些没有。本文对眼镜蛇毒抑制血小板聚集组份M就上述几种与聚集相关的酶活性进行了分析。结果表明该M组份不含上述酶活性。同时,通过测定血浆乳酸脱氢酶活性,我们进一步排除了组份M在30min内直接溶解血小板膜,释放胞内溶酶体血浆乳酸脱氢酶的可能性(诱导血小板聚集实验共需10~15min)。
, 百拇医药
排除了酶解作用这一外部因素影响血小板聚集的可能性。我们开始考虑组份M对血小板自身影响的可能。肌动蛋白是血小板内骨架蛋白的重要组成部分,它对于血小板变形、聚集及收缩等过程是一个重要影响因素。通过实验,我们发现组份M对血小板内肌动蛋白微丝聚合物的形成有显著的抑制作用,这一结果与该组份抑制多种诱导剂的诱聚作用是相一致的。当然这样一个分子量为14,000Da的蛋白质分子进入细胞内是困难的,那么它在血小板膜上是否存在一个特定的作用位点呢?除骨架蛋白外,它对血小板花生四烯酸代谢过程及血小板释放反应有无影响呢?对于这些问题,我们将进一步深入探讨。
基金项目:广东省自然科学基金资助项目(930190)
参考文献
1 张翔,周元聪.蛇毒磷脂酶A2不同测活方法的评估.生命化学,1994;14(2):41~42
, 百拇医药 2 Jeffrey B.Moran,Collis R.Green.Characterization of a fibrinogenase from northern copperhead(Agkistrodon contortrix mokasen) venom,Biochemic et Biophysica Acta,1981;659:161~168
3 管锦霞,赵延德,杨晓光.我国八种常见毒蛇蛇毒对血凝和纤溶的影响.两栖爬行动物研究,1984;3(2):65~71
4 杨振华,曾芝如.血清5′-核苷酸酶连续监测法测定.冯仁丰主编:实用医学检验学.上海:上海科学技术出版社,1996:444~445
5 阮长耿主编.血小板-基础与临床.上海:上海科技科学出版社,1987:27~28
6 孙林光.蛇毒抑制血小板聚集作用机制的研究进展.广州医学院学报,1997,25(2):102~105
(收稿:1999-02-08), http://www.100md.com