γ-干扰素对增生性瘢痕成纤维细胞影响的实验研究
作者:岑瑛 严小蓉
单位:岑瑛 严小蓉 华西医科大学附属第一医院整形烧伤科(成都,610041)
关键词:γ-干扰素;增生性瘢痕;肌成纤维细胞;成纤维细胞;凋亡
中国修复/990216 【摘 要】 目的 观察γ-干扰素对增生性瘢痕及成纤维细胞的作用,探索γ-干扰素治疗增生性瘢痕的依据。方法 取10例患者增生性瘢痕标本,培养增生性瘢痕的成纤维细胞,取第1代细胞,分为实验组和对照组。实验组加入γ-干扰素 100 U/ml,作用5天,并观察成纤维细胞的细胞计数、肌成纤维细胞分化比例及细胞凋亡率。结果 实验组成纤维细胞计数、肌成纤维细胞分化比例下降,细胞凋亡率增加,与对照组比较有显著性差异(P<0.05)。结论 γ-干扰素抑制成纤维细胞生长,抑制向肌成纤维细胞分化,促进成纤维细胞凋亡。
EFFECT OF γ-INTERFERON ON THE
, http://www.100md.com
FIBROBLASTS IN HYPERTROPHIC SCARS
CEN Ying, YAN Xiao-rong.
Department of Burn and Plastic Surgery, First University Hospital, West China University of Medical Sciences. Chengdu Sichuan, P.R.China 610041
【Abstract】 Objective To study the influence and mechanism of γ-IFN on fibroblasts in hypertrophic scars(HTS). Methods The cultured fibroblastic cells were isolated from the hypertrophic scars of 10 patients. The fibroblasts were divided into two groups, one group was treated with γ-IFN (100 U/ml, 5 days) and the other without γ-IFN as control. The proliferative activity in both groups was investigated and compared by blood cytometer, the proportion of myofibroblast (MFB) and the ratio of apoptosis were examined and analysed between two groups by flow cytometry using α-smooth muscle actin (α-SMA) as marker.Results The proliferative activity was downregulated with γ-IFN. In γ-IFN treated group, the differentiation of MFB were reduced and the decreasing ratio was 3.2% at the 2nd day and up to 10.5% at the 8th day, then it reduced gradually. The apoptosic ratio is 17.7% in γ-IFN treated group, and is 10.9% in control group. The difference was statistically significant.Conclusion γ-IFN could downregulate the proliferation of fibroblasts, decrease the differentiation of MFB and induce the apoptosis. It has beneficial effect in the treatment of hypertrophic scars(HTS).
, 百拇医药
【Key words】γ-interferon Hypertrophic scars Myofibroblast Fibroblast Apoptosis
增生性瘢痕(hypertrophic scars, HTS)是瘢痕过度生长的一种重要类型,可以造成相应部位不同程度的外形改变和功能异常,严重影响美观和健康水平。迄今为止,其病因学,发生、发展机理仍不十分清楚,也没有一种普遍有效的治疗方法。近年来,细胞因子治疗HTS已有越来越多的研究,γ-干扰素(γ-interferon,γ-IFN)是研究较多的一种由活性T细胞分泌的重要负性调节因子,Larrabee等[1]用γ-IFN有效治疗了HTS。我们的实验通过HTS的成纤维细胞(fibroblast, FB)体外培养,观察γ-IFN对HTS的FB体外的细胞计数、向肌成纤维细胞(myofibroblast, MFB)分化比例及凋亡率,探索γ-IFN对HTS的影响及其作用机理,为γ-IFN临床治疗HTS提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料
实验组织标本取自10例烧伤后患者,临床和病理均证实为HTS。其中男6例,女4例。年龄4~48岁,平均23.5岁。病程1~5年,平均2.2年。取材部位:手背3例,颈部2例,肘部2例,腋部2例,膝部1例。经检查所有患者均无全身器质性疾患。
1.2 方法
1.2.1 FB培养 无菌条件下切取10例HTS组织,彻底去除表皮和皮下组织,剪成1 mm3组织块,分别置于10个50 ml培养方瓶内(37℃、5% CO2孵箱),加入含20%胎牛血清的DMEM培养液。每周半量换液两次,培养细胞生长融合成片时传代。取传代的第1代细胞进行实验,每例原代细胞传代后分为18瓶,实验组和空白对照组各9瓶,实验组加入终浓度为100 U/ml的γ-IFN,持续作用5天。
, 百拇医药
1.2.2 电镜观察 在传代后第15天,每例标本各取对照组、实验组细胞一瓶,在日本电子公司JEM-100 SX透射电子显微镜下观察并行照像。
1.2.3 细胞计数 培养第1代细胞第2、4、6、8、10、12及15天分别取每例对照组和实验组各一瓶,胰酶消化后彻底收集细胞,血球计数仪光镜计数,每瓶细胞计数两次,取平均值。
1.2.4 测定MFB分化比例 分别于传代后的第2、4、6、8、10、12及15天取每例对照组和实验组细胞各一瓶,用MFB的典型标记α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)单抗作一抗(40 μl,1∶25,4℃,20小时),加入FITC羊抗鼠IgG作二抗(40 μl,1∶25,4℃,4小时)。流式细胞仪测定,每次测定留置一管不加一抗作为阴性对照。
1.2.5 测定细胞凋亡率 传代后第15天,每例标本各取对照组和实验组一瓶细胞,75%冷乙醇固定后加碘化丙啶染液1 ml(室温,15分钟),作流式细胞仪测定。
, http://www.100md.com
1.2.6 统计学处理 采用多元方差分析及t检验,差异的显著性定为P值<0.05,所有数据均表示为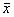 ±s。
±s。
2 结果
2.1 电镜
电镜下观察到传代后第15天,实验组和对照组细胞均存在MFB,胞质内有发达的肌动蛋白微丝及大量的具有平滑肌细胞特征的密体,密体内可见微丝连接,胞质内可见大量扩张粗面内质网,多数核膜切迹大而深。实验组MFB的细胞数量减少,MFB的胞浆内肌动蛋白微丝及密体也普遍减少(图1、2)。
图1 对照组第1代第15天MFB(透射电镜 ×10 000)
, http://www.100md.com
FIg 1 The first generation of MFB at the 15th day in the control group (TEM ×10 000)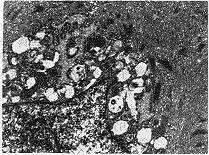
图2 实验组第1代第15天MFB(透射电镜×10 000)
Fig 2 The first generation of MFB at the 15th day in the treated group (TEM ×10 000)
2.2 细胞计数
实验组FB计数在各时间点均低于对照组,减少约0.28×105~1.92×105,但第12、15天的细胞计数经统计学处理无显著性差异(P>0.05),第2天~10天均有显著性差异(P<0.05),见表1。
, http://www.100md.com
表1 增生性瘢痕体外成纤维细胞计数(×105,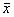 ±s)
±s)
Tab 1 Effect of γ-IFN on the cell count of fibroblasts from HTS in vitro (×105,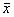 ±s)
±s)
组 别Groups
第2天
第4天
第6天
第8天
第10天
, http://www.100md.com
第12天
第15天
2 d
4 d
6 d
8 d
10 d
12 d
15 d
实验组γ-IFN Treated
0.80±0.22
2.60±0.31
4.32±0.48
, 百拇医药
5.37±0.52
6.36±0.97
8.12±0.93
8.24±0.64
对照组Contol
1.08±0.17
3.12±0.23
5.08±0.76
6.52±0.45
8.28±0.72
8.75±1.04
8.43±0.86
, http://www.100md.com
2.3 MFB分化比例
各时间点实验组与对照组的FB向MFB分化比例有差异,经统计学处理两者有显著性差异(P<0.05)。实验组较对照组MFB降低的比例由第2天的3.2%升至第8天10.5%达高峰,然后逐步降低(图3,表2)。
图3 体外成纤维细胞向肌成纤维细胞分化比例曲线图
Fig 3 Differential ratio of fibroblasts of HIS to MFB in vitro after γ-IFN treated
□ 实验组γ-IFN Treated ý对照组Control
表2 增生性瘢痕的肌成纤维细胞分化比例(%,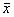 ±s)
±s)
, http://www.100md.com
Tab 2 Effect of γ-IFN on the differential ratio of fibroblasts of HTS to myobibroblasts in vitro(%,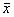 ±s)
±s)
组 别Groups
第2天
第4天
第6天
第8天
第10天
第12天
第15天
, 百拇医药
2 d
4 d
6 d
8 d
10 d
12 d
15 d
实验组γ-IFN Treated
15.9±0.89
18.5±1.18
23.0±1.49
26.7±1.47
, 百拇医药
23.9±1.25
20.4±0.94
18.4±1.37
对照组 Control
19.1±1.05
24.3±1.12
31.4±1.23
37.2±2.14
32.7±1.56
28.6±1.31
22.5±1.41
2.4 细胞凋亡率
, 百拇医药
第1代FB在传代后第15天,实验组和对照组细胞凋亡率分别为17.7%和10.9%,各例实验组的FB凋亡率均明显高于对照组,两者有显著性差异(P<0.05),见表3。
表3 各例第1代第15天增生性瘢痕体外成纤维细胞凋亡率(%)
Tab 3 Effect of γ-IFN on the apoptosic ratio of fibroblasts from HTS at the 15th days in vitro (%)
组 别Groups
病例 Cases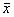 ±s
±s
1
2
, 百拇医药
3
4
5
6
7
8
9
10
实验组 γ-IFN Treated
16.2
18.8
17.9
19.0
, 百拇医药
18.2
18.5
17.2
14.7
17.9
18.1
17.7±1.31
对照组
Control
11.3
10.2
11.0
9.4
, http://www.100md.com
11.3
11.8
9.8
10.2
10.7
12.4
10.9±0.81
3 讨论
现已证明FB与瘢痕形成过程密切相关,具有增殖,迁移,合成细胞外基质如胶原及分化为具有收缩特征的MFB等生物学行为。在正常情况下,FB及MFB通过凋亡消失,创面形成正常瘢痕[2]。在病理条件下,FB行为异常,可引起胶原过度沉积,MFB持续存在,现在已被认为是HTS增生和挛缩的主要原因[3]。近年来研究表明,很多细胞因子都可以参与和影响瘢痕形成及调节MFB分化,γ-IFN为其中一种,它主要具有抗病毒、抗增生、抗肿瘤和免疫调节活性等功能。1989年Kahan用γ-IFN治疗系统性硬皮病有效,Larrabee等[1]用γ-IFN治疗HTS取得明显效果。γ-IFN治疗HTS的详细机理仍不完全清楚,特别是γ-IFN在亚细胞及分子生物学水平对FB及MFB的影响仍需进一步探讨。
, http://www.100md.com
我们在实验中发现,γ-IFN抑制HTS体外FB的生长,这与国内外学者报道一致[4],目前认为系抑制细胞的增殖活性。我们还发现实验组细胞生长虽较对照组慢,但细胞计数仍由0.8×105增至8.24×105,说明γ-IFN不能绝对抑制细胞增殖,而只是抑制了细胞的增长趋势。γ-IFN作用后,细胞增殖能力下降,减少了FB的数量,是γ-IFN抑制HTS增生和挛缩作用机理之一。
创面愈合过程中FB有一个特征的阶段分化为MFB。MFB中存在可区别于其它结缔组织细胞的细胞骨架蛋白α-SMA,也是MFB的主动收缩物质和典型标记。创面正常愈合时,MFB消失,而在HTS体内则持续存在[5]。HTS中持续存在的MFB通过α-SMA的持续收缩,可引起邻近组织、器官继发变形而形成各种挛缩畸形。FB向MFB的分化及MFB的持续存在已被认为是HTS挛缩的细胞基础[3]。
我们在对超微结构的研究中发现,γ-IFN作用后MFB内肌动蛋白微丝、密体较对照组明显减少;利用MFB的典型标记α-SMA作标志,并通过流式细胞仪定量测定,发现在各时间点γ-IFN抑制HTS来源的FB向MFB的分化,我们认为,γ-IFN可以通过抑制FB向MFB分化来抑制与收缩有关的生理和病理过程,如创面愈合、瘢痕挛缩等,与傅小兵等[6]研究类似。该实验观察到γ-IFN使用结束后,其抑制MFB分化作用可持续至第8天达高峰,表明γ-IFN的抑制作用具有后续性,这种后续性有逐渐增强的趋势,此效应报道较少,确切机制尚不清楚。达高峰后实验组逐渐向对照组靠拢,表明γ-IFN在HTS培养FB中的作用具有可逆性,与Desmouliere等[7]报道类似,提示临床使用γ-IFN治疗HTS时应注意观察远期疗效。γ-IFN抑制FB向MFB的分化,减少具有收缩力的MFB存在,是γ-IFN治疗HTS挛缩的重要机理。
, 百拇医药
Desmouliere等[3]发现正常创面愈合后,FB、MFB通过凋亡消失,而体内细胞凋亡减少可能形成HTS。启动和促进HTS中FB的凋亡对HTS的治疗有良好的应用前景。从我们的实验表明,γ-IFN作用后,细胞凋亡率增加,γ-IFN可促进HTS体外FB的凋亡,有人认为是通过FB的DAP激酶介导的,但确切机制尚不清楚[8]。从基因水平对γ-IFN诱导细胞凋亡及细胞凋亡与HTS形成的关系进行研究,有可能是认识的HTS的本质及γ-IFN作用机理的根本途径,从而进一步开展HTS的基因治疗。
我们认为,γ-IFN具有治疗HTS良好的应用前景,但进一步推广运用尚有许多问题需要解决,如γ-IFN的适合剂量、用法、疗程、给药途径、量效的持久性及在体内是否产生抗体等;与其它因子及药物的协同作用,尤其对大面积HTS中的应用及国内大批量临床用药的生产等。但γ-IFN用于HFS提示瘢痕的生物治疗将是今后的研究重点和方向之一。
4 参考文献
, 百拇医药
[1] Larrabee WF, East CA, Jaffe HS, et al. Intralesional interferon gamma treatment for keloids and htypertrophic scars. Arch Otolaryhgoi Head Neck Surg, 1990;116(10):1159
[2] Clark RA. Regulation of fibroplasia in cutaneous wound repair. Am J Med Sci, 1993;306(1):42
[3] Desmouliere A, Badid C, Bochaton PML, et al. Apotosis during wound healing fibrocontractive disease and vasular wall injury. Int J Biochem Cell Bol, 1997;29(1):19
, 百拇医药
[4] Harrop AK, Chahary A, Scott PG, et al. Regulation of collagen synthesis and mRNA expression in normal and hypertrophic scar fibroblasts in vitro by interferon-γ. J Surg Res, 1995;58:471
[5] Darby I, Skalli O, Gabbiani G. α-smooth muscle actin is transiently expressed by myofibroblasts during experimental wound healing. Lab Invest, 1990;63:21
[6] 傅小兵,常国友,王亚平,等.γ-干扰素抑制创伤修复的实验研究.中华整形烧伤外科杂志,1995;11(3):209
, http://www.100md.com
[7] Desmouliere A, Brandt LR, Abdiu A, et al. α-smooth muscle actin is expressed in a subpopulation of cultured and cloned fibroblasts and is modulated by γ-interferon. Exp Cell Res, 1992;92(1):64
[8] Kawai T, Matsumoto M, Takeda K, et al. ZIP Kinase, a novel serine/threonine kinase which mediates apoptosis. Mol Cell Biol, 1998;18(3):1642, 百拇医药
单位:岑瑛 严小蓉 华西医科大学附属第一医院整形烧伤科(成都,610041)
关键词:γ-干扰素;增生性瘢痕;肌成纤维细胞;成纤维细胞;凋亡
中国修复/990216 【摘 要】 目的 观察γ-干扰素对增生性瘢痕及成纤维细胞的作用,探索γ-干扰素治疗增生性瘢痕的依据。方法 取10例患者增生性瘢痕标本,培养增生性瘢痕的成纤维细胞,取第1代细胞,分为实验组和对照组。实验组加入γ-干扰素 100 U/ml,作用5天,并观察成纤维细胞的细胞计数、肌成纤维细胞分化比例及细胞凋亡率。结果 实验组成纤维细胞计数、肌成纤维细胞分化比例下降,细胞凋亡率增加,与对照组比较有显著性差异(P<0.05)。结论 γ-干扰素抑制成纤维细胞生长,抑制向肌成纤维细胞分化,促进成纤维细胞凋亡。
EFFECT OF γ-INTERFERON ON THE
, http://www.100md.com
FIBROBLASTS IN HYPERTROPHIC SCARS
CEN Ying, YAN Xiao-rong.
Department of Burn and Plastic Surgery, First University Hospital, West China University of Medical Sciences. Chengdu Sichuan, P.R.China 610041
【Abstract】 Objective To study the influence and mechanism of γ-IFN on fibroblasts in hypertrophic scars(HTS). Methods The cultured fibroblastic cells were isolated from the hypertrophic scars of 10 patients. The fibroblasts were divided into two groups, one group was treated with γ-IFN (100 U/ml, 5 days) and the other without γ-IFN as control. The proliferative activity in both groups was investigated and compared by blood cytometer, the proportion of myofibroblast (MFB) and the ratio of apoptosis were examined and analysed between two groups by flow cytometry using α-smooth muscle actin (α-SMA) as marker.Results The proliferative activity was downregulated with γ-IFN. In γ-IFN treated group, the differentiation of MFB were reduced and the decreasing ratio was 3.2% at the 2nd day and up to 10.5% at the 8th day, then it reduced gradually. The apoptosic ratio is 17.7% in γ-IFN treated group, and is 10.9% in control group. The difference was statistically significant.Conclusion γ-IFN could downregulate the proliferation of fibroblasts, decrease the differentiation of MFB and induce the apoptosis. It has beneficial effect in the treatment of hypertrophic scars(HTS).
, 百拇医药
【Key words】γ-interferon Hypertrophic scars Myofibroblast Fibroblast Apoptosis
增生性瘢痕(hypertrophic scars, HTS)是瘢痕过度生长的一种重要类型,可以造成相应部位不同程度的外形改变和功能异常,严重影响美观和健康水平。迄今为止,其病因学,发生、发展机理仍不十分清楚,也没有一种普遍有效的治疗方法。近年来,细胞因子治疗HTS已有越来越多的研究,γ-干扰素(γ-interferon,γ-IFN)是研究较多的一种由活性T细胞分泌的重要负性调节因子,Larrabee等[1]用γ-IFN有效治疗了HTS。我们的实验通过HTS的成纤维细胞(fibroblast, FB)体外培养,观察γ-IFN对HTS的FB体外的细胞计数、向肌成纤维细胞(myofibroblast, MFB)分化比例及凋亡率,探索γ-IFN对HTS的影响及其作用机理,为γ-IFN临床治疗HTS提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料
实验组织标本取自10例烧伤后患者,临床和病理均证实为HTS。其中男6例,女4例。年龄4~48岁,平均23.5岁。病程1~5年,平均2.2年。取材部位:手背3例,颈部2例,肘部2例,腋部2例,膝部1例。经检查所有患者均无全身器质性疾患。
1.2 方法
1.2.1 FB培养 无菌条件下切取10例HTS组织,彻底去除表皮和皮下组织,剪成1 mm3组织块,分别置于10个50 ml培养方瓶内(37℃、5% CO2孵箱),加入含20%胎牛血清的DMEM培养液。每周半量换液两次,培养细胞生长融合成片时传代。取传代的第1代细胞进行实验,每例原代细胞传代后分为18瓶,实验组和空白对照组各9瓶,实验组加入终浓度为100 U/ml的γ-IFN,持续作用5天。
, 百拇医药
1.2.2 电镜观察 在传代后第15天,每例标本各取对照组、实验组细胞一瓶,在日本电子公司JEM-100 SX透射电子显微镜下观察并行照像。
1.2.3 细胞计数 培养第1代细胞第2、4、6、8、10、12及15天分别取每例对照组和实验组各一瓶,胰酶消化后彻底收集细胞,血球计数仪光镜计数,每瓶细胞计数两次,取平均值。
1.2.4 测定MFB分化比例 分别于传代后的第2、4、6、8、10、12及15天取每例对照组和实验组细胞各一瓶,用MFB的典型标记α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)单抗作一抗(40 μl,1∶25,4℃,20小时),加入FITC羊抗鼠IgG作二抗(40 μl,1∶25,4℃,4小时)。流式细胞仪测定,每次测定留置一管不加一抗作为阴性对照。
1.2.5 测定细胞凋亡率 传代后第15天,每例标本各取对照组和实验组一瓶细胞,75%冷乙醇固定后加碘化丙啶染液1 ml(室温,15分钟),作流式细胞仪测定。
, http://www.100md.com
1.2.6 统计学处理 采用多元方差分析及t检验,差异的显著性定为P值<0.05,所有数据均表示为
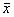 ±s。
±s。2 结果
2.1 电镜
电镜下观察到传代后第15天,实验组和对照组细胞均存在MFB,胞质内有发达的肌动蛋白微丝及大量的具有平滑肌细胞特征的密体,密体内可见微丝连接,胞质内可见大量扩张粗面内质网,多数核膜切迹大而深。实验组MFB的细胞数量减少,MFB的胞浆内肌动蛋白微丝及密体也普遍减少(图1、2)。

图1 对照组第1代第15天MFB(透射电镜 ×10 000)
, http://www.100md.com
FIg 1 The first generation of MFB at the 15th day in the control group (TEM ×10 000)

图2 实验组第1代第15天MFB(透射电镜×10 000)
Fig 2 The first generation of MFB at the 15th day in the treated group (TEM ×10 000)
2.2 细胞计数
实验组FB计数在各时间点均低于对照组,减少约0.28×105~1.92×105,但第12、15天的细胞计数经统计学处理无显著性差异(P>0.05),第2天~10天均有显著性差异(P<0.05),见表1。
, http://www.100md.com
表1 增生性瘢痕体外成纤维细胞计数(×105,
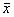 ±s)
±s)Tab 1 Effect of γ-IFN on the cell count of fibroblasts from HTS in vitro (×105,
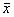 ±s)
±s)组 别Groups
第2天
第4天
第6天
第8天
第10天
, http://www.100md.com
第12天
第15天
2 d
4 d
6 d
8 d
10 d
12 d
15 d
实验组γ-IFN Treated
0.80±0.22
2.60±0.31
4.32±0.48
, 百拇医药
5.37±0.52
6.36±0.97
8.12±0.93
8.24±0.64
对照组Contol
1.08±0.17
3.12±0.23
5.08±0.76
6.52±0.45
8.28±0.72
8.75±1.04
8.43±0.86
, http://www.100md.com
2.3 MFB分化比例
各时间点实验组与对照组的FB向MFB分化比例有差异,经统计学处理两者有显著性差异(P<0.05)。实验组较对照组MFB降低的比例由第2天的3.2%升至第8天10.5%达高峰,然后逐步降低(图3,表2)。

图3 体外成纤维细胞向肌成纤维细胞分化比例曲线图
Fig 3 Differential ratio of fibroblasts of HIS to MFB in vitro after γ-IFN treated
□ 实验组γ-IFN Treated ý对照组Control
表2 增生性瘢痕的肌成纤维细胞分化比例(%,
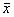 ±s)
±s), http://www.100md.com
Tab 2 Effect of γ-IFN on the differential ratio of fibroblasts of HTS to myobibroblasts in vitro(%,
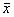 ±s)
±s)组 别Groups
第2天
第4天
第6天
第8天
第10天
第12天
第15天
, 百拇医药
2 d
4 d
6 d
8 d
10 d
12 d
15 d
实验组γ-IFN Treated
15.9±0.89
18.5±1.18
23.0±1.49
26.7±1.47
, 百拇医药
23.9±1.25
20.4±0.94
18.4±1.37
对照组 Control
19.1±1.05
24.3±1.12
31.4±1.23
37.2±2.14
32.7±1.56
28.6±1.31
22.5±1.41
2.4 细胞凋亡率
, 百拇医药
第1代FB在传代后第15天,实验组和对照组细胞凋亡率分别为17.7%和10.9%,各例实验组的FB凋亡率均明显高于对照组,两者有显著性差异(P<0.05),见表3。
表3 各例第1代第15天增生性瘢痕体外成纤维细胞凋亡率(%)
Tab 3 Effect of γ-IFN on the apoptosic ratio of fibroblasts from HTS at the 15th days in vitro (%)
组 别Groups
病例 Cases
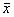 ±s
±s1
2
, 百拇医药
3
4
5
6
7
8
9
10
实验组 γ-IFN Treated
16.2
18.8
17.9
19.0
, 百拇医药
18.2
18.5
17.2
14.7
17.9
18.1
17.7±1.31
对照组
Control
11.3
10.2
11.0
9.4
, http://www.100md.com
11.3
11.8
9.8
10.2
10.7
12.4
10.9±0.81
3 讨论
现已证明FB与瘢痕形成过程密切相关,具有增殖,迁移,合成细胞外基质如胶原及分化为具有收缩特征的MFB等生物学行为。在正常情况下,FB及MFB通过凋亡消失,创面形成正常瘢痕[2]。在病理条件下,FB行为异常,可引起胶原过度沉积,MFB持续存在,现在已被认为是HTS增生和挛缩的主要原因[3]。近年来研究表明,很多细胞因子都可以参与和影响瘢痕形成及调节MFB分化,γ-IFN为其中一种,它主要具有抗病毒、抗增生、抗肿瘤和免疫调节活性等功能。1989年Kahan用γ-IFN治疗系统性硬皮病有效,Larrabee等[1]用γ-IFN治疗HTS取得明显效果。γ-IFN治疗HTS的详细机理仍不完全清楚,特别是γ-IFN在亚细胞及分子生物学水平对FB及MFB的影响仍需进一步探讨。
, http://www.100md.com
我们在实验中发现,γ-IFN抑制HTS体外FB的生长,这与国内外学者报道一致[4],目前认为系抑制细胞的增殖活性。我们还发现实验组细胞生长虽较对照组慢,但细胞计数仍由0.8×105增至8.24×105,说明γ-IFN不能绝对抑制细胞增殖,而只是抑制了细胞的增长趋势。γ-IFN作用后,细胞增殖能力下降,减少了FB的数量,是γ-IFN抑制HTS增生和挛缩作用机理之一。
创面愈合过程中FB有一个特征的阶段分化为MFB。MFB中存在可区别于其它结缔组织细胞的细胞骨架蛋白α-SMA,也是MFB的主动收缩物质和典型标记。创面正常愈合时,MFB消失,而在HTS体内则持续存在[5]。HTS中持续存在的MFB通过α-SMA的持续收缩,可引起邻近组织、器官继发变形而形成各种挛缩畸形。FB向MFB的分化及MFB的持续存在已被认为是HTS挛缩的细胞基础[3]。
我们在对超微结构的研究中发现,γ-IFN作用后MFB内肌动蛋白微丝、密体较对照组明显减少;利用MFB的典型标记α-SMA作标志,并通过流式细胞仪定量测定,发现在各时间点γ-IFN抑制HTS来源的FB向MFB的分化,我们认为,γ-IFN可以通过抑制FB向MFB分化来抑制与收缩有关的生理和病理过程,如创面愈合、瘢痕挛缩等,与傅小兵等[6]研究类似。该实验观察到γ-IFN使用结束后,其抑制MFB分化作用可持续至第8天达高峰,表明γ-IFN的抑制作用具有后续性,这种后续性有逐渐增强的趋势,此效应报道较少,确切机制尚不清楚。达高峰后实验组逐渐向对照组靠拢,表明γ-IFN在HTS培养FB中的作用具有可逆性,与Desmouliere等[7]报道类似,提示临床使用γ-IFN治疗HTS时应注意观察远期疗效。γ-IFN抑制FB向MFB的分化,减少具有收缩力的MFB存在,是γ-IFN治疗HTS挛缩的重要机理。
, 百拇医药
Desmouliere等[3]发现正常创面愈合后,FB、MFB通过凋亡消失,而体内细胞凋亡减少可能形成HTS。启动和促进HTS中FB的凋亡对HTS的治疗有良好的应用前景。从我们的实验表明,γ-IFN作用后,细胞凋亡率增加,γ-IFN可促进HTS体外FB的凋亡,有人认为是通过FB的DAP激酶介导的,但确切机制尚不清楚[8]。从基因水平对γ-IFN诱导细胞凋亡及细胞凋亡与HTS形成的关系进行研究,有可能是认识的HTS的本质及γ-IFN作用机理的根本途径,从而进一步开展HTS的基因治疗。
我们认为,γ-IFN具有治疗HTS良好的应用前景,但进一步推广运用尚有许多问题需要解决,如γ-IFN的适合剂量、用法、疗程、给药途径、量效的持久性及在体内是否产生抗体等;与其它因子及药物的协同作用,尤其对大面积HTS中的应用及国内大批量临床用药的生产等。但γ-IFN用于HFS提示瘢痕的生物治疗将是今后的研究重点和方向之一。
4 参考文献
, 百拇医药
[1] Larrabee WF, East CA, Jaffe HS, et al. Intralesional interferon gamma treatment for keloids and htypertrophic scars. Arch Otolaryhgoi Head Neck Surg, 1990;116(10):1159
[2] Clark RA. Regulation of fibroplasia in cutaneous wound repair. Am J Med Sci, 1993;306(1):42
[3] Desmouliere A, Badid C, Bochaton PML, et al. Apotosis during wound healing fibrocontractive disease and vasular wall injury. Int J Biochem Cell Bol, 1997;29(1):19
, 百拇医药
[4] Harrop AK, Chahary A, Scott PG, et al. Regulation of collagen synthesis and mRNA expression in normal and hypertrophic scar fibroblasts in vitro by interferon-γ. J Surg Res, 1995;58:471
[5] Darby I, Skalli O, Gabbiani G. α-smooth muscle actin is transiently expressed by myofibroblasts during experimental wound healing. Lab Invest, 1990;63:21
[6] 傅小兵,常国友,王亚平,等.γ-干扰素抑制创伤修复的实验研究.中华整形烧伤外科杂志,1995;11(3):209
, http://www.100md.com
[7] Desmouliere A, Brandt LR, Abdiu A, et al. α-smooth muscle actin is expressed in a subpopulation of cultured and cloned fibroblasts and is modulated by γ-interferon. Exp Cell Res, 1992;92(1):64
[8] Kawai T, Matsumoto M, Takeda K, et al. ZIP Kinase, a novel serine/threonine kinase which mediates apoptosis. Mol Cell Biol, 1998;18(3):1642, 百拇医药