微量稀释法测定抗酵母样菌药物最小抑菌浓度(MIC)的两种终点判定法比较
作者:陆小军 康梅 徐克和 刘际芬 潘培根 陈拯
单位:华西医科大学附属第一医院检验科(成都 610041)
关键词:
华西医学WEST CHINA MEDICAL JOURNAL1999年 第14卷 第2期 Vol [中图分类号]R927.1;R969.4 [文献标识码]D
[文章编号]1002-0179(1999)02-0235-02
许多因素可影响抗酵母样菌药物体外药敏结果,包括选用的方法,培养基,接种菌量,孵育温度和时间,终点判定方法等。其中终点判定方法是最为直接的重要影响因素。本文就两种终点判定即肉眼观察法和分光光度法加以比较讨论。
1 材料与方法
, http://www.100md.com
1.1 材料
1.1.1 抗酵母样菌药 两性霉素B标准品购自卫生部药品生物制品检定所,5-氟胞嘧啶标准品由上海瑞金医院提供,酮康唑、依曲康唑、氟康唑、咪康唑标准品由杨森公司提供。
1.1.2 培养基 RPMI 1640 过滤除菌。
1.1.3 试验菌株 175株酵母样菌来自临床送检的血液、脑脊液、痰和尿标本,由华西医科大学附一院细菌室鉴定。其中白色念珠菌63株,热带念珠菌51株,类星形念珠菌13株,高里氏念珠菌18株,克柔氏念珠菌2株,伪热带念珠菌6株,近平滑念珠菌2株,球拟酵母样菌19株,皱落念珠菌1株。
1.2 方法
1.2.1 药物标准品稀释 两性霉素B:二甲亚枫溶解,双蒸水稀释至1600μg/ml。5-氟胞嘧啶:用双蒸水稀释至3200μg/ml。酮康唑:HCL溶解,双蒸水稀释至1600μg/ml。咪康唑:用双蒸水溶解至3200μg/ml。氟康唑:二甲亚枫溶解,双蒸水稀释至1600μg/ml。依曲康唑:无水乙醇溶解,双蒸水稀释至1600μg/ml。
, 百拇医药
1.2.2 菌液制备 将在沙氏斜面上生长了24小时(35℃)的纯菌株,用RPMI1640液体培养基稀释,最终浓度为1~5×103CFU/ml。
1.2.3 微量稀释法 参照1995年NCCLS推荐的酵母样菌微量稀释法抗酵母样菌药物敏感试验参考方案〔1〕进行。
1.2.4 两种终点判定法标准
1.2.4.1 分光光度法 用微量振荡器摇晃微量板5分钟后,用Bio-Rad450型酶标仪,波长492nm阅读结果。MIC终点的计算值符合以下标准。%T≥C%×TK+0.5×(100-%TK),其中T是透光率,K是无药孔生长对照透光率,公式可换算为A≤0.301-1g(1+10-AK),记为MIC-A〔2〕。
1.2.4.2 肉眼观察法 按以下标准记录MIC结果。 :菌生长与生长对照相当,无抑菌作用;
:菌生长与生长对照相当,无抑菌作用; 菌生长较生长对照轻度减少,即MIC-3;
菌生长较生长对照轻度减少,即MIC-3;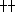 :菌生长较生长对照明显减少,即MIC-2;+:只有薄层菌生长,即MIC-1;0:清晰透明,即MIC-0。
:菌生长较生长对照明显减少,即MIC-2;+:只有薄层菌生长,即MIC-1;0:清晰透明,即MIC-0。
, http://www.100md.com
2 结果
将肉眼观察法按“0、+、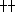 ”标准打出的MIC结果平均值与分光光度法得出的MIC结果平均值相比较,以两者的比值来表明其差异的大小(见表1)。
”标准打出的MIC结果平均值与分光光度法得出的MIC结果平均值相比较,以两者的比值来表明其差异的大小(见表1)。
表1.肉眼观察法与分光光度法判定抗酵母样菌药物MIC的比值 药 物
MIC-0/MIC-A
MIC-1/MIC-A
MIC-2/MIC-A
两性霉素B
4.23
1.36
, 百拇医药
2.00
5-氟嘧啶
3.84
1.01
1.25
酮康唑
484.38
0.53
3.86
咪康唑
867.07
1.72
4.06
, http://www.100md.com
氟康唑
116.97
0.48
6.41
依曲康唑
256.00
2.03
5.46
(注:MIC-n/MIC-A值越接近1表明用分光光度法得出的MIC结果和肉眼观察法按“n”标准打出的MIC结果有越好的一致性。)
3 讨论
MIC通常以“0”生长作为判定标准,但是目前在实验中发现所用的抗酵母样菌药物除两性霉素B外,其它药物特别是咪唑类药物如酮康唑、咪康唑、氟康唑等除了含低浓度抑菌药培养基中菌的生长可为“ 、
、 、
、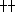 ”外,其余含药量较高的培养基中菌呈连续的“+”生长。故若以“+”生长作为MIC判定标准,则药物浓度就会高到病人无法接受的程度。而在临床上,参考“+”生长判定的MIC值来治疗也有明显的效果,并且药物浓度在病人可接受的范围内〔3~4〕。
”外,其余含药量较高的培养基中菌呈连续的“+”生长。故若以“+”生长作为MIC判定标准,则药物浓度就会高到病人无法接受的程度。而在临床上,参考“+”生长判定的MIC值来治疗也有明显的效果,并且药物浓度在病人可接受的范围内〔3~4〕。
, http://www.100md.com
以“0”生长作为判定标准,由于受观察者主观因素的影响,同一份标本的MIC值也可能相差数倍以上,故肉眼观察法并非理想的终点判定方法。分光光度法是通过测定各孔的吸光度来反映生长情况,具有客观、定量、迅速简便及重复性好等优点。只要根据公式计算出临界值(即相当于“+”生长的最高吸光度)即可确定出MIC值。从本文的实验结果可看出,分光光度法测定的MIC值与肉眼观察法中以“+”为标准得到的MIC值有较好的一致性,差异多在2倍以内,而以“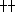 ”和“0”为标准的MIC值则相差甚远。本文的实验结果证实了用更易标准化的分光光度法来替代肉眼观察法作为微量法测定抗酵母样菌药物MIC的终点判定方法是可行的。
”和“0”为标准的MIC值则相差甚远。本文的实验结果证实了用更易标准化的分光光度法来替代肉眼观察法作为微量法测定抗酵母样菌药物MIC的终点判定方法是可行的。
本文为纽约中华医学基金会资助(CMB92-558)
3 参考文献
1 National Committee for Clinical Laboratory Standards.Reference method for broth dilution antifungal susceptibility testing of years;Tentative standards.Document M27-T,Wayne Pennsylvania:NCCLS,1995;15∶1~22.
, 百拇医药
2 R.Guinet,et al.Collabrative evaluation inserum laboratoris of a standardized micromethod for yeast susceptibility testing.J.Clin.Microbiol.1998;26∶2307~2312.
3 Ghannoum M A,Rex J H,Galgiani J N:susceptibility testing of fungi∶current status of conelation of in vitro data with clinical outcome.J Clin Microbiol,1996;34∶489.
4 Michael,A.Pfaller,et al.Collaborative investigative of variable in susceptiaility testing of yeast.Antimicrobial agents and Chemotherapy.1990;34∶1648~1654.
(收稿日期:1999-03-28), 百拇医药
单位:华西医科大学附属第一医院检验科(成都 610041)
关键词:
华西医学WEST CHINA MEDICAL JOURNAL1999年 第14卷 第2期 Vol [中图分类号]R927.1;R969.4 [文献标识码]D
[文章编号]1002-0179(1999)02-0235-02
许多因素可影响抗酵母样菌药物体外药敏结果,包括选用的方法,培养基,接种菌量,孵育温度和时间,终点判定方法等。其中终点判定方法是最为直接的重要影响因素。本文就两种终点判定即肉眼观察法和分光光度法加以比较讨论。
1 材料与方法
, http://www.100md.com
1.1 材料
1.1.1 抗酵母样菌药 两性霉素B标准品购自卫生部药品生物制品检定所,5-氟胞嘧啶标准品由上海瑞金医院提供,酮康唑、依曲康唑、氟康唑、咪康唑标准品由杨森公司提供。
1.1.2 培养基 RPMI 1640 过滤除菌。
1.1.3 试验菌株 175株酵母样菌来自临床送检的血液、脑脊液、痰和尿标本,由华西医科大学附一院细菌室鉴定。其中白色念珠菌63株,热带念珠菌51株,类星形念珠菌13株,高里氏念珠菌18株,克柔氏念珠菌2株,伪热带念珠菌6株,近平滑念珠菌2株,球拟酵母样菌19株,皱落念珠菌1株。
1.2 方法
1.2.1 药物标准品稀释 两性霉素B:二甲亚枫溶解,双蒸水稀释至1600μg/ml。5-氟胞嘧啶:用双蒸水稀释至3200μg/ml。酮康唑:HCL溶解,双蒸水稀释至1600μg/ml。咪康唑:用双蒸水溶解至3200μg/ml。氟康唑:二甲亚枫溶解,双蒸水稀释至1600μg/ml。依曲康唑:无水乙醇溶解,双蒸水稀释至1600μg/ml。
, 百拇医药
1.2.2 菌液制备 将在沙氏斜面上生长了24小时(35℃)的纯菌株,用RPMI1640液体培养基稀释,最终浓度为1~5×103CFU/ml。
1.2.3 微量稀释法 参照1995年NCCLS推荐的酵母样菌微量稀释法抗酵母样菌药物敏感试验参考方案〔1〕进行。
1.2.4 两种终点判定法标准
1.2.4.1 分光光度法 用微量振荡器摇晃微量板5分钟后,用Bio-Rad450型酶标仪,波长492nm阅读结果。MIC终点的计算值符合以下标准。%T≥C%×TK+0.5×(100-%TK),其中T是透光率,K是无药孔生长对照透光率,公式可换算为A≤0.301-1g(1+10-AK),记为MIC-A〔2〕。
1.2.4.2 肉眼观察法 按以下标准记录MIC结果。
 :菌生长与生长对照相当,无抑菌作用;
:菌生长与生长对照相当,无抑菌作用; 菌生长较生长对照轻度减少,即MIC-3;
菌生长较生长对照轻度减少,即MIC-3;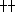 :菌生长较生长对照明显减少,即MIC-2;+:只有薄层菌生长,即MIC-1;0:清晰透明,即MIC-0。
:菌生长较生长对照明显减少,即MIC-2;+:只有薄层菌生长,即MIC-1;0:清晰透明,即MIC-0。, http://www.100md.com
2 结果
将肉眼观察法按“0、+、
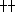 ”标准打出的MIC结果平均值与分光光度法得出的MIC结果平均值相比较,以两者的比值来表明其差异的大小(见表1)。
”标准打出的MIC结果平均值与分光光度法得出的MIC结果平均值相比较,以两者的比值来表明其差异的大小(见表1)。表1.肉眼观察法与分光光度法判定抗酵母样菌药物MIC的比值 药 物
MIC-0/MIC-A
MIC-1/MIC-A
MIC-2/MIC-A
两性霉素B
4.23
1.36
, 百拇医药
2.00
5-氟嘧啶
3.84
1.01
1.25
酮康唑
484.38
0.53
3.86
咪康唑
867.07
1.72
4.06
, http://www.100md.com
氟康唑
116.97
0.48
6.41
依曲康唑
256.00
2.03
5.46
(注:MIC-n/MIC-A值越接近1表明用分光光度法得出的MIC结果和肉眼观察法按“n”标准打出的MIC结果有越好的一致性。)
3 讨论
MIC通常以“0”生长作为判定标准,但是目前在实验中发现所用的抗酵母样菌药物除两性霉素B外,其它药物特别是咪唑类药物如酮康唑、咪康唑、氟康唑等除了含低浓度抑菌药培养基中菌的生长可为“
 、
、 、
、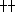 ”外,其余含药量较高的培养基中菌呈连续的“+”生长。故若以“+”生长作为MIC判定标准,则药物浓度就会高到病人无法接受的程度。而在临床上,参考“+”生长判定的MIC值来治疗也有明显的效果,并且药物浓度在病人可接受的范围内〔3~4〕。
”外,其余含药量较高的培养基中菌呈连续的“+”生长。故若以“+”生长作为MIC判定标准,则药物浓度就会高到病人无法接受的程度。而在临床上,参考“+”生长判定的MIC值来治疗也有明显的效果,并且药物浓度在病人可接受的范围内〔3~4〕。, http://www.100md.com
以“0”生长作为判定标准,由于受观察者主观因素的影响,同一份标本的MIC值也可能相差数倍以上,故肉眼观察法并非理想的终点判定方法。分光光度法是通过测定各孔的吸光度来反映生长情况,具有客观、定量、迅速简便及重复性好等优点。只要根据公式计算出临界值(即相当于“+”生长的最高吸光度)即可确定出MIC值。从本文的实验结果可看出,分光光度法测定的MIC值与肉眼观察法中以“+”为标准得到的MIC值有较好的一致性,差异多在2倍以内,而以“
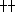 ”和“0”为标准的MIC值则相差甚远。本文的实验结果证实了用更易标准化的分光光度法来替代肉眼观察法作为微量法测定抗酵母样菌药物MIC的终点判定方法是可行的。
”和“0”为标准的MIC值则相差甚远。本文的实验结果证实了用更易标准化的分光光度法来替代肉眼观察法作为微量法测定抗酵母样菌药物MIC的终点判定方法是可行的。本文为纽约中华医学基金会资助(CMB92-558)
3 参考文献
1 National Committee for Clinical Laboratory Standards.Reference method for broth dilution antifungal susceptibility testing of years;Tentative standards.Document M27-T,Wayne Pennsylvania:NCCLS,1995;15∶1~22.
, 百拇医药
2 R.Guinet,et al.Collabrative evaluation inserum laboratoris of a standardized micromethod for yeast susceptibility testing.J.Clin.Microbiol.1998;26∶2307~2312.
3 Ghannoum M A,Rex J H,Galgiani J N:susceptibility testing of fungi∶current status of conelation of in vitro data with clinical outcome.J Clin Microbiol,1996;34∶489.
4 Michael,A.Pfaller,et al.Collaborative investigative of variable in susceptiaility testing of yeast.Antimicrobial agents and Chemotherapy.1990;34∶1648~1654.
(收稿日期:1999-03-28), 百拇医药