反转录病毒载体介导的人β-珠蛋白基因在小鼠体内整合和表达的实验研究
作者:翟锦彬 刘德培 王晶 陈迪 郑勇 梁植权
单位:100005 北京,中国医学科学院基础医学研究所、中国协和医科大学基础医学院医学分子生物学国家重点实验室
关键词:珠蛋白;基因表达;β地中海贫血
中华医学杂志990214 【摘要】 目的 探讨反转录病毒载体介导的携带小片段5′HS2增强子的β-珠蛋白基因在小鼠体内整合与表达状态,对能否应用于临床地中海贫血基因治疗作出初步的评价。方法 用“乒乓”超感染方法筛选具有较高病毒滴度的单向性产病毒细胞系,采用回体(ex vivo)基因转移策略,分析人β-珠蛋白基因在小鼠体内的整合及表达。结果 病毒重组体的病毒滴度在“乒乓”超感染后有明显提高,最高病毒滴度约为1×106CFU/ml;在小鼠CFU-S12(第12天脾结节)中检测到2个重组体中人β-珠蛋白基因的整合,表达水平约为内源性鼠α-珠蛋白基因的0.5%~5%。在2只长期造血重建小鼠的骨髓、脾、胸腺及另一只小鼠的骨髓及脾中整合有人β-珠蛋白基因,在一只重建小鼠的骨髓和脾中有人β-珠蛋白基因表达,约为鼠α-珠蛋白基因的7%。结论 反转录病毒载体介导的人β-珠蛋白基因可稳定整合在小鼠骨髓造血干细胞中,并呈现红系组织特异性表达。
, http://www.100md.com
Retroviral transfer of a human β-globin gene linked to β locus control region hypersensitive site 2 into murine hematopoietic stem cells ZHAI Jinbin, LIU Depei,WANG Jing, et al. National Laboratory of Medical Molecular Biology,Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences, School of Basic Medicine, Peking Union Medical College, Beijing 100005
【Abstract】 Objective To examine the in vivo properties of retroviral recombinants carrying partially deleted human β-globin gene (Δβ) and truncated erythroid enhancer (292 bp and 341 bp of 5′HS2) at the mRNA levels following short- and long-term reconstitution in mice with infected marrow cells.Methods First ecotropic virus producer cell lines with higher virus titers were isolated using “ping-pong” procedures. Then the human β-globin gene was transferred into murine hematopoietic progenitor cells and the integration and expression of transferred gene were analyzed by southern blot and RNase protection assay or RT-PCR. Results The virus titers of both recombinants increased obviously after “ping-pong” procedures. The transferred human β-globin gene was detected in murine CFU-S12 and the expression level was about 0.5%~5% of endogenous mouse α-globin gene. In 3 of 14 mice surviving long-term transplanted with bone marrow cells transduced with high-titer virus, bone marrow, spleen and thymus from two mice and bone marrow and spleen from another mouse contained the intact proviral genome. Long-term expression of the transferred gene was seen in one mouse at level of 7% of endogenous murine α-globin gene.Conclusions The transferred human β-globin gene can stably integrate into murine hematopoietic stem cells mediated by retroviral vectors and express in an erythroid-specific manner.
, 百拇医药
【Key words】 Globin Gene expression Beta-thalassemia
(Natl Med J China, 1999,79:121-124)
β-地中海贫血是人类常见的一种遗传病,发生的原因是β-珠蛋白链合成减少或不能合成,导致α类和β类珠蛋白失衡,使造血系统中的红系细胞功能缺陷。造血干细胞具有重建个体造血系统的全能性和自我更新的能力,理论上将正常β-珠蛋白基因导入造血干细胞并输回体内,使之获得适宜表达,病人将获得终生治疗,此即β-地中海贫血的基因治疗。反转录病毒载体因其基因转移的效率高而被广泛应用于造血干细胞的基因转移。本研究室发现,包含NFE-2/AP-1结合位点的292 bp和341 bp 5′HS2增强子可使部分缺失第二内含子的β-珠蛋白基因在鼠红白血病(MEL)细胞中的表达水平与内源性鼠α-珠蛋白基因可比,而且前病毒整合较稳定,具有较高的病毒滴度[1],因此,我们进一步探讨了在小鼠体内的整合与表达状态。
, 百拇医药
材料与方法
一、材料
1.病毒载体和重组体: N2A、N2A.Δβ.E292和N2A.Δβ.E341(含292 bp或341 bp 5′HS2核心序列和部分缺失第二内含子的β-珠蛋白基因反转录病毒重组体)由本室提供。
2.细胞系:Ψ-2、PA317、NIH3T3由本室提供。
3. 实验小鼠:近交系小鼠C57BL/6购自中国医学科学院实验动物研究所繁殖场。
二、 方法
1.高病毒滴度β-珠蛋白基因产病毒细胞系的建立: 做“乒乓”超感染[2],然后测定其病毒滴度[3]及前病毒的完整性,并检测是否有辅助病毒的产生。
, 百拇医药
2.小鼠骨髓细胞的基因转移和骨髓移植: 取6~8周雄性C57BL/6小鼠,尾静脉注射5-氟脲嘧啶(5-FU)0.15 mg/g体重, 48小时后游离股骨,冲取骨髓, 制备骨髓细胞[4],在含25 U/ml小鼠白细胞介素3和100 U/ml人白细胞介素6的IMDM中培养48小时,然后与产病毒细胞系共同培养24小时,收集小鼠骨髓细胞,移植于经全身致死性照射的受体鼠中。移植后第12天作短期整合表达检测。移植后4~5个月,做长期整合表达检测。
3. 人β-珠蛋白基因在小鼠体内整合与表达检测:(1)Southern blot分析:反转录病毒载体N2A两端LTR上各仅有一个SacI位点,取10 μg样品基因组DNA用SacI酶切,按标准方法做Southern blot分析[5]。(2)RT-PCR[6]:按Promega公司AMV Reverse Transcriptase说明书的实验程序合成cDNA第一链;人β-珠蛋白基因引物为: 5′-ACACAACTGTGTTCA CTAGCAACCTCA-3′和5′-GGTTGCCCATAACAG CATCAGGAGT-3′,鼠α-珠蛋白基因引物为5′-GAT TCTGACAGACTCAGGAAGAAAC-3′和5′-CCTTTC CAGGGCTTCAGCTCCATAT-3′, PCR反应条件:94 ℃变性4分钟; 94 ℃变性1分钟, 58 ℃退火1分钟,72 ℃延伸1分钟, 循环20次; 72 ℃延伸8分钟。取5 μl反应液,8%聚丙烯酰胺凝胶电泳,-70 ℃放射自显影。(3) RNase保护分析[7]:按Promega公司Riboprobe Gemini System合成小鼠α-和人β-珠蛋白RNA探针,取10 μg样品RNA, 10 μg酵母tRNA, hβ RNA探针2×105和mαRNA探针1×105,在18 μl杂交缓冲液(PH 7.4), 1 mmol/L EDTA, 0.1% SDS, 75%甲酰胺)中55 ℃杂交过夜。样品经RNase T1和RNase A消化, 蛋白酶K灭活RNase,乙醇沉淀,溶于10 μl含甲酰胺的上样缓冲液,上样于变性的4%聚丙烯酰胺凝胶,-70 ℃放射自显影。
, 百拇医药
结 果
一、具较高病毒滴度的产病毒细胞系的建立
N2A.Δβ.E292和N2A. Δβ.E341的Ψ2产病毒细胞系病毒滴度经“乒乓”超感染后均有明显提高, 经检测没有辅助病毒的产生(表1、2)。此时重组体N2A.Δβ.E292发生了缺失或部分缺失(图1); N2A. Δβ.E341仍保持了完整的前病毒(图2)。
表1 超感染前重组体N2A.Δβ.E292和N2A.Δβ.E341产病毒细胞系特点 细胞系
病毒滴度(CFU/ml)
前病毒完整性
N2A.Δβ.E292/Ψ2
, 百拇医药 1.7×104
100%
N2A.Δβ.E341/Ψ2
4.7×104
100%
表2 超感染后重组体N2A.Δβ.E292和N2A.Δβ.E341产病毒细胞系特点 产病毒细胞系
病毒滴度(CFU/ml)
病毒完整性
1.5×105
, 百拇医药
6.0×105
9.0×105
2.5×105
1.2×106
-
-
-
-
-
8.0×105
, http://www.100md.com 6.8×105
2.5×105
5.0×104
1.6×106
+
+
+
-
+
1.质粒对照(6.4 kb); 2.人基因组DNA(7.8kb). 3.N2A. Δβ.E292 Ψ2细胞池;4~6.N2A. Δβ.E292 Ψ2细胞克隆:D2, D4,D6. 7.N2A. Δβ.E341 Ψ2细胞池
, 百拇医药
图1 超感染后重组体N2A.Δβ.E292 Ψ2产病毒细胞Southern blot分析
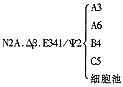
1.人基因组DNA(7.8 kb); 2. 阴性对照;3.“乒乓”超感染后N2A.Δβ.E292Ψ2细胞池;4.N2A.Δβ.E341 Ψ2细胞池;5~7.N2A.Δβ.E341 Ψ2细胞克隆:A3,A6,B4;8.“乒乓”超感染前N2A.Δβ.E341 Ψ2细胞池
图2 超感染后重组体N2A.Δβ.E341 Ψ2产病毒细胞Southern blot分析
二、人β-珠蛋白基因在CFU-S12中整合与表达
对重组体N2A.Δβ.E292,在检测的57个CFU-S12中有31个整合有人β-珠蛋白基因,未发生进一步的缺失重排(图3),对重组体N2A.Δβ.E341,在检测的30个CFU-S12中9个CFU-S12整合有完整的人β-珠蛋白基因(图4)。
, http://www.100md.com
1.质粒对照;3.人基因组DNA(7.8 kb);4.阴性对照.5~15.CFU-S12克隆
图3 包含N2A.Δβ.E292的CFU-S12 Southern blot分析
1.质粒对照;2.人基因组DNA(7.8 kb);3.阴性对照.其余为CFU-S12样品
图4 包含N2A.Δβ.E341的CFU-S12 Southern blot分析
两个重组体中的人β-珠蛋白基因在小鼠CFU-S12中表达水平约为小鼠内源性α的0.5%~5%(图5A,5B)。
, 百拇医药
A.N2A.Δβ.E292. 1和10.阳性对照;2.阴性对照;3~9.CFU-S12克隆 B.N2A. Δβ.E341. 1.阴性对照;2~7.CFU-S12.克隆. 8和9. 阳性对照
图5 CFU-S12中人β-珠蛋白(hβ)和鼠α-珠蛋白(mα)mRNA RNase保护分析
三、人β-珠蛋白基因在小鼠体内长期整合与表达
在14只长期造血重建小鼠中,第22和18号小鼠的骨髓、脾、胸腺和第10号小鼠的骨髓和脾整合有完整的人β-珠蛋白基因(图6A)。整合的人β-珠蛋白基因都携带5′HS2增强子(图6B)。
A.1.N2A.Δβ.E341/Ψ2 DNA;2.人基因组DNA;3.阴性对照,4~12.骨髓,脾和胸腺DNA;B.1.N2A.Δβ.E341/Ψ2 DNA; 2.阴性对照,lane 3~11骨髓、脾和胸腺DNA.
, 百拇医药
图6 长期造血重建小鼠骨髓(B),脾(S)和胸腺 (T) southern blot分析
RT-PCR和RNase保护分析发现,人β-珠蛋白基因在第22号重建小鼠的骨髓和脾中有表达,在第10号和18号重建小鼠中未表达(图7A),表达水平约为鼠内源α-珠蛋白基因的7%(图7B)。
P.阳性对照; N. 阴性对照;B、S、T. 骨髓、脾和胸腺RNA
图7 长期造血重建小鼠中人β-(hβ)和鼠α-珠蛋白(mα) mRNA RT-PCR(A)和RNase保护分析(B)
讨 论
β-地中海贫血基因治疗要求β-珠蛋白基因反转录病毒载体具有较高的病毒滴度,以便有效地感染骨髓造血干细胞。我们采用简单易行的“乒乓”感染方法,发现2个重组体的病毒滴度都有明显提高,未见辅助病毒产生,表明我们获得了具较高病毒滴度的产病毒细胞系。
, 百拇医药
在CFU-S12中检测到转移的人β-珠蛋白基因的整合;小鼠CFU-S12是由脾结节生成细胞增殖分化来的,脾结节生成细胞具有向髓系细胞和淋巴系细胞分化的能力,是多能造血干细胞,表明反转录病毒重组体中的人β-珠蛋白基因能稳定整合到小鼠多能造血干细胞中。
在14只长期造血重建小鼠中,2只小鼠的骨髓、脾和胸腺都稳定整合有完整人β-珠蛋白基因,说明重建骨髓移植受体鼠造血系统的全能造血干细胞不仅已被反转录病毒有效感染,而且转移的人β-珠蛋白基因可稳定整合于小鼠造血干细胞。
β-地中海贫血的基因治疗还要求转移的β-珠蛋白基因获得红系组织特异性高表达。2个重组体的人β-珠蛋白基因在CFU-S12中表达水平都很低,在一只长期造血重建小鼠造血组织中的表达约为内源α-珠蛋白基因的7%;长期重建小鼠造血组织中整合的人β-珠蛋白基因携带有5′HS2增强子,说明人β-珠蛋白基因的低表达水平不是因为重组体中5′HS2缺失。有研究发现,当反转录病毒载体引入新霉素抗性基因后,目的基因在小鼠体内的表达水平显著下降[8],新霉素抗性基因对真核启动子的转录活性有负向影响[9]。本实验所用反转录病毒载体包含新霉素抗性基因,推测它可能是人β-珠蛋白基因在小鼠体内低水平表达的一个原因。
, 百拇医药
整合的人β-珠蛋白基因在重建小鼠骨髓和脾中表达,在胸腺中不表达,表明转移的人β-珠蛋白基因获得了红系组织特异性表达,提示其表达受自身携带的启动子调节。
本课题为国家“八六三”高技术发展计划资助项目(863-BH-03-02-02)
参考文献 1 韦启泽,刘德培,陶吉中,等. 红系增强子的不同片段对转移的β-珠蛋白基因在MEL细胞中表达的作用. 自然科学进展,1997,7:117-121.
2 Wilfred TVG, Norio A, Skinji F, et al. Efficient retrovirus-mediated gene transduction into murine hematopoietic stem cells and long-lasting expression using a transwell coculture system. Blood,1994,84:780-788.
, 百拇医药
3 Eglitis MA, Kantoff P, Gilboa E, et al. Gene expression in mice after high efficiency retroviral-mediated gene transfer, Science, 1985, 230:1395-1398.
4 Barker JE, Mcfarland EC. A method to enrich mouse hematopoietic stem cells. Blood, 1983,62:827-831.
5 Sambrook J, Fritsch EF,Maniatis T. Molecular cloning. 2nd Ed. New York: Cold Spring Harbour Laboratory, 1989, 719-722.
6 Bungert J, Dave U, Lim KC, et al. Synergistic regulation of human β-globin gene switching by locus control region element HS3 and HS4. Gene Dev. 1995, 9:3083-3096.
, 百拇医药
7 Melton DA, Krieg PA, Rebagliati MR, et al. Efficient in vitro synthesis of biologically active RNA and RNA hybridization probes from plasmids containing a bacteriophage SP6 promotor. Nucleic Acid Res, 1984,12:7035-7056.
8 Rivier I, Brose K, Mulligan RC. Effects of retroviral vector design on expression of human adenosine deaminase in murine bone marrow transplant recipients engrafted with genetically modifiedells. Proc Natl Acad Sci. USA,1995, 92:6733-6737.
9 Artelt P, Grannemann R, Stocking C, et al. The prokaryotic neomycin-resistance-encoding gene acts as a transcriptional silencer in eukaryotic cells. Gene,1991, 99:249-254.
(收稿:1998-07-03 修回:1998-11-20), 百拇医药
单位:100005 北京,中国医学科学院基础医学研究所、中国协和医科大学基础医学院医学分子生物学国家重点实验室
关键词:珠蛋白;基因表达;β地中海贫血
中华医学杂志990214 【摘要】 目的 探讨反转录病毒载体介导的携带小片段5′HS2增强子的β-珠蛋白基因在小鼠体内整合与表达状态,对能否应用于临床地中海贫血基因治疗作出初步的评价。方法 用“乒乓”超感染方法筛选具有较高病毒滴度的单向性产病毒细胞系,采用回体(ex vivo)基因转移策略,分析人β-珠蛋白基因在小鼠体内的整合及表达。结果 病毒重组体的病毒滴度在“乒乓”超感染后有明显提高,最高病毒滴度约为1×106CFU/ml;在小鼠CFU-S12(第12天脾结节)中检测到2个重组体中人β-珠蛋白基因的整合,表达水平约为内源性鼠α-珠蛋白基因的0.5%~5%。在2只长期造血重建小鼠的骨髓、脾、胸腺及另一只小鼠的骨髓及脾中整合有人β-珠蛋白基因,在一只重建小鼠的骨髓和脾中有人β-珠蛋白基因表达,约为鼠α-珠蛋白基因的7%。结论 反转录病毒载体介导的人β-珠蛋白基因可稳定整合在小鼠骨髓造血干细胞中,并呈现红系组织特异性表达。
, http://www.100md.com
Retroviral transfer of a human β-globin gene linked to β locus control region hypersensitive site 2 into murine hematopoietic stem cells ZHAI Jinbin, LIU Depei,WANG Jing, et al. National Laboratory of Medical Molecular Biology,Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences, School of Basic Medicine, Peking Union Medical College, Beijing 100005
【Abstract】 Objective To examine the in vivo properties of retroviral recombinants carrying partially deleted human β-globin gene (Δβ) and truncated erythroid enhancer (292 bp and 341 bp of 5′HS2) at the mRNA levels following short- and long-term reconstitution in mice with infected marrow cells.Methods First ecotropic virus producer cell lines with higher virus titers were isolated using “ping-pong” procedures. Then the human β-globin gene was transferred into murine hematopoietic progenitor cells and the integration and expression of transferred gene were analyzed by southern blot and RNase protection assay or RT-PCR. Results The virus titers of both recombinants increased obviously after “ping-pong” procedures. The transferred human β-globin gene was detected in murine CFU-S12 and the expression level was about 0.5%~5% of endogenous mouse α-globin gene. In 3 of 14 mice surviving long-term transplanted with bone marrow cells transduced with high-titer virus, bone marrow, spleen and thymus from two mice and bone marrow and spleen from another mouse contained the intact proviral genome. Long-term expression of the transferred gene was seen in one mouse at level of 7% of endogenous murine α-globin gene.Conclusions The transferred human β-globin gene can stably integrate into murine hematopoietic stem cells mediated by retroviral vectors and express in an erythroid-specific manner.
, 百拇医药
【Key words】 Globin Gene expression Beta-thalassemia
(Natl Med J China, 1999,79:121-124)
β-地中海贫血是人类常见的一种遗传病,发生的原因是β-珠蛋白链合成减少或不能合成,导致α类和β类珠蛋白失衡,使造血系统中的红系细胞功能缺陷。造血干细胞具有重建个体造血系统的全能性和自我更新的能力,理论上将正常β-珠蛋白基因导入造血干细胞并输回体内,使之获得适宜表达,病人将获得终生治疗,此即β-地中海贫血的基因治疗。反转录病毒载体因其基因转移的效率高而被广泛应用于造血干细胞的基因转移。本研究室发现,包含NFE-2/AP-1结合位点的292 bp和341 bp 5′HS2增强子可使部分缺失第二内含子的β-珠蛋白基因在鼠红白血病(MEL)细胞中的表达水平与内源性鼠α-珠蛋白基因可比,而且前病毒整合较稳定,具有较高的病毒滴度[1],因此,我们进一步探讨了在小鼠体内的整合与表达状态。
, 百拇医药
材料与方法
一、材料
1.病毒载体和重组体: N2A、N2A.Δβ.E292和N2A.Δβ.E341(含292 bp或341 bp 5′HS2核心序列和部分缺失第二内含子的β-珠蛋白基因反转录病毒重组体)由本室提供。
2.细胞系:Ψ-2、PA317、NIH3T3由本室提供。
3. 实验小鼠:近交系小鼠C57BL/6购自中国医学科学院实验动物研究所繁殖场。
二、 方法
1.高病毒滴度β-珠蛋白基因产病毒细胞系的建立: 做“乒乓”超感染[2],然后测定其病毒滴度[3]及前病毒的完整性,并检测是否有辅助病毒的产生。
, 百拇医药
2.小鼠骨髓细胞的基因转移和骨髓移植: 取6~8周雄性C57BL/6小鼠,尾静脉注射5-氟脲嘧啶(5-FU)0.15 mg/g体重, 48小时后游离股骨,冲取骨髓, 制备骨髓细胞[4],在含25 U/ml小鼠白细胞介素3和100 U/ml人白细胞介素6的IMDM中培养48小时,然后与产病毒细胞系共同培养24小时,收集小鼠骨髓细胞,移植于经全身致死性照射的受体鼠中。移植后第12天作短期整合表达检测。移植后4~5个月,做长期整合表达检测。
3. 人β-珠蛋白基因在小鼠体内整合与表达检测:(1)Southern blot分析:反转录病毒载体N2A两端LTR上各仅有一个SacI位点,取10 μg样品基因组DNA用SacI酶切,按标准方法做Southern blot分析[5]。(2)RT-PCR[6]:按Promega公司AMV Reverse Transcriptase说明书的实验程序合成cDNA第一链;人β-珠蛋白基因引物为: 5′-ACACAACTGTGTTCA CTAGCAACCTCA-3′和5′-GGTTGCCCATAACAG CATCAGGAGT-3′,鼠α-珠蛋白基因引物为5′-GAT TCTGACAGACTCAGGAAGAAAC-3′和5′-CCTTTC CAGGGCTTCAGCTCCATAT-3′, PCR反应条件:94 ℃变性4分钟; 94 ℃变性1分钟, 58 ℃退火1分钟,72 ℃延伸1分钟, 循环20次; 72 ℃延伸8分钟。取5 μl反应液,8%聚丙烯酰胺凝胶电泳,-70 ℃放射自显影。(3) RNase保护分析[7]:按Promega公司Riboprobe Gemini System合成小鼠α-和人β-珠蛋白RNA探针,取10 μg样品RNA, 10 μg酵母tRNA, hβ RNA探针2×105和mαRNA探针1×105,在18 μl杂交缓冲液(PH 7.4), 1 mmol/L EDTA, 0.1% SDS, 75%甲酰胺)中55 ℃杂交过夜。样品经RNase T1和RNase A消化, 蛋白酶K灭活RNase,乙醇沉淀,溶于10 μl含甲酰胺的上样缓冲液,上样于变性的4%聚丙烯酰胺凝胶,-70 ℃放射自显影。
, 百拇医药
结 果
一、具较高病毒滴度的产病毒细胞系的建立
N2A.Δβ.E292和N2A. Δβ.E341的Ψ2产病毒细胞系病毒滴度经“乒乓”超感染后均有明显提高, 经检测没有辅助病毒的产生(表1、2)。此时重组体N2A.Δβ.E292发生了缺失或部分缺失(图1); N2A. Δβ.E341仍保持了完整的前病毒(图2)。
表1 超感染前重组体N2A.Δβ.E292和N2A.Δβ.E341产病毒细胞系特点 细胞系
病毒滴度(CFU/ml)
前病毒完整性
N2A.Δβ.E292/Ψ2
, 百拇医药 1.7×104
100%
N2A.Δβ.E341/Ψ2
4.7×104
100%
表2 超感染后重组体N2A.Δβ.E292和N2A.Δβ.E341产病毒细胞系特点 产病毒细胞系
病毒滴度(CFU/ml)
病毒完整性

1.5×105
, 百拇医药
6.0×105
9.0×105
2.5×105
1.2×106
-
-
-
-
-

8.0×105
, http://www.100md.com 6.8×105
2.5×105
5.0×104
1.6×106
+
+
+
-
+

1.质粒对照(6.4 kb); 2.人基因组DNA(7.8kb). 3.N2A. Δβ.E292 Ψ2细胞池;4~6.N2A. Δβ.E292 Ψ2细胞克隆:D2, D4,D6. 7.N2A. Δβ.E341 Ψ2细胞池
, 百拇医药
图1 超感染后重组体N2A.Δβ.E292 Ψ2产病毒细胞Southern blot分析

1.人基因组DNA(7.8 kb); 2. 阴性对照;3.“乒乓”超感染后N2A.Δβ.E292Ψ2细胞池;4.N2A.Δβ.E341 Ψ2细胞池;5~7.N2A.Δβ.E341 Ψ2细胞克隆:A3,A6,B4;8.“乒乓”超感染前N2A.Δβ.E341 Ψ2细胞池
图2 超感染后重组体N2A.Δβ.E341 Ψ2产病毒细胞Southern blot分析
二、人β-珠蛋白基因在CFU-S12中整合与表达
对重组体N2A.Δβ.E292,在检测的57个CFU-S12中有31个整合有人β-珠蛋白基因,未发生进一步的缺失重排(图3),对重组体N2A.Δβ.E341,在检测的30个CFU-S12中9个CFU-S12整合有完整的人β-珠蛋白基因(图4)。

, http://www.100md.com
1.质粒对照;3.人基因组DNA(7.8 kb);4.阴性对照.5~15.CFU-S12克隆
图3 包含N2A.Δβ.E292的CFU-S12 Southern blot分析

1.质粒对照;2.人基因组DNA(7.8 kb);3.阴性对照.其余为CFU-S12样品
图4 包含N2A.Δβ.E341的CFU-S12 Southern blot分析
两个重组体中的人β-珠蛋白基因在小鼠CFU-S12中表达水平约为小鼠内源性α的0.5%~5%(图5A,5B)。

, 百拇医药
A.N2A.Δβ.E292. 1和10.阳性对照;2.阴性对照;3~9.CFU-S12克隆 B.N2A. Δβ.E341. 1.阴性对照;2~7.CFU-S12.克隆. 8和9. 阳性对照
图5 CFU-S12中人β-珠蛋白(hβ)和鼠α-珠蛋白(mα)mRNA RNase保护分析
三、人β-珠蛋白基因在小鼠体内长期整合与表达
在14只长期造血重建小鼠中,第22和18号小鼠的骨髓、脾、胸腺和第10号小鼠的骨髓和脾整合有完整的人β-珠蛋白基因(图6A)。整合的人β-珠蛋白基因都携带5′HS2增强子(图6B)。

A.1.N2A.Δβ.E341/Ψ2 DNA;2.人基因组DNA;3.阴性对照,4~12.骨髓,脾和胸腺DNA;B.1.N2A.Δβ.E341/Ψ2 DNA; 2.阴性对照,lane 3~11骨髓、脾和胸腺DNA.
, 百拇医药
图6 长期造血重建小鼠骨髓(B),脾(S)和胸腺 (T) southern blot分析
RT-PCR和RNase保护分析发现,人β-珠蛋白基因在第22号重建小鼠的骨髓和脾中有表达,在第10号和18号重建小鼠中未表达(图7A),表达水平约为鼠内源α-珠蛋白基因的7%(图7B)。

P.阳性对照; N. 阴性对照;B、S、T. 骨髓、脾和胸腺RNA
图7 长期造血重建小鼠中人β-(hβ)和鼠α-珠蛋白(mα) mRNA RT-PCR(A)和RNase保护分析(B)
讨 论
β-地中海贫血基因治疗要求β-珠蛋白基因反转录病毒载体具有较高的病毒滴度,以便有效地感染骨髓造血干细胞。我们采用简单易行的“乒乓”感染方法,发现2个重组体的病毒滴度都有明显提高,未见辅助病毒产生,表明我们获得了具较高病毒滴度的产病毒细胞系。
, 百拇医药
在CFU-S12中检测到转移的人β-珠蛋白基因的整合;小鼠CFU-S12是由脾结节生成细胞增殖分化来的,脾结节生成细胞具有向髓系细胞和淋巴系细胞分化的能力,是多能造血干细胞,表明反转录病毒重组体中的人β-珠蛋白基因能稳定整合到小鼠多能造血干细胞中。
在14只长期造血重建小鼠中,2只小鼠的骨髓、脾和胸腺都稳定整合有完整人β-珠蛋白基因,说明重建骨髓移植受体鼠造血系统的全能造血干细胞不仅已被反转录病毒有效感染,而且转移的人β-珠蛋白基因可稳定整合于小鼠造血干细胞。
β-地中海贫血的基因治疗还要求转移的β-珠蛋白基因获得红系组织特异性高表达。2个重组体的人β-珠蛋白基因在CFU-S12中表达水平都很低,在一只长期造血重建小鼠造血组织中的表达约为内源α-珠蛋白基因的7%;长期重建小鼠造血组织中整合的人β-珠蛋白基因携带有5′HS2增强子,说明人β-珠蛋白基因的低表达水平不是因为重组体中5′HS2缺失。有研究发现,当反转录病毒载体引入新霉素抗性基因后,目的基因在小鼠体内的表达水平显著下降[8],新霉素抗性基因对真核启动子的转录活性有负向影响[9]。本实验所用反转录病毒载体包含新霉素抗性基因,推测它可能是人β-珠蛋白基因在小鼠体内低水平表达的一个原因。
, 百拇医药
整合的人β-珠蛋白基因在重建小鼠骨髓和脾中表达,在胸腺中不表达,表明转移的人β-珠蛋白基因获得了红系组织特异性表达,提示其表达受自身携带的启动子调节。
本课题为国家“八六三”高技术发展计划资助项目(863-BH-03-02-02)
参考文献 1 韦启泽,刘德培,陶吉中,等. 红系增强子的不同片段对转移的β-珠蛋白基因在MEL细胞中表达的作用. 自然科学进展,1997,7:117-121.
2 Wilfred TVG, Norio A, Skinji F, et al. Efficient retrovirus-mediated gene transduction into murine hematopoietic stem cells and long-lasting expression using a transwell coculture system. Blood,1994,84:780-788.
, 百拇医药
3 Eglitis MA, Kantoff P, Gilboa E, et al. Gene expression in mice after high efficiency retroviral-mediated gene transfer, Science, 1985, 230:1395-1398.
4 Barker JE, Mcfarland EC. A method to enrich mouse hematopoietic stem cells. Blood, 1983,62:827-831.
5 Sambrook J, Fritsch EF,Maniatis T. Molecular cloning. 2nd Ed. New York: Cold Spring Harbour Laboratory, 1989, 719-722.
6 Bungert J, Dave U, Lim KC, et al. Synergistic regulation of human β-globin gene switching by locus control region element HS3 and HS4. Gene Dev. 1995, 9:3083-3096.
, 百拇医药
7 Melton DA, Krieg PA, Rebagliati MR, et al. Efficient in vitro synthesis of biologically active RNA and RNA hybridization probes from plasmids containing a bacteriophage SP6 promotor. Nucleic Acid Res, 1984,12:7035-7056.
8 Rivier I, Brose K, Mulligan RC. Effects of retroviral vector design on expression of human adenosine deaminase in murine bone marrow transplant recipients engrafted with genetically modifiedells. Proc Natl Acad Sci. USA,1995, 92:6733-6737.
9 Artelt P, Grannemann R, Stocking C, et al. The prokaryotic neomycin-resistance-encoding gene acts as a transcriptional silencer in eukaryotic cells. Gene,1991, 99:249-254.
(收稿:1998-07-03 修回:1998-11-20), 百拇医药