健康儿童足甲襞微区血流量及与体位的关系
作者:张庆富 翟君鹤 刘 军 周慧敏 赵秀荣 王玉萍
单位:张庆富 翟君鹤 刘 军 063000 唐山,河北省烧伤研究所;周慧敏 赵秀荣 王玉萍 唐山工人医院
关键词:
中国微循环990224
【摘要】 目的 应用我所新建立的循环内皮细胞(Circulating Endothelial Cells,CEC)的分离计数方法计数急性心肌梗塞患者外周血中循环内皮细胞含量的改变并检测其凋亡。方法 Percoll密度梯度离心后,将其先后标记以鼠抗人CD31抗体,FITC-羊抗鼠IgG及碘化丙啶。应用流式细胞仪计数CD31阳性细胞的百分比,并通过检测CEC的DNA倍体含量检测其凋亡状态。结果 急性心肌梗塞组(n= 16)与正常对照组(n= 16)的CEC分别为62.9±24.5/ml及29.9±9.1/ml全血,两者有非常显著性差异(P<0.0001)。两组均为双倍体DNA,无亚二倍体峰的出现,说明无细胞凋亡的发生。结论 此方法克服了以往CEC研究方法的缺点,提高了特异性及回收率,使CEC真正成为来自活体的特异的且直接反映血管损伤的量化指示物。
, http://www.100md.com
Changes in the Level of Circulationg Endothelial Cells in Acute Myocardial Infarction Patients and the Detection of Its Appotosis
Chi Xuan,Li Hongwei,Xiao Linsheng,et al.
Institute of Microcirculation,Peking Union Medical College & Chinese Academy of Medical Sciences,Beijing 100005
【Abstract】 Objective The aim of this study is to count CEC in peripheral blood of acute myocardial infarction (AMI) patients and to detect its apoptotic state,using FACS analysis.Methods The peripheral blood was Percoll density gradient centrifuged and analyzed with flow cytometry,using CD31 monoclonal antibody and propidium iodide.Results CEC counting is 62.9±24.5/ml and 29.9±9.1/ml whole blood in AMI patients (n= 16) and age-matched controls (n= 16) respectively (P<0.0001).There were no signs of apoptosis in both groups.Conclusion There was significant increase in CEC level in AMI patients,indicating that endothelial injury in AMI patients occurred significantly.Our result proved that FACS analysis is efficient in counting and identifying the functional status of CEC in various cardiovascular diseases.
, 百拇医药
【Key words】 Acute myocardial infarction Circulationg endothelial cells Apoptosis
内皮细胞衰老或受损后自基底膜脱落,循环于外周血中,称循环内皮细胞(Circulating Endothelial Cell,CEC)[1]。我们对不同生理病理条件下唯一来源于活体成年血液中的内皮细胞的功能、代谢、生长率等进行研究,因而避免了长期以来体外实验的局限性。自Takahashi于1983年用Von Willebrand因子(vWF-Ag)鉴明“内皮样细胞”确为内皮细胞后[2],即引起心血管研究领域学者们的关注,并在多种病理情况下于患者的外周血中检测到CEC的存在[3~4]。自1983年以来的15年间,CEC的研究方法经不断改进,由光镜下单纯依赖形态学鉴别,进展到目前最常用的Percoll密度梯度离心后以因子VⅢ-R: Ag作为内皮细胞标记物鉴别计数[5]。此方法的缺点是血小板与内皮细胞密度重叠,不易清楚分开,而且血小板与巨核细胞对因子VⅢ-R: Ag的荧光抗体也呈阳性反应,而有些血管内皮细胞对因子VⅢ-R: Ag的荧光抗体染色却呈阴性反应,所以此方法的特异性及回收率均受限制。
, http://www.100md.com
我们建立了一种新的循环内皮细胞的分离技术方法,即Percoll密度梯度离心分离出目的细胞层后,将其先后标记以鼠抗人CD31抗体及FITC-羊抗鼠IgG,应用流式细胞仪计数阳性细胞的百分比,以表达血液内循环内皮细胞的数值。此方法克服了以往方法的缺点,提高了特异性及回收率,且取血量少,仅需3ml外周血,使CEC真正成为来自活体的特异的且直接反映血管损伤的指示物。应用此方法我们计数了急性心肌梗塞患者外周血中循环内皮细胞含量的改变并检测其凋亡。
材料与方法
试剂 3.8%枸橼酸钠(北京,中国);Percoll储存液,密度1.130±0.005g/ml(Sigma,美国);2%台盼蓝(北京,中国);小鼠抗人CD31单克隆抗体(Coulter,美国);FITC-羊抗小鼠IgG(Coulter,美国);小鼠IgG1(阴性对照)(Coulter,美国);牛血清白蛋白(天津血液研究所,中国);RNaseA(Sigma,美国);碘化丙啶(Sigma,美国)。
, 百拇医药
仪器 真空硅化试管(Costar,美国);流式细胞仪检测管(Coulter,美国);流式细胞仪(Coulter,美国);离心机(Renner Gmbh,德国);微量称量天平(Sartorius Research,瑞典)。
实验方法
1 血样采集: 肘正中静脉采血3ml,加入预装有3.8%枸橼酸钠(w/v)0.33ml的硅化试管中。最初采集的2ml血弃去,以避免静脉穿刺时脱落的内皮细胞参入。
2 Percoll密度梯度离心法分离[6~7]: 配制密度分别为1.060g/ml及1.045g/ml的Percoll分层液。100ml 1.060g/ml的Percoll分层液由42.9ml Percoll储存液,10ml集成人血清,37.1ml DMEN及10ml 3.8%枸橼酸钠配成。100ml 1.045g/ml的Percoll分层液由30.3ml Percoll储存液,10ml集成人血清,49.7ml DMEM及10ml 3.8%枸橼酸钠配成。将两种密度的Percoll分层液各3ml轻辅于离心管内。用Hanks液将上述抗凝血稀释1倍,摇匀,清铺于分层液表面,以水平离心机离心,1800rpm×20分钟;离心后目的细胞层悬于两层分层液面之间,呈白膜状,用毛细吸管将目的层细胞吸出,移入另一试管;大量Hanks液清洗离心两次,1500rpm×10分钟;以0.5%台盼蓝检查细胞活力,活细胞比例要求在95%以上。
, 百拇医药
3 抗体标记: 在收获的细胞悬液内加小鼠抗人单克隆抗体CD31 20μl,用PBS-2%BSA 1∶50稀释,室温孵育60分钟。之后用PBS-0.5%BSA清洗、离心两遍,1500rpm×10分钟,弃上清液,将沉淀制成细胞悬液,加FITC-羊抗小鼠IgG 20μl(PBS-2% BSA 1∶50稀释),避光室温孵育30分钟;PBS-0.5%BSA清洗、离心两遍;阴性对照以小鼠IgG1代替一抗。
4 细胞固定: 加0.5mlPBS,将细胞打散,用注射器吸取细胞缓慢注入到5ml 70%冷乙醇中固定一天或更长的时间。
5 RNaseA配制: 用1.12%枸橼酸钠平pH8.2配制RNaseA 5000μg/ml,加温至75℃孵育30分钟以使DNase灭活,再用1.12%枸橼酸钠做1∶10的稀释,终浓度为500μg/ml,分装于1ml安瓿中冻存,每次使用前复溶。
6 碘化丙啶染色[8~9]: PBS洗两次细胞,加1mlPBS于细胞悬液内,加RNaseA至终浓度为50μg/ml,置37℃水浴中消化30分钟,取出立即放入冰浴中,再加DNA染料碘化丙啶至终浓度为5μg/ml,放入冰中于4℃冰箱暗染1小时,用200目尼龙网过滤除去杂质及细胞团块。
, http://www.100md.com
7 流式细胞仪检测:(1) CEC计数及鉴定[10]: 在装备有488nm光线氩离子激光光源的Cοulter EPICS PROFILE II Flow Cytometer上检测。根据前向角光散射的不同,每例标本收集10000个细胞,根据阴性对照设定门,以检测CD31阳性细胞的百分比;(2) CEC DNA倍体检测[11]: 收集CD31阳性细胞门内的细胞,使用488nm光线氩离子激光光源。检测其DNA倍体含量。应用EPICS ELLTE Flow Cytometer Workstation program version 3.0,分析凋亡细胞的比例。凋亡细胞被定义为亚二倍体细胞,其DNA含量应至少为二倍体细胞的5%,小于5%的部分被认为是碎片。
8 统计学方法及制图: 应用Graphpad Instat Verson 1.14统计软件分别计算均数及标准差,CEC绝对值以均数±标准差表示。进行组间t检验,P<0.05认为差别有显著性意义。应用MicroCal Origin 3.0软件制图。
, http://www.100md.com
本实验中我们首先应用Percoll密度梯度离心法分离细胞,其密度为1.045~1.060g/ml,循环内皮细胞即包含于此层中,除此以外还包括部分单核细胞及血小板。随后应用流式细胞仪检测CEC。识别内皮细胞的标志是小鼠抗人单克隆抗CD31,血小板内皮细胞粘附因子(PECAM-1)。CD31是细胞外粘附分子,属于免疫球蛋白基因超家族,是130Kda的整合性膜糖蛋白,由6个Ig样C2同源亚单位组成。已证明CD31在所有类型的内皮细胞表面结构性,均一性地表达[12~13]。
经流式细胞仪计数时,首先根据前向角光散射收集细胞,前向角光散射的强度与细胞大小有关,由于血小板直径小于内皮细胞,其前向角光散射较小,因此在散点图中与细胞碎片一起位于内皮细胞群的下方,易于分开(图1)。由于去除了血小板的影响,因此提高了此方法的特异性。在散点图中设定门,收集细胞10000个。再在荧光直方图中分析收集细胞中CD31阳性细胞的百分比(图2)。
, http://www.100md.com
图1 散点图
在本图中首先根据前向光散射角(forward light scatter)将包含CEC的目的细胞群与血小板及细胞碎片分开,所选定区域内的细胞即为目的细胞群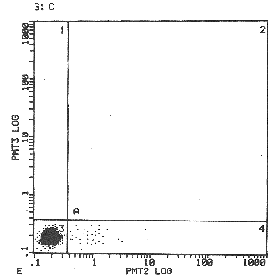
图2 荧光直方图
在本图中根据阴性对照设定门,以检测CD31阳性细胞的百分比
实验结果
图3示AMI组(n=16)与正常对照组(n=16)CEC值的差异。两者分别为62.9±24.5/ml及29.9±9.1/ml外周血,两者间有非常显著性差异(P<0.0001)。AMI组及对照组其CEC的DNA含量均为二倍体,未见亚二倍体峰(hypodiploid peak),见图4。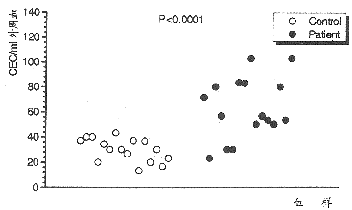
, http://www.100md.com
图3 心肌梗塞患者与健康人血中CE的含量
心梗组(n=16)与正常对照组(n=16)的CEC分别为62.9±24.5/ml外周血及29.9±9.1/ml外周血,两者有显著性差异(P<0.0001)
图4 CEC的DNA倍体检测
AMI组及对照组CEC的DNA含量均为二倍体,未见亚二倍体峰
讨 论
在本试验中,我们应用流式细胞仪法计数循环内皮细胞。识别内皮细胞的标志是内皮细胞特异性单克隆抗体-鼠抗人CD31(PECAM-1)。在以前的CEC检测中,多用抗VⅢ因子抗体标记细胞,荧光显微镜下计数。此方法最早由Takahashi于1983年报道,至今仍是我国学者研究CEC的主要方法[14~17],此方法存在以下3个问题: (1) VⅢ因子抗原除在内皮细胞表面表达外,还存在于巨核细胞与血小板表面;(2) 血小板与内皮细胞的密度重叠,以往的分离检测方法不能将两者区分开来。即使加入ADP使血小板聚集而离心,仍不能将血小板完全去除,而且此方法需反复清洗离心,易损伤或损失内皮细胞;(3) 光学显微镜下计数血细胞计数池中的CEC或荧光显微镜下计数荧光细胞为主要的CEC计数方法。前者主要通过形态学辨认CEC,主观性强,不同计数者计数结果差别大;后者计数的荧光细胞并非全部是内皮细胞。以上三点可以解释为什么应用同样的分离方法及抗体(抗VⅢ因子抗体),Takahashi及Hanker等人(1983)在正常人外周血中未检测到CEC的存在,而Davis等人(1985)却得出正常人外周血中的CEC浓度为1~4个/μl的结论。Rosella Sbarbati等人重复了Haladovec等人的实验,却不能将EC从外周血中分离出来。
, http://www.100md.com
在本实验中我们应用流式细胞仪法检测CEC,可以通过前向及侧向散射角先将单个核细胞群与血小板分开,从而提高了此方法的特异性。在检测荧光细胞占单个核细胞的百分比之前,计数了单个细胞的总数,可以计算每ml外周血中CEC的绝对值,这较单独检测荧光细胞的百分比更客观地反映血管内皮细胞的受损程度。
流式细胞仪法计数CEC具有客观、省时、精确的优点,且取血量少(3ml),使CEC值真正成为一项能反映活体血管内皮损伤程度的无创性临床指标。流式细胞仪在国外应用已相当普遍,在国内的一些大型医院及研究所也已开始使用,并积累一定经验,因此将其应用于CEC计数是切实可行的。
有日本学者报道[18]从动脉粥样硬化患者的外周血中分离出具有活力的CEC,并在体外培育成功。应用流式细胞仪法也可将CEC从单个核细胞中分选出来,并将纯的CEC进一步培养,如若成功,将使我们有机会对来源于活的个体的成年内皮细胞的代谢、生长、死亡等进行系统研究。Schweitzer等人报道[19]从骨髓提取物中应用流式细胞仪法分选出内皮细胞,并培养成功,说明了此方法的可行性。
, 百拇医药
当然,此方法仍有不足之处,主要是抗体的特异性还不够强。国外学者已报道数种内皮细胞特异性的单克隆抗体,如CLB-HEC19,S-Endol[20]等,并已成功应用于流式细胞仪法分选CEC。还可通过双抗体标记法提高检出细胞的特异性。制备内皮细胞特异性单克隆抗体是我们目前正进行的工作。
参考文献
1 杨映波,王正国.循环内皮细胞研究进展.生理科学进展.1993,24(1):70
2 Takahashi H,Harker LA.Measurement of human endothelial cells in whole blood.Throms.Res.1983,31(4):1
3 Hladovec J,Perowsky L.Endothelial lesion in hypertension.Cor.Vasa 1989,31:51
, 百拇医药
4 Hladovec J,Prerowsky I,Stanek V,et al.Circulating endothelial cells in acute myocardial infarction and angina pectoris.Klin.Wochenschr.1978,56:1033
5 郑豪义,戴玉华.内皮细胞的损伤与急性心肌梗塞.中华心血管病杂志.1997,25(4):36
6 杨景山主编.细胞生物化学与细胞生物技术.北京: 北京医科大学中国协和医科大学联合出版社.1990,7~8
7 Rosella S,Martin B,Marzilli M.Immunologic detection of endothelial cells in human whole blood.Blood.1991,77:764
, http://www.100md.com
8 Walsh GM,Dewson G,Wardlaw AJ,et al.A comparative study of different methods for the assessment of apoptosis and necrosis in human eosinophils.J Immunol Methods.1998,217:153
9 Obrien MC,Healy SF Jr,Raney SR,et al.Discrimination of late apoptotic/necrotic cells by flow cytometry in solid tumors.Cytometry.1997,28(1):81
10 Geroge F,Brisson C,Poncelet P,et al.Rapid isolation of human endothelial cells from whole blood using S-Endo 1 monoclonal antibody coupled to immuno-magnetic beads: demonstration of endothelial injury after angioplasty.Thrombosis and Haemostasis.1992,67:147
, 百拇医药
11 Endresen PC,Prytz PS,Aarbakke J.A new cytometric method for discrimination of apoptotic cells and detection of their cell cycle specificity through staining of F-action and DNA.Cytometry.1995,20(2):162
12 Scholz D,Schaper J.Platelet/endothelial cell adhesion molecule-1(PECAM-1) is localized over the entire plasma membrane of endothelial cells.Cell Tissue Res.1997,290:623
13 Richard L,Velasco P,Detmar M.A simple immunomagnetic protocol for the selective isolation and long-term culture of human dermal microvascular endothelial cells.Exp Cell Res.1998,240(1):1
, 百拇医药
14 祝之明,杨映波.高血压病患者血液中血管内皮细胞的变化及其临床意义.中华心血管病杂志.1991,19:217
15 杨映波,王正国,朱佩芳.血循环中内皮细胞数量变化意义的初探.第三军医大学学报.1990,12:209
16 杨映波.王正国,朱佩芳,等.化学和机械损伤对大鼠血管内皮细胞的影响.中国病理生理杂志.1993,9(7):27
17 杨映波,王正国.循环内皮细胞来源的实验研究.第三军医大学学报.1992,14:251
18 Samaden A,Piovella F,Almasio P,et al.Isolation and growth of human endothelial cells from peripheral blood by PVP-Silica density gradients.Boll Soc It Biol Sper.1985,61:957
, 百拇医药
19 Schweitzer CM,Schoot CE,Drager AM,et al.Isolation and culture of human bone marrow endothelial cells.Experimental Hematology.1995,23:41
20 Bardin N,George F,Mutin M,et al.S-Endol,a pan-endothelial monoclonal antibody recognizing a novel human endothelial antigen.Eur J Haematol.1998,60:153
收稿: 1999-04-20, http://www.100md.com
单位:张庆富 翟君鹤 刘 军 063000 唐山,河北省烧伤研究所;周慧敏 赵秀荣 王玉萍 唐山工人医院
关键词:
中国微循环990224
【摘要】 目的 应用我所新建立的循环内皮细胞(Circulating Endothelial Cells,CEC)的分离计数方法计数急性心肌梗塞患者外周血中循环内皮细胞含量的改变并检测其凋亡。方法 Percoll密度梯度离心后,将其先后标记以鼠抗人CD31抗体,FITC-羊抗鼠IgG及碘化丙啶。应用流式细胞仪计数CD31阳性细胞的百分比,并通过检测CEC的DNA倍体含量检测其凋亡状态。结果 急性心肌梗塞组(n= 16)与正常对照组(n= 16)的CEC分别为62.9±24.5/ml及29.9±9.1/ml全血,两者有非常显著性差异(P<0.0001)。两组均为双倍体DNA,无亚二倍体峰的出现,说明无细胞凋亡的发生。结论 此方法克服了以往CEC研究方法的缺点,提高了特异性及回收率,使CEC真正成为来自活体的特异的且直接反映血管损伤的量化指示物。
, http://www.100md.com
Changes in the Level of Circulationg Endothelial Cells in Acute Myocardial Infarction Patients and the Detection of Its Appotosis
Chi Xuan,Li Hongwei,Xiao Linsheng,et al.
Institute of Microcirculation,Peking Union Medical College & Chinese Academy of Medical Sciences,Beijing 100005
【Abstract】 Objective The aim of this study is to count CEC in peripheral blood of acute myocardial infarction (AMI) patients and to detect its apoptotic state,using FACS analysis.Methods The peripheral blood was Percoll density gradient centrifuged and analyzed with flow cytometry,using CD31 monoclonal antibody and propidium iodide.Results CEC counting is 62.9±24.5/ml and 29.9±9.1/ml whole blood in AMI patients (n= 16) and age-matched controls (n= 16) respectively (P<0.0001).There were no signs of apoptosis in both groups.Conclusion There was significant increase in CEC level in AMI patients,indicating that endothelial injury in AMI patients occurred significantly.Our result proved that FACS analysis is efficient in counting and identifying the functional status of CEC in various cardiovascular diseases.
, 百拇医药
【Key words】 Acute myocardial infarction Circulationg endothelial cells Apoptosis
内皮细胞衰老或受损后自基底膜脱落,循环于外周血中,称循环内皮细胞(Circulating Endothelial Cell,CEC)[1]。我们对不同生理病理条件下唯一来源于活体成年血液中的内皮细胞的功能、代谢、生长率等进行研究,因而避免了长期以来体外实验的局限性。自Takahashi于1983年用Von Willebrand因子(vWF-Ag)鉴明“内皮样细胞”确为内皮细胞后[2],即引起心血管研究领域学者们的关注,并在多种病理情况下于患者的外周血中检测到CEC的存在[3~4]。自1983年以来的15年间,CEC的研究方法经不断改进,由光镜下单纯依赖形态学鉴别,进展到目前最常用的Percoll密度梯度离心后以因子VⅢ-R: Ag作为内皮细胞标记物鉴别计数[5]。此方法的缺点是血小板与内皮细胞密度重叠,不易清楚分开,而且血小板与巨核细胞对因子VⅢ-R: Ag的荧光抗体也呈阳性反应,而有些血管内皮细胞对因子VⅢ-R: Ag的荧光抗体染色却呈阴性反应,所以此方法的特异性及回收率均受限制。
, http://www.100md.com
我们建立了一种新的循环内皮细胞的分离技术方法,即Percoll密度梯度离心分离出目的细胞层后,将其先后标记以鼠抗人CD31抗体及FITC-羊抗鼠IgG,应用流式细胞仪计数阳性细胞的百分比,以表达血液内循环内皮细胞的数值。此方法克服了以往方法的缺点,提高了特异性及回收率,且取血量少,仅需3ml外周血,使CEC真正成为来自活体的特异的且直接反映血管损伤的指示物。应用此方法我们计数了急性心肌梗塞患者外周血中循环内皮细胞含量的改变并检测其凋亡。
材料与方法
试剂 3.8%枸橼酸钠(北京,中国);Percoll储存液,密度1.130±0.005g/ml(Sigma,美国);2%台盼蓝(北京,中国);小鼠抗人CD31单克隆抗体(Coulter,美国);FITC-羊抗小鼠IgG(Coulter,美国);小鼠IgG1(阴性对照)(Coulter,美国);牛血清白蛋白(天津血液研究所,中国);RNaseA(Sigma,美国);碘化丙啶(Sigma,美国)。
, 百拇医药
仪器 真空硅化试管(Costar,美国);流式细胞仪检测管(Coulter,美国);流式细胞仪(Coulter,美国);离心机(Renner Gmbh,德国);微量称量天平(Sartorius Research,瑞典)。
实验方法
1 血样采集: 肘正中静脉采血3ml,加入预装有3.8%枸橼酸钠(w/v)0.33ml的硅化试管中。最初采集的2ml血弃去,以避免静脉穿刺时脱落的内皮细胞参入。
2 Percoll密度梯度离心法分离[6~7]: 配制密度分别为1.060g/ml及1.045g/ml的Percoll分层液。100ml 1.060g/ml的Percoll分层液由42.9ml Percoll储存液,10ml集成人血清,37.1ml DMEN及10ml 3.8%枸橼酸钠配成。100ml 1.045g/ml的Percoll分层液由30.3ml Percoll储存液,10ml集成人血清,49.7ml DMEM及10ml 3.8%枸橼酸钠配成。将两种密度的Percoll分层液各3ml轻辅于离心管内。用Hanks液将上述抗凝血稀释1倍,摇匀,清铺于分层液表面,以水平离心机离心,1800rpm×20分钟;离心后目的细胞层悬于两层分层液面之间,呈白膜状,用毛细吸管将目的层细胞吸出,移入另一试管;大量Hanks液清洗离心两次,1500rpm×10分钟;以0.5%台盼蓝检查细胞活力,活细胞比例要求在95%以上。
, 百拇医药
3 抗体标记: 在收获的细胞悬液内加小鼠抗人单克隆抗体CD31 20μl,用PBS-2%BSA 1∶50稀释,室温孵育60分钟。之后用PBS-0.5%BSA清洗、离心两遍,1500rpm×10分钟,弃上清液,将沉淀制成细胞悬液,加FITC-羊抗小鼠IgG 20μl(PBS-2% BSA 1∶50稀释),避光室温孵育30分钟;PBS-0.5%BSA清洗、离心两遍;阴性对照以小鼠IgG1代替一抗。
4 细胞固定: 加0.5mlPBS,将细胞打散,用注射器吸取细胞缓慢注入到5ml 70%冷乙醇中固定一天或更长的时间。
5 RNaseA配制: 用1.12%枸橼酸钠平pH8.2配制RNaseA 5000μg/ml,加温至75℃孵育30分钟以使DNase灭活,再用1.12%枸橼酸钠做1∶10的稀释,终浓度为500μg/ml,分装于1ml安瓿中冻存,每次使用前复溶。
6 碘化丙啶染色[8~9]: PBS洗两次细胞,加1mlPBS于细胞悬液内,加RNaseA至终浓度为50μg/ml,置37℃水浴中消化30分钟,取出立即放入冰浴中,再加DNA染料碘化丙啶至终浓度为5μg/ml,放入冰中于4℃冰箱暗染1小时,用200目尼龙网过滤除去杂质及细胞团块。
, http://www.100md.com
7 流式细胞仪检测:(1) CEC计数及鉴定[10]: 在装备有488nm光线氩离子激光光源的Cοulter EPICS PROFILE II Flow Cytometer上检测。根据前向角光散射的不同,每例标本收集10000个细胞,根据阴性对照设定门,以检测CD31阳性细胞的百分比;(2) CEC DNA倍体检测[11]: 收集CD31阳性细胞门内的细胞,使用488nm光线氩离子激光光源。检测其DNA倍体含量。应用EPICS ELLTE Flow Cytometer Workstation program version 3.0,分析凋亡细胞的比例。凋亡细胞被定义为亚二倍体细胞,其DNA含量应至少为二倍体细胞的5%,小于5%的部分被认为是碎片。
8 统计学方法及制图: 应用Graphpad Instat Verson 1.14统计软件分别计算均数及标准差,CEC绝对值以均数±标准差表示。进行组间t检验,P<0.05认为差别有显著性意义。应用MicroCal Origin 3.0软件制图。
, http://www.100md.com
本实验中我们首先应用Percoll密度梯度离心法分离细胞,其密度为1.045~1.060g/ml,循环内皮细胞即包含于此层中,除此以外还包括部分单核细胞及血小板。随后应用流式细胞仪检测CEC。识别内皮细胞的标志是小鼠抗人单克隆抗CD31,血小板内皮细胞粘附因子(PECAM-1)。CD31是细胞外粘附分子,属于免疫球蛋白基因超家族,是130Kda的整合性膜糖蛋白,由6个Ig样C2同源亚单位组成。已证明CD31在所有类型的内皮细胞表面结构性,均一性地表达[12~13]。
经流式细胞仪计数时,首先根据前向角光散射收集细胞,前向角光散射的强度与细胞大小有关,由于血小板直径小于内皮细胞,其前向角光散射较小,因此在散点图中与细胞碎片一起位于内皮细胞群的下方,易于分开(图1)。由于去除了血小板的影响,因此提高了此方法的特异性。在散点图中设定门,收集细胞10000个。再在荧光直方图中分析收集细胞中CD31阳性细胞的百分比(图2)。

, http://www.100md.com
图1 散点图
在本图中首先根据前向光散射角(forward light scatter)将包含CEC的目的细胞群与血小板及细胞碎片分开,所选定区域内的细胞即为目的细胞群

图2 荧光直方图
在本图中根据阴性对照设定门,以检测CD31阳性细胞的百分比
实验结果
图3示AMI组(n=16)与正常对照组(n=16)CEC值的差异。两者分别为62.9±24.5/ml及29.9±9.1/ml外周血,两者间有非常显著性差异(P<0.0001)。AMI组及对照组其CEC的DNA含量均为二倍体,未见亚二倍体峰(hypodiploid peak),见图4。

, http://www.100md.com
图3 心肌梗塞患者与健康人血中CE的含量
心梗组(n=16)与正常对照组(n=16)的CEC分别为62.9±24.5/ml外周血及29.9±9.1/ml外周血,两者有显著性差异(P<0.0001)

图4 CEC的DNA倍体检测
AMI组及对照组CEC的DNA含量均为二倍体,未见亚二倍体峰
讨 论
在本试验中,我们应用流式细胞仪法计数循环内皮细胞。识别内皮细胞的标志是内皮细胞特异性单克隆抗体-鼠抗人CD31(PECAM-1)。在以前的CEC检测中,多用抗VⅢ因子抗体标记细胞,荧光显微镜下计数。此方法最早由Takahashi于1983年报道,至今仍是我国学者研究CEC的主要方法[14~17],此方法存在以下3个问题: (1) VⅢ因子抗原除在内皮细胞表面表达外,还存在于巨核细胞与血小板表面;(2) 血小板与内皮细胞的密度重叠,以往的分离检测方法不能将两者区分开来。即使加入ADP使血小板聚集而离心,仍不能将血小板完全去除,而且此方法需反复清洗离心,易损伤或损失内皮细胞;(3) 光学显微镜下计数血细胞计数池中的CEC或荧光显微镜下计数荧光细胞为主要的CEC计数方法。前者主要通过形态学辨认CEC,主观性强,不同计数者计数结果差别大;后者计数的荧光细胞并非全部是内皮细胞。以上三点可以解释为什么应用同样的分离方法及抗体(抗VⅢ因子抗体),Takahashi及Hanker等人(1983)在正常人外周血中未检测到CEC的存在,而Davis等人(1985)却得出正常人外周血中的CEC浓度为1~4个/μl的结论。Rosella Sbarbati等人重复了Haladovec等人的实验,却不能将EC从外周血中分离出来。
, http://www.100md.com
在本实验中我们应用流式细胞仪法检测CEC,可以通过前向及侧向散射角先将单个核细胞群与血小板分开,从而提高了此方法的特异性。在检测荧光细胞占单个核细胞的百分比之前,计数了单个细胞的总数,可以计算每ml外周血中CEC的绝对值,这较单独检测荧光细胞的百分比更客观地反映血管内皮细胞的受损程度。
流式细胞仪法计数CEC具有客观、省时、精确的优点,且取血量少(3ml),使CEC值真正成为一项能反映活体血管内皮损伤程度的无创性临床指标。流式细胞仪在国外应用已相当普遍,在国内的一些大型医院及研究所也已开始使用,并积累一定经验,因此将其应用于CEC计数是切实可行的。
有日本学者报道[18]从动脉粥样硬化患者的外周血中分离出具有活力的CEC,并在体外培育成功。应用流式细胞仪法也可将CEC从单个核细胞中分选出来,并将纯的CEC进一步培养,如若成功,将使我们有机会对来源于活的个体的成年内皮细胞的代谢、生长、死亡等进行系统研究。Schweitzer等人报道[19]从骨髓提取物中应用流式细胞仪法分选出内皮细胞,并培养成功,说明了此方法的可行性。
, 百拇医药
当然,此方法仍有不足之处,主要是抗体的特异性还不够强。国外学者已报道数种内皮细胞特异性的单克隆抗体,如CLB-HEC19,S-Endol[20]等,并已成功应用于流式细胞仪法分选CEC。还可通过双抗体标记法提高检出细胞的特异性。制备内皮细胞特异性单克隆抗体是我们目前正进行的工作。
参考文献
1 杨映波,王正国.循环内皮细胞研究进展.生理科学进展.1993,24(1):70
2 Takahashi H,Harker LA.Measurement of human endothelial cells in whole blood.Throms.Res.1983,31(4):1
3 Hladovec J,Perowsky L.Endothelial lesion in hypertension.Cor.Vasa 1989,31:51
, 百拇医药
4 Hladovec J,Prerowsky I,Stanek V,et al.Circulating endothelial cells in acute myocardial infarction and angina pectoris.Klin.Wochenschr.1978,56:1033
5 郑豪义,戴玉华.内皮细胞的损伤与急性心肌梗塞.中华心血管病杂志.1997,25(4):36
6 杨景山主编.细胞生物化学与细胞生物技术.北京: 北京医科大学中国协和医科大学联合出版社.1990,7~8
7 Rosella S,Martin B,Marzilli M.Immunologic detection of endothelial cells in human whole blood.Blood.1991,77:764
, http://www.100md.com
8 Walsh GM,Dewson G,Wardlaw AJ,et al.A comparative study of different methods for the assessment of apoptosis and necrosis in human eosinophils.J Immunol Methods.1998,217:153
9 Obrien MC,Healy SF Jr,Raney SR,et al.Discrimination of late apoptotic/necrotic cells by flow cytometry in solid tumors.Cytometry.1997,28(1):81
10 Geroge F,Brisson C,Poncelet P,et al.Rapid isolation of human endothelial cells from whole blood using S-Endo 1 monoclonal antibody coupled to immuno-magnetic beads: demonstration of endothelial injury after angioplasty.Thrombosis and Haemostasis.1992,67:147
, 百拇医药
11 Endresen PC,Prytz PS,Aarbakke J.A new cytometric method for discrimination of apoptotic cells and detection of their cell cycle specificity through staining of F-action and DNA.Cytometry.1995,20(2):162
12 Scholz D,Schaper J.Platelet/endothelial cell adhesion molecule-1(PECAM-1) is localized over the entire plasma membrane of endothelial cells.Cell Tissue Res.1997,290:623
13 Richard L,Velasco P,Detmar M.A simple immunomagnetic protocol for the selective isolation and long-term culture of human dermal microvascular endothelial cells.Exp Cell Res.1998,240(1):1
, 百拇医药
14 祝之明,杨映波.高血压病患者血液中血管内皮细胞的变化及其临床意义.中华心血管病杂志.1991,19:217
15 杨映波,王正国,朱佩芳.血循环中内皮细胞数量变化意义的初探.第三军医大学学报.1990,12:209
16 杨映波.王正国,朱佩芳,等.化学和机械损伤对大鼠血管内皮细胞的影响.中国病理生理杂志.1993,9(7):27
17 杨映波,王正国.循环内皮细胞来源的实验研究.第三军医大学学报.1992,14:251
18 Samaden A,Piovella F,Almasio P,et al.Isolation and growth of human endothelial cells from peripheral blood by PVP-Silica density gradients.Boll Soc It Biol Sper.1985,61:957
, 百拇医药
19 Schweitzer CM,Schoot CE,Drager AM,et al.Isolation and culture of human bone marrow endothelial cells.Experimental Hematology.1995,23:41
20 Bardin N,George F,Mutin M,et al.S-Endol,a pan-endothelial monoclonal antibody recognizing a novel human endothelial antigen.Eur J Haematol.1998,60:153
收稿: 1999-04-20, http://www.100md.com