应用Frua-2测定人腹腔巨噬细胞胞浆游离钙浓度*
作者:刘义 罗丽兰 赵海波 胡清华 刘晨红
单位:刘义 罗丽兰 赵海波 同济医科大学附属同济医院妇产科,武汉 430030;胡清华 刘晨红 同济医科大学基础医学院病理生理学教研室,武汉 430030
关键词:巨噬细胞;胞浆游离钙;子宫内膜异位症;Frua-2
同济医科大学学报990216 摘要 为了解子宫内膜异位症患者腹腔巨噬细胞活性变化,建立了应用Frua-2测定人腹腔巨噬细胞胞浆游离钙浓度([Ca2+]i)的方法。结果显示,正常盆腔患者腹腔巨噬细胞[Ca2+]i为(100.32±5.69) nmol/L,而子宫内膜异位症患者腹腔巨噬细胞较正常盆腔者显著升高。表明子宫内膜异位症患者腹腔巨噬细胞活性增强与其[Ca2+]i增高有关。
中图法分类号 R329.2, Q582
, http://www.100md.com
Determination of Cytosolic Free Calcium Concentration in Peritoneal
Macrophage by Frua-2
Liu Yi, Luo Lilan, Zhao Haibo et al
Department of Obstetrics and Gynecology, Tongji Hospital, Tongji Medical University, Wuhan 430030
Abstract In order to study the alteration of activity of peritoneal macrophages in endometriosis, the method for cytosolic free calcium levels ([Ca2+]i) in human peritoneal macrophages by Frua-2 was developed. The results showed that the cytosolic ([Ca2+]i) in the peritoneal macrophages in patients with normal pelvis were (100.32±5.69) nmol/L, which was significantly lower than in the patients with endometriosis. It is suggested that the elevated cytosolic ([Ca2+]i) in peritoneal macrophages may contribute to the alteration of peritoneal macrophage activity in patients with endometriosis.
, 百拇医药
Key words macrophage; cytosolic free calcium ([Ca2+]i); endometriosis; Frua-2
作为第二信使系统的巨噬细胞内胞浆游离钙,其浓度的变化往往代表着细胞功能的启动、加强或抑制[1]。为了解子宫内膜异位症患者腹腔巨噬细胞活性变化,我们建立了应用Frua-2测定人单层贴壁腹腔巨噬细胞胞浆游离钙浓度([Ca2+]i)的方法。
1 材料与方法
1.1 原理
Frua-2/AM在适宜条件下载入细胞,随后被胞浆的非特异性脂酶水解成Frua-2,后者与胞浆的游离钙结合后即可被特定波长的紫外光激发产生荧光,其发射光强度与[Ca2+]i之间存在在一定函数关系,据此可测定[Ca2+]i[2]。
, 百拇医药
1.2 主要仪器和试剂
F-2000型双波长荧光分光光度计(HITACHI 850), Frua-2/AM (Sigma),RPMI 1640 (GIBCO),小牛血清(天津血液病研究所),淋巴细胞分离液(上海试剂二厂),L-谷胺酰氨(E. Merck), EGTA(Sigma), Triton (Sigma), DTPA (Sigma)。
1.3 步骤
1.3.1巨噬细胞的分离、培养和鉴定:在腹腔镜直视下通过吸管抽取子宫直肠凹和子宫膀胱陷凹腹腔液,立即置于肝素化无菌试管中。将腹腔液按1∶1比例小心加在淋巴细胞分离液的液面上,注意勿与分离液混合。然后用水平离心机2 000 r/min离心20 min,小心吸取中间富含淋巴细胞的灰白色层(其中90 %以上为巨噬细胞)。用Hanks液洗涤2~3次,调整细胞浓度,最后用含200 mg/L小牛血清的RPMI 1640培养液配制成密度3×106/ml的细胞悬液。滴在25 mm×12 mm的小玻片上,置50 ml/L CO2、37 ℃培养箱孵育1 h,使巨噬细胞贴壁,用Hanks液洗去未粘附的细胞。重新置于细胞培养液中。倒置显微镜下观察贴壁的巨噬细胞呈均匀单层融合状态。同时用台盼蓝拒染试验检测巨噬细胞成活率,要求活细胞数大于90 %。
, 百拇医药
1.3.2 Fura-2/AM负载:将上述贴壁细胞的玻片在37 ℃ PSS溶液中冲洗2次;将细胞放入含2.5 μmol/L Fura-2/AM PSS溶液中,于37 ℃静置孵育45 min;细胞经Fura-2/AM孵育后,用37 ℃ PSS溶液中冲洗两次;将玻片沿对角线垂直插入比色皿中,比色皿内已预先加入37 ℃ PSS溶液。
1.3.3 巨噬细胞[Ca2+]i测定:应用F-2000型双波长荧光分光光度计于37 ℃恒温测定荧光强度。比色皿上机时须使玻片上生长细胞的一面以45 °角面对激光光源,连续测定340、380 nm波长激发光交替激发时,510 nm发射新的荧光强度F,同时记录荧光强度比值R(R=F340/F380)。有关参数:激发光栅5 nm,发射光栅10 nm,发射速度100 nm/min,响应时间2 s,激发光扫描范围320~420 nm,发射光扫描范围440~540 nm。校正参数:Rmax为Fura-2饱和时产生的最大荧光比值,以1 mg/L Triton测得;Rmin为Fura-2游离时形成的最小荧光比值,以4 mmol/L EGTA测得;自身荧光以未孵育Fura-2/AM的细胞依同法测量,计算[Ca2+]i时减去。
, 百拇医药
1.3.4 细胞胞浆游离钙浓度[Ca2+]i计算:[Ca2+]i依下式计算:[Ca2+]i=Kd.(R-Rmin)/(Rmax-R).Ff2/Fb2。其中平衡常数Kd在37 ℃时为224 nmol/L;R为340、380 nm荧光强度的比值(R=F340/F380)。校正参数Rmax、Rmin分别为Ca2+饱和与Ca2+游离时形成的最大、最小荧光比值,Ff2与Fb2分别为Ca2+游离与Ca2+饱时380 nm荧光强度。
2 结果与讨论
Frua-2作为Ca2+荧光探针,具有荧光强度高,Ca2+选择性强,自身荧光弱,双激发光波长等优点。本文应用上述方法测出正常盆腔不孕患者腹腔巨噬细胞[Ca2+]i为(100.32±5.69) nmol/L (n=8),与文献报道的静息状态下巨噬细胞内[Ca2+]i基本一致[2]。而子宫内膜异位症患者腹腔巨噬细胞内[Ca2+]i为(620.52±57.17) nmol/L (n=10),较正常盆腔患者显著升高(P<0.01),见图1,2。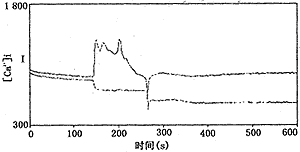
, 百拇医药
图1 对照组腹腔巨噬细胞[Ca2+]i测定,静息水平时R(F340/F380)=1.165,待稳定后,加入Triton,F340上升,而F380下降,得到Rmax;继而加入EGTA,则使F340迅速下降
而F380上升,得到Rmin;依据公式计算[Ca2+]i=114.71 nmol/L
图2 子宫内膜异位症腹腔巨噬细胞[Ca2+]i测定,静息水平时R(F340/F380)=2.073,待稳定后,加入Triton,F340上升,而F380下降,得到Rmax;继而加入EGTA,则使F340
迅速下降而F380上升,得到Rmin;依据公式计算[Ca2+]i=856 nmol/L
, 百拇医药
目前国内一单位相继建立了应用Frua-2测定细胞[Ca2+]i的方法[3,4]。但多是将细胞制备成悬液状态。这种方法从细胞悬液的制备,荧光探针的孵育和清洗,直到上机测试需反复离心,并最后调整细胞密度,操作过程复杂,同时容易造成细胞损伤。采用双波长荧光显微成像技术测定单个细胞[Ca2+],需双波长显微荧光分光设备,由于价格昂贵,国内尚难普遍开展。本方法的特点在于操作过程简单、实用,避免了反复离心对细胞的损伤。由于所需细胞数量较少,便于临床观察各种状态下巨噬细胞[Ca2+]i的变化,同时还可观察药物对细胞[Ca2+]i的影响。此外,采用双波长荧光分光光度计可发挥Frua-2双激发波长的优点,它同时可测出340和380 nm两个波长激发的荧光强度。因而测定结果更准确可靠。实验中我们注意到了以下几个因素的影响。
①细胞制备:贴壁细胞呈单层融合状态是测试成功的关键因素之一。由于巨噬细胞为终末细胞,加之临床取材限制,为了满足上述要求,我们将细胞悬液浓度调整为3×106/ml,然后滴在12 mm×25 mm玻片上,每片约需0.4~0.5 ml,置于50 ml/L CO2、37 ℃培养箱孵育1 h使细胞呈均匀单层贴壁状态可满足要求。② 纯水:普通蒸馏水因其所含重金属离子可致荧光猝严灭,故不适于此实验。我们选用离子交换纯水器过柱后的四蒸水,并以40 μm DTPA鳌合金属离子,基本满足要求。③温度:测定时为了保持细胞功能的正常,尽量在37 ℃下进行荧光测定。④ 荧光本底数值如不影响[Ca2+]i,计算时可忽略,否则应在计算R前减去。荧光本底较大时,应注意细胞层数(多层细胞本底数值增高)。⑤玻片规格应与比色皿一致,放置时激发光发射光均应以45 °角直射培养细胞面。
, 百拇医药
*湖北省自然科学基金资助项目(95J43)
作者简介:刘 义,男,1967年生,主治医师,医学博士。现址:同济医科大学附属协和医院,邮编:430022
参考文献
1 陈楹海,韩言德. 细胞内游离Ca2+浓度的调节机制. 生理科学进展, 1993, 24(1): 10
2 Grynkiewiwz G. A new generation of Ca2+ indictor with greatly improved fluorescence properites. J Biol Chem, 1985, 260: 3 440
3 王国平,邓仲端. 用Fura-2测量单核细胞胞浆游离钙浓度的方法. 中国病理生理学杂志, 1993, 9(4): 552
4 胡清华,王迪浔. 应用Fura-2测定猪肺动脉内皮细胞游离钙浓度. 中国病理生理学杂志, 1992, 8(4): 477
收稿日期:1998-03-11, http://www.100md.com
单位:刘义 罗丽兰 赵海波 同济医科大学附属同济医院妇产科,武汉 430030;胡清华 刘晨红 同济医科大学基础医学院病理生理学教研室,武汉 430030
关键词:巨噬细胞;胞浆游离钙;子宫内膜异位症;Frua-2
同济医科大学学报990216 摘要 为了解子宫内膜异位症患者腹腔巨噬细胞活性变化,建立了应用Frua-2测定人腹腔巨噬细胞胞浆游离钙浓度([Ca2+]i)的方法。结果显示,正常盆腔患者腹腔巨噬细胞[Ca2+]i为(100.32±5.69) nmol/L,而子宫内膜异位症患者腹腔巨噬细胞较正常盆腔者显著升高。表明子宫内膜异位症患者腹腔巨噬细胞活性增强与其[Ca2+]i增高有关。
中图法分类号 R329.2, Q582
, http://www.100md.com
Determination of Cytosolic Free Calcium Concentration in Peritoneal
Macrophage by Frua-2
Liu Yi, Luo Lilan, Zhao Haibo et al
Department of Obstetrics and Gynecology, Tongji Hospital, Tongji Medical University, Wuhan 430030
Abstract In order to study the alteration of activity of peritoneal macrophages in endometriosis, the method for cytosolic free calcium levels ([Ca2+]i) in human peritoneal macrophages by Frua-2 was developed. The results showed that the cytosolic ([Ca2+]i) in the peritoneal macrophages in patients with normal pelvis were (100.32±5.69) nmol/L, which was significantly lower than in the patients with endometriosis. It is suggested that the elevated cytosolic ([Ca2+]i) in peritoneal macrophages may contribute to the alteration of peritoneal macrophage activity in patients with endometriosis.
, 百拇医药
Key words macrophage; cytosolic free calcium ([Ca2+]i); endometriosis; Frua-2
作为第二信使系统的巨噬细胞内胞浆游离钙,其浓度的变化往往代表着细胞功能的启动、加强或抑制[1]。为了解子宫内膜异位症患者腹腔巨噬细胞活性变化,我们建立了应用Frua-2测定人单层贴壁腹腔巨噬细胞胞浆游离钙浓度([Ca2+]i)的方法。
1 材料与方法
1.1 原理
Frua-2/AM在适宜条件下载入细胞,随后被胞浆的非特异性脂酶水解成Frua-2,后者与胞浆的游离钙结合后即可被特定波长的紫外光激发产生荧光,其发射光强度与[Ca2+]i之间存在在一定函数关系,据此可测定[Ca2+]i[2]。
, 百拇医药
1.2 主要仪器和试剂
F-2000型双波长荧光分光光度计(HITACHI 850), Frua-2/AM (Sigma),RPMI 1640 (GIBCO),小牛血清(天津血液病研究所),淋巴细胞分离液(上海试剂二厂),L-谷胺酰氨(E. Merck), EGTA(Sigma), Triton (Sigma), DTPA (Sigma)。
1.3 步骤
1.3.1巨噬细胞的分离、培养和鉴定:在腹腔镜直视下通过吸管抽取子宫直肠凹和子宫膀胱陷凹腹腔液,立即置于肝素化无菌试管中。将腹腔液按1∶1比例小心加在淋巴细胞分离液的液面上,注意勿与分离液混合。然后用水平离心机2 000 r/min离心20 min,小心吸取中间富含淋巴细胞的灰白色层(其中90 %以上为巨噬细胞)。用Hanks液洗涤2~3次,调整细胞浓度,最后用含200 mg/L小牛血清的RPMI 1640培养液配制成密度3×106/ml的细胞悬液。滴在25 mm×12 mm的小玻片上,置50 ml/L CO2、37 ℃培养箱孵育1 h,使巨噬细胞贴壁,用Hanks液洗去未粘附的细胞。重新置于细胞培养液中。倒置显微镜下观察贴壁的巨噬细胞呈均匀单层融合状态。同时用台盼蓝拒染试验检测巨噬细胞成活率,要求活细胞数大于90 %。
, 百拇医药
1.3.2 Fura-2/AM负载:将上述贴壁细胞的玻片在37 ℃ PSS溶液中冲洗2次;将细胞放入含2.5 μmol/L Fura-2/AM PSS溶液中,于37 ℃静置孵育45 min;细胞经Fura-2/AM孵育后,用37 ℃ PSS溶液中冲洗两次;将玻片沿对角线垂直插入比色皿中,比色皿内已预先加入37 ℃ PSS溶液。
1.3.3 巨噬细胞[Ca2+]i测定:应用F-2000型双波长荧光分光光度计于37 ℃恒温测定荧光强度。比色皿上机时须使玻片上生长细胞的一面以45 °角面对激光光源,连续测定340、380 nm波长激发光交替激发时,510 nm发射新的荧光强度F,同时记录荧光强度比值R(R=F340/F380)。有关参数:激发光栅5 nm,发射光栅10 nm,发射速度100 nm/min,响应时间2 s,激发光扫描范围320~420 nm,发射光扫描范围440~540 nm。校正参数:Rmax为Fura-2饱和时产生的最大荧光比值,以1 mg/L Triton测得;Rmin为Fura-2游离时形成的最小荧光比值,以4 mmol/L EGTA测得;自身荧光以未孵育Fura-2/AM的细胞依同法测量,计算[Ca2+]i时减去。
, 百拇医药
1.3.4 细胞胞浆游离钙浓度[Ca2+]i计算:[Ca2+]i依下式计算:[Ca2+]i=Kd.(R-Rmin)/(Rmax-R).Ff2/Fb2。其中平衡常数Kd在37 ℃时为224 nmol/L;R为340、380 nm荧光强度的比值(R=F340/F380)。校正参数Rmax、Rmin分别为Ca2+饱和与Ca2+游离时形成的最大、最小荧光比值,Ff2与Fb2分别为Ca2+游离与Ca2+饱时380 nm荧光强度。
2 结果与讨论
Frua-2作为Ca2+荧光探针,具有荧光强度高,Ca2+选择性强,自身荧光弱,双激发光波长等优点。本文应用上述方法测出正常盆腔不孕患者腹腔巨噬细胞[Ca2+]i为(100.32±5.69) nmol/L (n=8),与文献报道的静息状态下巨噬细胞内[Ca2+]i基本一致[2]。而子宫内膜异位症患者腹腔巨噬细胞内[Ca2+]i为(620.52±57.17) nmol/L (n=10),较正常盆腔患者显著升高(P<0.01),见图1,2。

, 百拇医药
图1 对照组腹腔巨噬细胞[Ca2+]i测定,静息水平时R(F340/F380)=1.165,待稳定后,加入Triton,F340上升,而F380下降,得到Rmax;继而加入EGTA,则使F340迅速下降
而F380上升,得到Rmin;依据公式计算[Ca2+]i=114.71 nmol/L

图2 子宫内膜异位症腹腔巨噬细胞[Ca2+]i测定,静息水平时R(F340/F380)=2.073,待稳定后,加入Triton,F340上升,而F380下降,得到Rmax;继而加入EGTA,则使F340
迅速下降而F380上升,得到Rmin;依据公式计算[Ca2+]i=856 nmol/L
, 百拇医药
目前国内一单位相继建立了应用Frua-2测定细胞[Ca2+]i的方法[3,4]。但多是将细胞制备成悬液状态。这种方法从细胞悬液的制备,荧光探针的孵育和清洗,直到上机测试需反复离心,并最后调整细胞密度,操作过程复杂,同时容易造成细胞损伤。采用双波长荧光显微成像技术测定单个细胞[Ca2+],需双波长显微荧光分光设备,由于价格昂贵,国内尚难普遍开展。本方法的特点在于操作过程简单、实用,避免了反复离心对细胞的损伤。由于所需细胞数量较少,便于临床观察各种状态下巨噬细胞[Ca2+]i的变化,同时还可观察药物对细胞[Ca2+]i的影响。此外,采用双波长荧光分光光度计可发挥Frua-2双激发波长的优点,它同时可测出340和380 nm两个波长激发的荧光强度。因而测定结果更准确可靠。实验中我们注意到了以下几个因素的影响。
①细胞制备:贴壁细胞呈单层融合状态是测试成功的关键因素之一。由于巨噬细胞为终末细胞,加之临床取材限制,为了满足上述要求,我们将细胞悬液浓度调整为3×106/ml,然后滴在12 mm×25 mm玻片上,每片约需0.4~0.5 ml,置于50 ml/L CO2、37 ℃培养箱孵育1 h使细胞呈均匀单层贴壁状态可满足要求。② 纯水:普通蒸馏水因其所含重金属离子可致荧光猝严灭,故不适于此实验。我们选用离子交换纯水器过柱后的四蒸水,并以40 μm DTPA鳌合金属离子,基本满足要求。③温度:测定时为了保持细胞功能的正常,尽量在37 ℃下进行荧光测定。④ 荧光本底数值如不影响[Ca2+]i,计算时可忽略,否则应在计算R前减去。荧光本底较大时,应注意细胞层数(多层细胞本底数值增高)。⑤玻片规格应与比色皿一致,放置时激发光发射光均应以45 °角直射培养细胞面。
, 百拇医药
*湖北省自然科学基金资助项目(95J43)
作者简介:刘 义,男,1967年生,主治医师,医学博士。现址:同济医科大学附属协和医院,邮编:430022
参考文献
1 陈楹海,韩言德. 细胞内游离Ca2+浓度的调节机制. 生理科学进展, 1993, 24(1): 10
2 Grynkiewiwz G. A new generation of Ca2+ indictor with greatly improved fluorescence properites. J Biol Chem, 1985, 260: 3 440
3 王国平,邓仲端. 用Fura-2测量单核细胞胞浆游离钙浓度的方法. 中国病理生理学杂志, 1993, 9(4): 552
4 胡清华,王迪浔. 应用Fura-2测定猪肺动脉内皮细胞游离钙浓度. 中国病理生理学杂志, 1992, 8(4): 477
收稿日期:1998-03-11, http://www.100md.com