重组质粒转染蟑螂对黑胸大蠊浓核病毒的拯救
作者:张晓东 张珈敏 郭海涛 朱丽华 胡远扬
单位:武汉大学病毒研究所,武汉 430072
关键词:浓核病毒;黑胸大蠊;重组质粒;病毒拯救
中国病毒学990211 摘 要 用Glassmilk法纯化PfDNV dsDNA,在其3′端和PstⅠ切开的pUC119质粒的3′端分别加dG和dC尾,连接、转化、筛选得到分子量为8.7kb的重组质粒。通过酶切证明插入DNA为PfDNV全基因组DNA。利用DEAE-dextran转染技术,将此重组质粒导入黑胸大蠊幼虫体内,此重组质粒能使虫体发病死亡。电镜超薄切片观察发现虫体细胞内存在大量的病毒粒子。同样,在免疫扩散实验中虫体PBS浸出液能与抗PfDNV的抗体产生沉淀线。用重组质粒感染致死的虫体喂食健康黑胸大蠊,也能使其发病死亡,通过电镜可以观察到在细胞内增殖的病毒粒子。
Rescue of Infectious Virions from Recombinant Plasmid with the Genome of Periplanta fuliginosa Densovirus
, http://www.100md.com
Zhang Xiaodong Zhang Jiamin Guo Haitao Zhu Lihua Hu Yuanyang
(Insitute of Virology, Wuhan University, Wuhan 430072)
Abstract An infectious genome of the Periplanta fuliginosa densovirus (PfDNV) has been cloned into the bacterial plasmid pUC119. The viral genome could be rescued from the recombinant plasmid PfNDV-pUC119 by transfection to sensitive Periplanta fuliginosa larvae. Virions can be found in the cells of the transfected larvaes by electron microscope, and the rescued virions were as infectious as wild-type virions. In contrast, the viral genome could not be rescued from the recombinant plasmid deleted one extremity.
, 百拇医药
Key words Densovirus, Periplanta fuliginosa, Recombinant plasmid, Rescue
黑胸大蠊浓核病毒(Periplanete fuliginosa Densovirus, PfDNV)是我室1991年在国内首次报道并在国内外第一个分类鉴定的蟑螂细小病毒[1]。我们对该病毒的理化特性和病理进行了系统的研究,并构建了PfDNV全基因组克隆和酶切亚克隆重组质粒。为了进一步研究黑胸大蠊浓核病毒感染、复制及其基因表达机理,我们进行了重组质粒感染复原病毒基因特征的实验,并证实含病毒全基因重组质粒转染黑胸大蠊幼虫后可以拯救出感染性的病毒粒子。
1 材料和方法
1.1 病毒和病毒DNA PfDNV由本室分离、增殖和保存。病毒DNA提纯方法参照Nakagaki[2]所叙述方法并略有修改。用于克隆的PfDNV dsDNA经琼脂糖电泳后,切取含完整的PfDNV dsDNA片段的凝胶,通过NaⅠ溶液溶胶,Glassmilk水浴吸附,乙醇漂洗液漂洗,最后用TE溶液洗脱,得到纯化DNA备用。
, 百拇医药
1.2 病毒全基因组克隆和酶切亚克隆的构建 克隆战略如图1所示。PfDNV DNA加dG尾,质粒pUC119加上dC尾,连接、转化和筛选按《分子克隆实验指南》[3]所述进行。
1.3 重组质粒DNA的提取 按《分子克隆实验指南》[3]所述碱裂解法进行。
1.4 DNA转染 将适量的重组质粒溶解于含2mg//mL DEAE-dextran的TE溶液中,采用腹部注射法按每只10μL量注射到黑胸大蠊幼虫体内。注射后的幼虫在28℃、相对湿度70%的饲养房中加入大鼠饲料饲养。
1.5 电镜观察 不同时间取样,取虫体的肠道组织,采用戊二醛-锇酸双固定后,包埋,切片,染色,H-8100Ⅱ型电镜观察并拍照。
1.6 免疫扩散实验 豚鼠抗PfDNV抗血清的制备和双向免疫扩散实验均参照文献[4]进行。
, 百拇医药
1.7 回感实验 取重组质粒致死的虫体浸出液作为感染源喂食黑胸大蠊幼虫,28℃,相对湿度70%的饲养房中饲养并观察。
2 结果和分析
2.1 全基因组重组质粒的构建及酶切鉴定 如图1所示,纯化后的PfDNV全基因组与pUC119质粒采取加G-C尾连接方式构建重组质粒,即在PfDNV dsDNA 3′末端通过末端转移酶加Oligo dG尾,用PstⅠ切开pUC119 MCS区域后,在其3′端加oligo dC尾,进行粘端连接后,转化宿主菌大肠杆菌DH5αTM,挑选重组质粒(较小的白色菌落)。在挑选的32个菌落中,有3个为8.7kb,进一步用HindⅢ消化分析,其中3株显示5kb和3.7kb片段,2株为1.8kb和6.9kb片段。因为HindⅢ在PfDNV DNA上仅有一个切点(1.8kb处),而HindⅢ在pUC119质粒上也只有一个切点(MCS区域),所以实际上5株重组质粒以两种连接方向组合,本实验选用前者,并命名为PfDNV-pUC119重组质粒。
, http://www.100md.com
图1 重组质粒PfDNV-pUC119和PFΔKpn-pUC119的构建
Fig 1 Construction of recombinant plasmids PfDNV-pUC119 and PFΔKpn-pUC119
2.2 酶切亚克隆的构建 将上面构建好的PfDNV-pUC119重组质粒用KpnⅠ酶解后进行琼脂糖电泳,回收7.3kb的片段,通过T4DNA连接酶连接后,转化宿主菌大肠杆菌DH5αTM,挑取阳性菌落,扩增提取质粒,电泳鉴定,获得酶切亚克隆,命名为PFΔKpn-pUC119。因为在pUC119和PfDNV DNA上各有一个Kpn Ⅰ酶切位点(如图1),所以此亚克隆实际为缺失了PfDNV DNA一末端的重组质粒。
2.3 转染实验 采用腹部注射法向黑胸大蠊幼虫体内注射。每只10μL注射物中全基因组重组质粒分别为2500ng、1500ng和250ng,相当于含PfDNV dsDNA量1600ng、960ng和160ng,其结果见表1。
, http://www.100md.com
表1 质粒转染蟑螂实验结果
Table 1 Transfection experiments of Peripianta fuliginosa with recombinant plasmids 接种物
Inoculum
接种虫数
No. of inoculated larvae
感染虫数
No.of infected larvae
感染百分数(%)
% infection
, 百拇医药 PfDNV-pUC119
(2500ng)
20
20
100
(1250ng)
20
18
90
(250ng)
20
17
85
, http://www.100md.com
PF ΔKpn-pUC119
(2300ng)
20
0
0
(1000ng)
20
0
0
TE缓冲液
TE buffer
20
0
, http://www.100md.com
0
野生型病毒
Wild-type virus
20
20
100
健康蟑螂
Noninoculated
larvae
20
0
0
从表中可以看出注射的重组质粒的量越大,虫体最终死亡率也越高。当注射的重组质粒PfDNV-pUC119的量在1.5μg以上时,虫体最终死亡率与野生型病毒以自然喂食感染几乎相同。此外分别以TE buffer(含2mg/mL的DEAE-dextran)和含PFΔKpn-pUC119注射幼虫,生长正常,没有发现任何病变。
, 百拇医药
2.4 感染测定
2.4.1 双向免疫扩散实验 结果如图2。在中央孔加入豚鼠抗PfDNV抗体,周边四孔分别加入质粒转染致死的虫体PBS研磨液,正常虫体PBS研磨液,野生型病毒致死的虫体PBS研磨液和PBS液。结果发现在中央孔与1和3两孔之间分别出现特异性沉淀线,说明这两种样品中都有病毒粒子存在。
图2 血清学反应
Fig.2 Serological reaction
A 豚鼠抗PfDNV抗血清
1.转染虫体的PBS研磨液;2.正常虫体的PBS研磨液;3.野生型病毒致死的虫体PBS研磨液;4.PBS缓冲液.
, 百拇医药
A Guinea pig antiserum against PfDNV
1.PBS solution of larvae transfected by pUC119;2.PBS solution of healthy larvae;3.PBS solution of larvae infected by wt virion; 4. PBS buffer.
2.4.2 电镜超薄切片观察 通过超薄切片电镜技术,我们在重组质粒感染的黑胸大蠊虫体前肠及后肠细胞中发现大量的病毒。病毒大量复制,使细胞核膨胀(图3),在细胞质中可见大片晶格状排列的病毒聚集物(图4)。而且其超微病理变化与野生型病毒致死的超微病理变化一样。
2.4.3 回感实验 为了证实在蟑螂体内从重组质粒拯救出来的病毒是否具有感染性,我们将转染致死的虫体喂食健康黑胸大蠊,一段时间后虫体同样发病死亡,而且通过超薄切片电镜观察也发现大量病毒的增殖。
, 百拇医药
图3 重组质粒转染的蟑螂后肠细胞核中可见大量球状病毒粒子(×60000)
Fig.3 Nucleus of transfected colon cell by recombinant plasmid, shows large amount spherieal virus particles (×60000)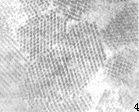
图4 重组质粒转染的蟑螂后肠细胞中病毒呈晶格状聚集 (×80000)
Fig.4 Crysfalline accumulation of the PfDNV virion in transfected colon cell by recombinant plasmid (×80000)
3 讨论
, http://www.100md.com
我们构建了含PfDNV全基因组的克隆及其亚克隆,分别命名为PfDNV-pUC119和PFΔKpn-pUC119。通过DEAE-dextran介导的转染技术,分别将它们导入黑胸大蠊幼虫体内,实验结果表明,PfDNV-pUC119质粒转染后能使虫体发病死亡。超薄切片电镜观察,虫体细胞内存在大量病毒,且病毒的存在方式及超微病理变化与野生型PfDNV感染的虫体细胞没有本质区别。虫体PBS浸出液也能与豚鼠抗PfDNV抗血清产生沉淀线。相反,缺失一末端的PFΔKpn-pUC119重组质粒转染蟑螂后不能使虫体发病死亡,且通过电镜超薄切片和双向免疫扩散都不能检测到病毒粒子。以前的报道认为在细小病毒的拯救模式中,均包括病毒本身的末端重复序列[9],本实验证实缺失了一末端的PfDNV DNA重组质粒不能被拯救。
细小病毒科所属的细小病毒和腺病毒伴随病毒的全基因组重组质粒转染细胞、拯救病毒已有报道[5~7],1990年也曾经报道过在昆虫宿主中用全基因组重组质粒拯救出浓核病毒[8]。用含蟑螂病毒基因组的重组质粒在蟑螂体内复制出病毒,对于蟑螂病毒基因工程研究具有重要意义。重组质粒在虫体内复制机理正在进一步研究。
, 百拇医药
总之,重组质粒PfDNV-pUC119的构建及其转染的研究将为浓核病毒乃至细小病毒的复制机理研究提供一个很好的模型,并将在防治世界性卫生害虫——蟑螂的工作中起到重要作用。
* 胡远扬:联系人
参考文献
[1] Hu Y, Zhang J, Bando H et al. A densovirus newly isolated from the smoky-brown cockroach Periplanta fuliginosa. Arch Virol, 1994, 138:365~372
[2] Hu Yuanyang, Seki H, Shigemi Kawase. Electron microscopic studies on DNA from a densovirus (Yamanashi isolate) of the silkworm, Bombyx mori. Appl Ent Zool, 1986,21(4):613~619
, 百拇医药
[3] 萨姆布鲁克等著.金冬雁等译.分子克隆实验指南.第二版,北京:科学出版社,1992.
[4] 范秀容等编.微生物学实验.第二版,北京:高等教育出版社,1989.
[5] Laughlin C A, Tratschin J D, Coon H et al. Cloning of infectious adeno-associated virus genomes in bacterial plasmids. Gene, 1983,23:65~73
[6] Merchlinsky M J, Tattersall P J, Leary J J et al. Construction of an infectious molecular clone of the autonomous parvirus minute virus of mice. J Virol, 1983,47:227~232
, 百拇医药
[7] Samaski R J, Berns K I, Tan M et al. Cloning of adeno-associated virus into pBR322:Rescue of intact virus from the recombinant plasmids in human cells. Proc Natl Acad Sci USA, 1982,79:2077~2081
[8] Mireille J, Francoise X J, Monica G et al. Cloning of the genome of a densovirus and rescue of infectious virions from recombinant plasmid in the insect host Spodoptera littoralis. Virol, 1990,179:403~409
[9] Andrew K M, Cheung. Integration of the adeno-associated virus genome into cellular DNA in latently infected human detroit 6 cells. J Virol, 1980,33(2):739~748
收稿日期:1998-03-13,修回日期:1998-05-25, 百拇医药
单位:武汉大学病毒研究所,武汉 430072
关键词:浓核病毒;黑胸大蠊;重组质粒;病毒拯救
中国病毒学990211 摘 要 用Glassmilk法纯化PfDNV dsDNA,在其3′端和PstⅠ切开的pUC119质粒的3′端分别加dG和dC尾,连接、转化、筛选得到分子量为8.7kb的重组质粒。通过酶切证明插入DNA为PfDNV全基因组DNA。利用DEAE-dextran转染技术,将此重组质粒导入黑胸大蠊幼虫体内,此重组质粒能使虫体发病死亡。电镜超薄切片观察发现虫体细胞内存在大量的病毒粒子。同样,在免疫扩散实验中虫体PBS浸出液能与抗PfDNV的抗体产生沉淀线。用重组质粒感染致死的虫体喂食健康黑胸大蠊,也能使其发病死亡,通过电镜可以观察到在细胞内增殖的病毒粒子。
Rescue of Infectious Virions from Recombinant Plasmid with the Genome of Periplanta fuliginosa Densovirus
, http://www.100md.com
Zhang Xiaodong Zhang Jiamin Guo Haitao Zhu Lihua Hu Yuanyang
(Insitute of Virology, Wuhan University, Wuhan 430072)
Abstract An infectious genome of the Periplanta fuliginosa densovirus (PfDNV) has been cloned into the bacterial plasmid pUC119. The viral genome could be rescued from the recombinant plasmid PfNDV-pUC119 by transfection to sensitive Periplanta fuliginosa larvae. Virions can be found in the cells of the transfected larvaes by electron microscope, and the rescued virions were as infectious as wild-type virions. In contrast, the viral genome could not be rescued from the recombinant plasmid deleted one extremity.
, 百拇医药
Key words Densovirus, Periplanta fuliginosa, Recombinant plasmid, Rescue
黑胸大蠊浓核病毒(Periplanete fuliginosa Densovirus, PfDNV)是我室1991年在国内首次报道并在国内外第一个分类鉴定的蟑螂细小病毒[1]。我们对该病毒的理化特性和病理进行了系统的研究,并构建了PfDNV全基因组克隆和酶切亚克隆重组质粒。为了进一步研究黑胸大蠊浓核病毒感染、复制及其基因表达机理,我们进行了重组质粒感染复原病毒基因特征的实验,并证实含病毒全基因重组质粒转染黑胸大蠊幼虫后可以拯救出感染性的病毒粒子。
1 材料和方法
1.1 病毒和病毒DNA PfDNV由本室分离、增殖和保存。病毒DNA提纯方法参照Nakagaki[2]所叙述方法并略有修改。用于克隆的PfDNV dsDNA经琼脂糖电泳后,切取含完整的PfDNV dsDNA片段的凝胶,通过NaⅠ溶液溶胶,Glassmilk水浴吸附,乙醇漂洗液漂洗,最后用TE溶液洗脱,得到纯化DNA备用。
, 百拇医药
1.2 病毒全基因组克隆和酶切亚克隆的构建 克隆战略如图1所示。PfDNV DNA加dG尾,质粒pUC119加上dC尾,连接、转化和筛选按《分子克隆实验指南》[3]所述进行。
1.3 重组质粒DNA的提取 按《分子克隆实验指南》[3]所述碱裂解法进行。
1.4 DNA转染 将适量的重组质粒溶解于含2mg//mL DEAE-dextran的TE溶液中,采用腹部注射法按每只10μL量注射到黑胸大蠊幼虫体内。注射后的幼虫在28℃、相对湿度70%的饲养房中加入大鼠饲料饲养。
1.5 电镜观察 不同时间取样,取虫体的肠道组织,采用戊二醛-锇酸双固定后,包埋,切片,染色,H-8100Ⅱ型电镜观察并拍照。
1.6 免疫扩散实验 豚鼠抗PfDNV抗血清的制备和双向免疫扩散实验均参照文献[4]进行。
, 百拇医药
1.7 回感实验 取重组质粒致死的虫体浸出液作为感染源喂食黑胸大蠊幼虫,28℃,相对湿度70%的饲养房中饲养并观察。
2 结果和分析
2.1 全基因组重组质粒的构建及酶切鉴定 如图1所示,纯化后的PfDNV全基因组与pUC119质粒采取加G-C尾连接方式构建重组质粒,即在PfDNV dsDNA 3′末端通过末端转移酶加Oligo dG尾,用PstⅠ切开pUC119 MCS区域后,在其3′端加oligo dC尾,进行粘端连接后,转化宿主菌大肠杆菌DH5αTM,挑选重组质粒(较小的白色菌落)。在挑选的32个菌落中,有3个为8.7kb,进一步用HindⅢ消化分析,其中3株显示5kb和3.7kb片段,2株为1.8kb和6.9kb片段。因为HindⅢ在PfDNV DNA上仅有一个切点(1.8kb处),而HindⅢ在pUC119质粒上也只有一个切点(MCS区域),所以实际上5株重组质粒以两种连接方向组合,本实验选用前者,并命名为PfDNV-pUC119重组质粒。

, http://www.100md.com
图1 重组质粒PfDNV-pUC119和PFΔKpn-pUC119的构建
Fig 1 Construction of recombinant plasmids PfDNV-pUC119 and PFΔKpn-pUC119
2.2 酶切亚克隆的构建 将上面构建好的PfDNV-pUC119重组质粒用KpnⅠ酶解后进行琼脂糖电泳,回收7.3kb的片段,通过T4DNA连接酶连接后,转化宿主菌大肠杆菌DH5αTM,挑取阳性菌落,扩增提取质粒,电泳鉴定,获得酶切亚克隆,命名为PFΔKpn-pUC119。因为在pUC119和PfDNV DNA上各有一个Kpn Ⅰ酶切位点(如图1),所以此亚克隆实际为缺失了PfDNV DNA一末端的重组质粒。
2.3 转染实验 采用腹部注射法向黑胸大蠊幼虫体内注射。每只10μL注射物中全基因组重组质粒分别为2500ng、1500ng和250ng,相当于含PfDNV dsDNA量1600ng、960ng和160ng,其结果见表1。
, http://www.100md.com
表1 质粒转染蟑螂实验结果
Table 1 Transfection experiments of Peripianta fuliginosa with recombinant plasmids 接种物
Inoculum
接种虫数
No. of inoculated larvae
感染虫数
No.of infected larvae
感染百分数(%)
% infection
, 百拇医药 PfDNV-pUC119
(2500ng)
20
20
100
(1250ng)
20
18
90
(250ng)
20
17
85
, http://www.100md.com
PF ΔKpn-pUC119
(2300ng)
20
0
0
(1000ng)
20
0
0
TE缓冲液
TE buffer
20
0
, http://www.100md.com
0
野生型病毒
Wild-type virus
20
20
100
健康蟑螂
Noninoculated
larvae
20
0
0
从表中可以看出注射的重组质粒的量越大,虫体最终死亡率也越高。当注射的重组质粒PfDNV-pUC119的量在1.5μg以上时,虫体最终死亡率与野生型病毒以自然喂食感染几乎相同。此外分别以TE buffer(含2mg/mL的DEAE-dextran)和含PFΔKpn-pUC119注射幼虫,生长正常,没有发现任何病变。
, 百拇医药
2.4 感染测定
2.4.1 双向免疫扩散实验 结果如图2。在中央孔加入豚鼠抗PfDNV抗体,周边四孔分别加入质粒转染致死的虫体PBS研磨液,正常虫体PBS研磨液,野生型病毒致死的虫体PBS研磨液和PBS液。结果发现在中央孔与1和3两孔之间分别出现特异性沉淀线,说明这两种样品中都有病毒粒子存在。

图2 血清学反应
Fig.2 Serological reaction
A 豚鼠抗PfDNV抗血清
1.转染虫体的PBS研磨液;2.正常虫体的PBS研磨液;3.野生型病毒致死的虫体PBS研磨液;4.PBS缓冲液.
, 百拇医药
A Guinea pig antiserum against PfDNV
1.PBS solution of larvae transfected by pUC119;2.PBS solution of healthy larvae;3.PBS solution of larvae infected by wt virion; 4. PBS buffer.
2.4.2 电镜超薄切片观察 通过超薄切片电镜技术,我们在重组质粒感染的黑胸大蠊虫体前肠及后肠细胞中发现大量的病毒。病毒大量复制,使细胞核膨胀(图3),在细胞质中可见大片晶格状排列的病毒聚集物(图4)。而且其超微病理变化与野生型病毒致死的超微病理变化一样。
2.4.3 回感实验 为了证实在蟑螂体内从重组质粒拯救出来的病毒是否具有感染性,我们将转染致死的虫体喂食健康黑胸大蠊,一段时间后虫体同样发病死亡,而且通过超薄切片电镜观察也发现大量病毒的增殖。

, 百拇医药
图3 重组质粒转染的蟑螂后肠细胞核中可见大量球状病毒粒子(×60000)
Fig.3 Nucleus of transfected colon cell by recombinant plasmid, shows large amount spherieal virus particles (×60000)

图4 重组质粒转染的蟑螂后肠细胞中病毒呈晶格状聚集 (×80000)
Fig.4 Crysfalline accumulation of the PfDNV virion in transfected colon cell by recombinant plasmid (×80000)
3 讨论
, http://www.100md.com
我们构建了含PfDNV全基因组的克隆及其亚克隆,分别命名为PfDNV-pUC119和PFΔKpn-pUC119。通过DEAE-dextran介导的转染技术,分别将它们导入黑胸大蠊幼虫体内,实验结果表明,PfDNV-pUC119质粒转染后能使虫体发病死亡。超薄切片电镜观察,虫体细胞内存在大量病毒,且病毒的存在方式及超微病理变化与野生型PfDNV感染的虫体细胞没有本质区别。虫体PBS浸出液也能与豚鼠抗PfDNV抗血清产生沉淀线。相反,缺失一末端的PFΔKpn-pUC119重组质粒转染蟑螂后不能使虫体发病死亡,且通过电镜超薄切片和双向免疫扩散都不能检测到病毒粒子。以前的报道认为在细小病毒的拯救模式中,均包括病毒本身的末端重复序列[9],本实验证实缺失了一末端的PfDNV DNA重组质粒不能被拯救。
细小病毒科所属的细小病毒和腺病毒伴随病毒的全基因组重组质粒转染细胞、拯救病毒已有报道[5~7],1990年也曾经报道过在昆虫宿主中用全基因组重组质粒拯救出浓核病毒[8]。用含蟑螂病毒基因组的重组质粒在蟑螂体内复制出病毒,对于蟑螂病毒基因工程研究具有重要意义。重组质粒在虫体内复制机理正在进一步研究。
, 百拇医药
总之,重组质粒PfDNV-pUC119的构建及其转染的研究将为浓核病毒乃至细小病毒的复制机理研究提供一个很好的模型,并将在防治世界性卫生害虫——蟑螂的工作中起到重要作用。
* 胡远扬:联系人
参考文献
[1] Hu Y, Zhang J, Bando H et al. A densovirus newly isolated from the smoky-brown cockroach Periplanta fuliginosa. Arch Virol, 1994, 138:365~372
[2] Hu Yuanyang, Seki H, Shigemi Kawase. Electron microscopic studies on DNA from a densovirus (Yamanashi isolate) of the silkworm, Bombyx mori. Appl Ent Zool, 1986,21(4):613~619
, 百拇医药
[3] 萨姆布鲁克等著.金冬雁等译.分子克隆实验指南.第二版,北京:科学出版社,1992.
[4] 范秀容等编.微生物学实验.第二版,北京:高等教育出版社,1989.
[5] Laughlin C A, Tratschin J D, Coon H et al. Cloning of infectious adeno-associated virus genomes in bacterial plasmids. Gene, 1983,23:65~73
[6] Merchlinsky M J, Tattersall P J, Leary J J et al. Construction of an infectious molecular clone of the autonomous parvirus minute virus of mice. J Virol, 1983,47:227~232
, 百拇医药
[7] Samaski R J, Berns K I, Tan M et al. Cloning of adeno-associated virus into pBR322:Rescue of intact virus from the recombinant plasmids in human cells. Proc Natl Acad Sci USA, 1982,79:2077~2081
[8] Mireille J, Francoise X J, Monica G et al. Cloning of the genome of a densovirus and rescue of infectious virions from recombinant plasmid in the insect host Spodoptera littoralis. Virol, 1990,179:403~409
[9] Andrew K M, Cheung. Integration of the adeno-associated virus genome into cellular DNA in latently infected human detroit 6 cells. J Virol, 1980,33(2):739~748
收稿日期:1998-03-13,修回日期:1998-05-25, 百拇医药