8Hz次声作用后大鼠脑热休克蛋白70的表达
作者:袁华 陈景藻 李玲
单位:710032 西安,第四军医大学西京医院理疗科
关键词:次声;脑;热休克蛋白70
中华物理医学与康复杂志990210
【摘 要】 目的 探讨次声作用后大鼠脑的热休克蛋白70(heat shock protein70,HSP70)的表达。方法 大鼠暴露于8 Hz的次声,2h/d, 点杂交检测次声作用1次后多器官HSP70 MRNA平;免疫组织化学方法检测次声作用1、3、7、14、21d后脑HSP70的表达和分布。结果 次声作用后脑、心、肝、肺等器官HSP70 mRNA明显增加,脑中有24个部位出现HSP70阳性神经元,且随声压增强、作用时间延长,阳性表达增强。结论 这些部位对次声敏感,次声的作用效应与声压、作用时间有关。
, 百拇医药 【中图号】 R454.3
Expression of heat shock protein 70(HSP70) within brain of
the rat exposed to infrasound of 8 Hz
YUAN Hua,CHEN Jingzao,LI Ling.
Xijing Hospital,Fourth Military Medical University, Xi′an 710032
【Abstract】 Objective To explore the expression of heat shock protein 70 HSP70 in the brain of rat exposed to infrasound.Methods Rats were exposed to infrasound of 8Hz for 2 h,and dot blot was employed to detect the level of HSP70mRNA of organs.Then immunohistochemcal techinique was used to detect the expression and distribution of HSP70 in the brain after exposed to infrasound 2 h/d for 1,3,7,14,21 d.Results HSP70 mRNA transcription was much increased in brain,heart,liver,and lung.HSP70 immunoreactive neurons presented mainly in 24 nucleus after infrasound exposure.The number of HSP70 immunoreactive neurons grew as the increasing of the sound pressure and action time.Conclusion These regions were sensitive to infrasound and the effects of infrasound on brain were closely related to the sound pressure and the action time.
, 百拇医药
【Key words】 Infrasound Brain Heat shock protein 70
次声是频率低于20Hz的声波。据报道在冶金、建筑、交通运输等行业环境中均有次声存在,其强度可达90~120 dB。一定参数的次声常影响中枢神经系统功能,出现头晕、疲倦、焦虑、工作效率下降等症状[1]。然而关于次声对脑的作用机制的研究还很不充分。本实验拟观察8 Hz次声作用于大鼠后脑热休克蛋白(heat shock protein70,HSP70)mRNA和HSP70的表达,探索次声对脑的作用机制。
1 材 料 与 方 法
1.1 采用我校研制的电激励式次声压力仓系统进行次声的产生和检测。
1.2 点杂交
1.2.1 动物模型:健康成年雄性SD大鼠 12只,体质量220~250 g,分笼饲养于安静舒适环境下,自由饮水,标准饲料喂养,避免各种刺激。动物随机分为实验组和对照组,实验组6只动物置于次声压力仓内,暴露于8 Hz,120 dB的次声下2 h。次声作用停止后,将动物断头处死,取脑、心、肝、肺投入液氮中待用。对照组6只动物无次声作用放置2 h,余处理同实验组。
, http://www.100md.com
1.2.2 RNA提取与鉴定:采用异硫氰酸胍—苯酚—氯仿一步法[2]抽提组织总RNA,用琼脂糖凝胶电泳法鉴定RNA的完整性,紫外分光光度法确定RNA的量和纯度。
1.2.3 HSP70cDNA探针的制备和标记:HSP70 cDNA质粒经BamH I+Hind III , BamH I+EcoR I酶切后,用低熔点琼脂糖法回收HSP70cDNA片段,并用α-32PdATP缺口平移法标记。
1.2.4 点杂交:取总RNA20 μg, 甲醛变性后用20×SSC稀释,按倍比稀释浓度(10 μg,5 μg,2.5 μg)直接点到尼龙膜上,固定后,膜用6×SS C浸湿后放入塑料袋中,加入预杂交液12 ml,封口后68 ℃水浴预杂交2 h;倾去预杂交液加入新鲜配制的预杂交液12 ml,并加入变性标记探针,封口,68 ℃杂交过夜。
1.2.5 HSP70 mRNA的检测:取出杂交膜用2×SS C和0.1%(g/ml)SDS于室温洗涤20 min;再用0.2×SSC,0.1%SDS于68 ℃洗涤两次,每次15 min;杂交膜与X线片一起放置于暗盒中,-70 ℃放射自显影,于不同时间取出X光片,冲洗胶片,观察结果。
, http://www.100md.com
1.3 免疫组织化学染色
1.3.1 动物模型:SD大鼠66只, 选择及饲养同1.2.1,随机分为11组。8 Hz,90 dB和120 dB 次声作用组动物每天暴露于次声下2 h,按作用时间分为1、3、7、14、21 d共10组,每组6只,对照组6只动物每天在次声仓内无次声作用放置2 h,共21d。
1.3.2 免疫组织化学染色:动物常规灌注固定,冰冻切片,采用ABC法[3]进行HSP70免疫组织化学染色。其中鼠抗人HSP70单克隆抗体(1∶3000)、生物素化羊抗鼠IgG(1∶500)及ABC复合物(1∶500)均购于美国Sigma公司。光镜观察反应结果。
2 结 果
2.1 点杂交
对照组HSP70 mRNA表达水平极低,其脑、心、肝、肺只有痕量表达。8 Hz,120 dB次声作用2 h后HSP70 mRNA的表达水平明显提高,其中脑HSP70 mRNA诱导最明显(图1)。
, http://www.100md.com
图1 8 Hz,120 dB次声作用后心、脑、肝、肺HSP70 mRNA的表达
(C示对照组,B示脑,H示心,Lu示肺,Li示肝)
2.2 免疫组织化学染色
HSP70阳性神经元在大脑中的分布,以每单位视野(125 μm×125 μm)内的数目表示数量,2个以下为 -,3~10个为+,11~20个为 ++,21~30个为+++,31个以上为++++。其结果见表1及图2。
表1 8 Hz次声作用后大鼠脑中HSP70的分布 核团
对照
120 dB
90 dB
, 百拇医药
1 d
3 d
7 d
14 d
21 d
1 d
3 d
7 d
14 d
21 d
扣 带 回
-
-
, 百拇医药
-
+
++
++
-
-
-
+
+
额叶皮质
-
-
+
+
, http://www.100md.com
++
++~+++
-
-
+
+
++
顶叶皮质
-
-
+
+
++
++
, 百拇医药
-
-
+
+
++
颞叶皮质
-
-
-
+
++
++
-
-
, 百拇医药
+
+
+
海 马
-
-
-
-
+
++
-
-
-
-
, 百拇医药
+
梨状皮质
-
-
-
+
+
+
-
-
-
-
+
室 旁 核
, http://www.100md.com
+
++
++
+++
++++
+++
+
+
+
+
+
视 上 核
+
++
, http://www.100md.com
++
+++
++++
+++
+
+
+
+
+
杏 仁 核
-
-
-
+
, http://www.100md.com
+
+
-
-
-
+
+
乳 头 体
-
-
-
+
+
++
, http://www.100md.com
-
-
-
-
-
脚 间 核
-
-
-
+
+
++
-
-
, http://www.100md.com
-
-
-
黑 质
-
-
-
+
+
+
-
-
-
-
, http://www.100md.com
-
中央灰质
-
-
-
+
++
++
-
-
-
+
+
内侧膝状体
, 百拇医药
-
-
+
+
++
++
-
+
+
+
++
外侧丘系
-
-
, http://www.100md.com
+
+
+
++
-
-
-
+
+
下 丘
-
-
+
+
, 百拇医药
++
++
-
+
+
+
++
上橄榄核
-
-
+
+
++
++
, http://www.100md.com
-
+
+
+
++
耳 蜗 核
-
-
+
+
++
+++
-
+
, http://www.100md.com
+
++
++
蓝 斑
-
-
+
+
+
+
-
-
-
-
, 百拇医药
-
孤 束 核
-
-
+
+
+~++
++
-
-
+
+
+
网状结构
, 百拇医药
+
+
+
+
+
+
-
-
+
+
+
中 缝 核
-
-
, 百拇医药
-
+
+
+
-
-
+
+
+
外侧巨细
-
-
+
+
, 百拇医药
+
+
-
-
+
+
+
胞 旁 核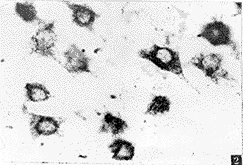
图2 孤束核HSP70免疫阳性神经元 光镜×400
3 讨 论
据卫生防护调查,次声对中枢神经系统、心血管系统、呼吸系统及工作效率等有不良影响,并可引起精神—情绪的变化[4]。人体各部及器官都有其固有的振动频率:头部为8~12 Hz、胸腔为4~6 Hz、心脏为5 Hz、腹腔为6~9 Hz、盆腔为6 Hz ,当外界次声的频率与体内器官的固有振荡频率相同或接近时可引起共振反应[1],在此基础上可产生一系列的生物效应。由于次声波长长,对机体产生“全方位”作用,脑既受到次声的直接作用,又受其他器官共振反应的影响并对其进行调节,因此次声对脑的作用效应是复杂的。热休克蛋白是一类在进化上高度保守的蛋白质,在多种应激条件下诱导产生,对细胞维持自身稳态具有重要意义[5]。其中HSP70家族含量最高,当刺激超过一定阈值时,热休克蛋白基因启动,HSP70 mRNA转录、翻译,HSP70蛋白质合成,以抵御刺激对细胞的损伤,因此HSP70最能代表生物体抵抗不良刺激的能力[6]。
, http://www.100md.com
实验1观察到脑、心、肝、肺等器官在次声作用后HSP70 mRNA转录均明显增加,证实8 Hz,120 dB 的次声是一种伤害性刺激,可引起这些器官的应激反应;其中脑HSP70 mRNA 诱导最强,提示脑对次声作用最敏感。以脑为核心的神经系统是机体维持内外环境平衡的基础,因此研究次声对脑的影响具有特别重要的意义。实验2观察到对照组大鼠脑中HSP70基础表达极低,而次声作用后有24个核团出现HSP70的表达,提示这些核团细胞发生了应激反应,HSP70合成增加。一方面这是神经元损伤的标志之一[7],另一方面,HSP70具有细胞保护功能,能减轻次声对细胞的损伤[8]。因此HSP70的表达是神经元的一种自我保护机制。从实验中看到次声作用后脑的很多具有重要功能的脑区发生了应激反应:下丘脑是神经内分泌的高级整合中枢,对保障内环境稳定具有十分重要的作用;大脑边缘系统的功能涉及对内脏功能的调节、意识与情绪反应;孤束核、中缝核、外侧巨细胞旁核等核团是自主神经系统的调节中枢,与呼吸、心率及血压的调节密切相关;皮质和海马对学习和记忆具有重要意义;中缝核、孤束核、网状结构、蓝斑等与睡眠和觉醒状态有关[9];次声作用引起这些部位及核团发生应激反应,通过自主神经调节和神经内分泌调节保证全身的代谢及功能活动的平衡;另一方面,这些阳性反应核团的功能几乎涵盖了中枢神经系统所有的高级整合功能,次声对这些核团不同程度的损伤,可能是次声作用引起脑功能障碍的基础。
, http://www.100md.com
另外120 dB组比90 dB组阳性反应出现早,阳性神经元数目多,两组随作用时间延长,阳性反应也增强,提示次声声压越强、作用时间(每次作用时间和作用次数)越长,其损伤效应越强,HSP70表达越高,以增加细胞对损伤的抵抗力。这可供制定卫生防护标准参考。
本课题为全军医药卫生科研基金资助项目(96Z042)
参 考 文 献
1 陈景藻. 次声的产生及生物学效应.见:中国人民解放军总后勤部卫生部编.医药卫生科学技术进展.北京:军事医学科学出版社,1997.194-197.
2 Piotr Chomczynski,Nicocletta Sacchi.Single-step method of RNA isolation by acid guandinium thiocyanate-phenol-chloroform extraction.Analytical Biochemistry,1987,162:156-159.
, http://www.100md.com
3 远山正弥,主编.饶志仁,译.神经科学研究尖端技术手册.分子组织化学.第二版.北京:科学出版社,1997.95-102.
4 Шайпак Е.Ю.Гигиениuеская значимость инфразвукана производстве.Гигиена и сани- тария.1981,12:19-21.
5 Koroshetz WJ,Bonventre JV.Heat shock response in the central nervous system.Experientia,1994,50:1085-1091.
6 Afshin Samali,Thomas G.Cotter.Heat shock proteins increase resistance to apoptosis.Experimental Cell Research,1996,223:163-170.
, http://www.100md.com
7 Manuel F.Gonzalez,Kazuya Shiraishi,Kinya Hisanaga,et al.Heat shock protein as markers of neural injury.Molecular Brain Research,1989,6:93-100.
8 王燕如,罗正曜.细胞保护与热休克蛋白.国外医学生理、病理科学与临床分册,1995,15:198-200.
9 韩济生,主编. 神经科学纲要.北京:北京医科大学,中国协和医科大学联合出版社,1993.645-737.
(收稿 1998-01-18 修回1999-04-21), http://www.100md.com
单位:710032 西安,第四军医大学西京医院理疗科
关键词:次声;脑;热休克蛋白70
中华物理医学与康复杂志990210
【摘 要】 目的 探讨次声作用后大鼠脑的热休克蛋白70(heat shock protein70,HSP70)的表达。方法 大鼠暴露于8 Hz的次声,2h/d, 点杂交检测次声作用1次后多器官HSP70 MRNA平;免疫组织化学方法检测次声作用1、3、7、14、21d后脑HSP70的表达和分布。结果 次声作用后脑、心、肝、肺等器官HSP70 mRNA明显增加,脑中有24个部位出现HSP70阳性神经元,且随声压增强、作用时间延长,阳性表达增强。结论 这些部位对次声敏感,次声的作用效应与声压、作用时间有关。
, 百拇医药 【中图号】 R454.3
Expression of heat shock protein 70(HSP70) within brain of
the rat exposed to infrasound of 8 Hz
YUAN Hua,CHEN Jingzao,LI Ling.
Xijing Hospital,Fourth Military Medical University, Xi′an 710032
【Abstract】 Objective To explore the expression of heat shock protein 70 HSP70 in the brain of rat exposed to infrasound.Methods Rats were exposed to infrasound of 8Hz for 2 h,and dot blot was employed to detect the level of HSP70mRNA of organs.Then immunohistochemcal techinique was used to detect the expression and distribution of HSP70 in the brain after exposed to infrasound 2 h/d for 1,3,7,14,21 d.Results HSP70 mRNA transcription was much increased in brain,heart,liver,and lung.HSP70 immunoreactive neurons presented mainly in 24 nucleus after infrasound exposure.The number of HSP70 immunoreactive neurons grew as the increasing of the sound pressure and action time.Conclusion These regions were sensitive to infrasound and the effects of infrasound on brain were closely related to the sound pressure and the action time.
, 百拇医药
【Key words】 Infrasound Brain Heat shock protein 70
次声是频率低于20Hz的声波。据报道在冶金、建筑、交通运输等行业环境中均有次声存在,其强度可达90~120 dB。一定参数的次声常影响中枢神经系统功能,出现头晕、疲倦、焦虑、工作效率下降等症状[1]。然而关于次声对脑的作用机制的研究还很不充分。本实验拟观察8 Hz次声作用于大鼠后脑热休克蛋白(heat shock protein70,HSP70)mRNA和HSP70的表达,探索次声对脑的作用机制。
1 材 料 与 方 法
1.1 采用我校研制的电激励式次声压力仓系统进行次声的产生和检测。
1.2 点杂交
1.2.1 动物模型:健康成年雄性SD大鼠 12只,体质量220~250 g,分笼饲养于安静舒适环境下,自由饮水,标准饲料喂养,避免各种刺激。动物随机分为实验组和对照组,实验组6只动物置于次声压力仓内,暴露于8 Hz,120 dB的次声下2 h。次声作用停止后,将动物断头处死,取脑、心、肝、肺投入液氮中待用。对照组6只动物无次声作用放置2 h,余处理同实验组。
, http://www.100md.com
1.2.2 RNA提取与鉴定:采用异硫氰酸胍—苯酚—氯仿一步法[2]抽提组织总RNA,用琼脂糖凝胶电泳法鉴定RNA的完整性,紫外分光光度法确定RNA的量和纯度。
1.2.3 HSP70cDNA探针的制备和标记:HSP70 cDNA质粒经BamH I+Hind III , BamH I+EcoR I酶切后,用低熔点琼脂糖法回收HSP70cDNA片段,并用α-32PdATP缺口平移法标记。
1.2.4 点杂交:取总RNA20 μg, 甲醛变性后用20×SSC稀释,按倍比稀释浓度(10 μg,5 μg,2.5 μg)直接点到尼龙膜上,固定后,膜用6×SS C浸湿后放入塑料袋中,加入预杂交液12 ml,封口后68 ℃水浴预杂交2 h;倾去预杂交液加入新鲜配制的预杂交液12 ml,并加入变性标记探针,封口,68 ℃杂交过夜。
1.2.5 HSP70 mRNA的检测:取出杂交膜用2×SS C和0.1%(g/ml)SDS于室温洗涤20 min;再用0.2×SSC,0.1%SDS于68 ℃洗涤两次,每次15 min;杂交膜与X线片一起放置于暗盒中,-70 ℃放射自显影,于不同时间取出X光片,冲洗胶片,观察结果。
, http://www.100md.com
1.3 免疫组织化学染色
1.3.1 动物模型:SD大鼠66只, 选择及饲养同1.2.1,随机分为11组。8 Hz,90 dB和120 dB 次声作用组动物每天暴露于次声下2 h,按作用时间分为1、3、7、14、21 d共10组,每组6只,对照组6只动物每天在次声仓内无次声作用放置2 h,共21d。
1.3.2 免疫组织化学染色:动物常规灌注固定,冰冻切片,采用ABC法[3]进行HSP70免疫组织化学染色。其中鼠抗人HSP70单克隆抗体(1∶3000)、生物素化羊抗鼠IgG(1∶500)及ABC复合物(1∶500)均购于美国Sigma公司。光镜观察反应结果。
2 结 果
2.1 点杂交
对照组HSP70 mRNA表达水平极低,其脑、心、肝、肺只有痕量表达。8 Hz,120 dB次声作用2 h后HSP70 mRNA的表达水平明显提高,其中脑HSP70 mRNA诱导最明显(图1)。

, http://www.100md.com
图1 8 Hz,120 dB次声作用后心、脑、肝、肺HSP70 mRNA的表达
(C示对照组,B示脑,H示心,Lu示肺,Li示肝)
2.2 免疫组织化学染色
HSP70阳性神经元在大脑中的分布,以每单位视野(125 μm×125 μm)内的数目表示数量,2个以下为 -,3~10个为+,11~20个为 ++,21~30个为+++,31个以上为++++。其结果见表1及图2。
表1 8 Hz次声作用后大鼠脑中HSP70的分布 核团
对照
120 dB
90 dB
, 百拇医药
1 d
3 d
7 d
14 d
21 d
1 d
3 d
7 d
14 d
21 d
扣 带 回
-
-
, 百拇医药
-
+
++
++
-
-
-
+
+
额叶皮质
-
-
+
+
, http://www.100md.com
++
++~+++
-
-
+
+
++
顶叶皮质
-
-
+
+
++
++
, 百拇医药
-
-
+
+
++
颞叶皮质
-
-
-
+
++
++
-
-
, 百拇医药
+
+
+
海 马
-
-
-
-
+
++
-
-
-
-
, 百拇医药
+
梨状皮质
-
-
-
+
+
+
-
-
-
-
+
室 旁 核
, http://www.100md.com
+
++
++
+++
++++
+++
+
+
+
+
+
视 上 核
+
++
, http://www.100md.com
++
+++
++++
+++
+
+
+
+
+
杏 仁 核
-
-
-
+
, http://www.100md.com
+
+
-
-
-
+
+
乳 头 体
-
-
-
+
+
++
, http://www.100md.com
-
-
-
-
-
脚 间 核
-
-
-
+
+
++
-
-
, http://www.100md.com
-
-
-
黑 质
-
-
-
+
+
+
-
-
-
-
, http://www.100md.com
-
中央灰质
-
-
-
+
++
++
-
-
-
+
+
内侧膝状体
, 百拇医药
-
-
+
+
++
++
-
+
+
+
++
外侧丘系
-
-
, http://www.100md.com
+
+
+
++
-
-
-
+
+
下 丘
-
-
+
+
, 百拇医药
++
++
-
+
+
+
++
上橄榄核
-
-
+
+
++
++
, http://www.100md.com
-
+
+
+
++
耳 蜗 核
-
-
+
+
++
+++
-
+
, http://www.100md.com
+
++
++
蓝 斑
-
-
+
+
+
+
-
-
-
-
, 百拇医药
-
孤 束 核
-
-
+
+
+~++
++
-
-
+
+
+
网状结构
, 百拇医药
+
+
+
+
+
+
-
-
+
+
+
中 缝 核
-
-
, 百拇医药
-
+
+
+
-
-
+
+
+
外侧巨细
-
-
+
+
, 百拇医药
+
+
-
-
+
+
+
胞 旁 核

图2 孤束核HSP70免疫阳性神经元 光镜×400
3 讨 论
据卫生防护调查,次声对中枢神经系统、心血管系统、呼吸系统及工作效率等有不良影响,并可引起精神—情绪的变化[4]。人体各部及器官都有其固有的振动频率:头部为8~12 Hz、胸腔为4~6 Hz、心脏为5 Hz、腹腔为6~9 Hz、盆腔为6 Hz ,当外界次声的频率与体内器官的固有振荡频率相同或接近时可引起共振反应[1],在此基础上可产生一系列的生物效应。由于次声波长长,对机体产生“全方位”作用,脑既受到次声的直接作用,又受其他器官共振反应的影响并对其进行调节,因此次声对脑的作用效应是复杂的。热休克蛋白是一类在进化上高度保守的蛋白质,在多种应激条件下诱导产生,对细胞维持自身稳态具有重要意义[5]。其中HSP70家族含量最高,当刺激超过一定阈值时,热休克蛋白基因启动,HSP70 mRNA转录、翻译,HSP70蛋白质合成,以抵御刺激对细胞的损伤,因此HSP70最能代表生物体抵抗不良刺激的能力[6]。
, http://www.100md.com
实验1观察到脑、心、肝、肺等器官在次声作用后HSP70 mRNA转录均明显增加,证实8 Hz,120 dB 的次声是一种伤害性刺激,可引起这些器官的应激反应;其中脑HSP70 mRNA 诱导最强,提示脑对次声作用最敏感。以脑为核心的神经系统是机体维持内外环境平衡的基础,因此研究次声对脑的影响具有特别重要的意义。实验2观察到对照组大鼠脑中HSP70基础表达极低,而次声作用后有24个核团出现HSP70的表达,提示这些核团细胞发生了应激反应,HSP70合成增加。一方面这是神经元损伤的标志之一[7],另一方面,HSP70具有细胞保护功能,能减轻次声对细胞的损伤[8]。因此HSP70的表达是神经元的一种自我保护机制。从实验中看到次声作用后脑的很多具有重要功能的脑区发生了应激反应:下丘脑是神经内分泌的高级整合中枢,对保障内环境稳定具有十分重要的作用;大脑边缘系统的功能涉及对内脏功能的调节、意识与情绪反应;孤束核、中缝核、外侧巨细胞旁核等核团是自主神经系统的调节中枢,与呼吸、心率及血压的调节密切相关;皮质和海马对学习和记忆具有重要意义;中缝核、孤束核、网状结构、蓝斑等与睡眠和觉醒状态有关[9];次声作用引起这些部位及核团发生应激反应,通过自主神经调节和神经内分泌调节保证全身的代谢及功能活动的平衡;另一方面,这些阳性反应核团的功能几乎涵盖了中枢神经系统所有的高级整合功能,次声对这些核团不同程度的损伤,可能是次声作用引起脑功能障碍的基础。
, http://www.100md.com
另外120 dB组比90 dB组阳性反应出现早,阳性神经元数目多,两组随作用时间延长,阳性反应也增强,提示次声声压越强、作用时间(每次作用时间和作用次数)越长,其损伤效应越强,HSP70表达越高,以增加细胞对损伤的抵抗力。这可供制定卫生防护标准参考。
本课题为全军医药卫生科研基金资助项目(96Z042)
参 考 文 献
1 陈景藻. 次声的产生及生物学效应.见:中国人民解放军总后勤部卫生部编.医药卫生科学技术进展.北京:军事医学科学出版社,1997.194-197.
2 Piotr Chomczynski,Nicocletta Sacchi.Single-step method of RNA isolation by acid guandinium thiocyanate-phenol-chloroform extraction.Analytical Biochemistry,1987,162:156-159.
, http://www.100md.com
3 远山正弥,主编.饶志仁,译.神经科学研究尖端技术手册.分子组织化学.第二版.北京:科学出版社,1997.95-102.
4 Шайпак Е.Ю.Гигиениuеская значимость инфразвукана производстве.Гигиена и сани- тария.1981,12:19-21.
5 Koroshetz WJ,Bonventre JV.Heat shock response in the central nervous system.Experientia,1994,50:1085-1091.
6 Afshin Samali,Thomas G.Cotter.Heat shock proteins increase resistance to apoptosis.Experimental Cell Research,1996,223:163-170.
, http://www.100md.com
7 Manuel F.Gonzalez,Kazuya Shiraishi,Kinya Hisanaga,et al.Heat shock protein as markers of neural injury.Molecular Brain Research,1989,6:93-100.
8 王燕如,罗正曜.细胞保护与热休克蛋白.国外医学生理、病理科学与临床分册,1995,15:198-200.
9 韩济生,主编. 神经科学纲要.北京:北京医科大学,中国协和医科大学联合出版社,1993.645-737.
(收稿 1998-01-18 修回1999-04-21), http://www.100md.com