固定对IgG抗原活性的影响
作者:熊正文 王伯沄 李达 丁华野 李春光
单位:熊正文 李达 李春光(解放军第二五一医院病理科,张家口 075000);王伯沄 丁华野(第四军医大学病理学教研室,西安 710032)
关键词:组织包埋;免疫组织化学;抗原活性;免疫印迹
临床与实验病理学杂志990330分类号 R361.2; R392 文献标识码 A
文章编号 1001-7399(1999)03-0263-02
免疫组织化学染色(ICS)以其突出的优点,已广泛用于病理学诊断、鉴别诊断及相关学科的研究之中〔1,2〕,其染色成功与否和抗原性的妥善保存极为重要。影响石蜡切片中抗原性的主要因素有固定、制片、ICS中的封闭内源酶、抗原修复或暴露、组织存档时间等〔3~5〕,但排除其它各种因素,单从固定这一环节看来,其对抗原性的影响如何,尚不十分清楚。我们应用蛋白质的Western blot技术、并与图像分析相结合,观察了不同的固定液和时间对小鼠IgG抗原活性的影响,现报道如下。
, 百拇医药
1 材料和方法
1.1 材料 鼠IgG及HRP标记羊抗鼠IgG(1∶500)为军事医学科学院五所产品,醋酸纤维素膜为浙江黄岩产品,酪蛋白、吐温20、联苯胺等试剂购于北京化学试剂商店,均为国产。YWY 781 A型医用微波炉为浙江临安爱迪电子仪器厂产品,CMIAS-B真彩色图像分析仪为北京空军总医院研制。
1.2 主要试剂配制〔6,7〕 ①封闭液:TBS加入0.05%吐温-20(TTBS),再加入1%酪蛋白。②PBST洗片液:1 000 ml PBS加入0.5 ml吐温-20。③DAB显色液:0.05 mol。L-1 TB 100 ml加入DAB 50 mg,过滤后加30%H2O2 50 μl。
1.3 实验分组 将鼠IgG抗原用0.01 mol。L-1 PBS按7.5 mg。L-1稀释后,用微量加样器取3 μl加在醋酸纤维素膜的无光泽面,将点样的醋酸纤维素膜放在湿盒内,放于4℃冰箱结合24 h,然后分成固定组与非固定组。固定组分别用为10%缓冲福尔马林、20%缓冲福尔马林、4%多聚甲醛缓冲液、95%乙醇和甲醇在室温(22℃)下处理3、6、12、24 h,PBS洗后在相同条件下作Western blot〔6,7〕。主要步骤为:①封闭60 min,②PBST洗3 min×3次,③HRP-IgG 60 min,④PBST洗3 min×3次,⑤DAB显色8 min。
, 百拇医药
1.4 图像分析〔8〕 将免疫印迹的醋酸纤维素膜放于有充足光源的摄像翻拍台上,通过摄像机将结果摄入,并传到计算机内的图像处理系统,标定未点样处的光密度(OD)值后,在监视器上利用不同的图像分割方法和编缉功能,计算每组结果的平均OD值,其值代表膜上小鼠IgG抗原活性的相对值。图像分析结果以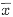 ±s表示,作方差分析和t检验。
±s表示,作方差分析和t检验。
2 结果
2.1 固定对小鼠IgG抗原活性的影响 见表1。从表1中可以看出:固定与不固定相比,不论是采用何种固定液都对小鼠IgG活性有非常明显的影响(P<0.01)。所用固定液中10%缓冲福尔马林和甲醇对抗原活性影响相对较小,而20%缓冲福尔马林、4%多聚甲醛和95%乙醇对抗原活性的影响均比10%缓冲福尔马林大(P<0.01)。
表1 未固定与固定组对IgG抗原活性的影响(光密度,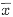 ±s) 分 类
±s) 分 类
, http://www.100md.com
n
光密度
未固定
20
1.070±0.181
10%缓冲福尔马林
40
0.710±0.316*
20%缓冲福尔马林
40
0.543±0.278*△
4%多聚甲醛
, http://www.100md.com
40
0.545±0.271*△
95%乙醇
40
0.423±0.180*△
甲醇
40
0.625±0.388*△
与未固定组比,*P<0.05;与10%缓冲甲醛组比,△P<0.01
2.2 固定时间对小鼠IgG抗原活性的影响 见表2。
, 百拇医药
表2 固定时间对小鼠IgG抗原活性的影响(光密度,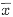 ±s) 时间(h)
±s) 时间(h)
n
光密度
0
20
1.070±0.181
3
100
0.762±0.218
6
100
, http://www.100md.com
0.724±0.169*
12
100
0.582±0.203*△
24
100
0.208±0.054*△
与0 h组比,*P<0.05;与3 h、6 h组比,△P<0.01
从表2中可以看出,固定时间从3 h开始都对抗原活性有非常明显的影响(P<0.01),随着固定时间的增长,抗原性减低的程度不断加重,在3、6、12、24 h 4个时相点中,3 h与6 h差异无显著性(P>0.05),而12 h后均与3、6 h差异有显著性(P<0.05)。2.3 5种固定液的种类和固定时间对小鼠IgG活性的影响 见表3。
, http://www.100md.com
表3 各种固定液的种类和固定时间对小鼠IgG活性影响(光密度,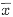 ±s) 分 类
±s) 分 类
n
固定时间(h)
3
6
12
24
10%缓冲福尔马林
20
0.97±0.161
0.82±0.166*
, http://www.100md.com
0.80±0.196*
0.250.091*
20%缓冲福尔马林
40
0.58±0.143△
0.64±0.148△
0.80±0.236*
0.15±0.059*△
4%多聚甲醛
40
, 百拇医药
0.76±0.122△
0.74±0.590
0.50±0.165*△
0.18±0.076*△
95%乙醇
40
0.53±0.096△
0.49±0.169△
0.39±0.131*△
0.28±0.154*
, http://www.100md.com
甲醇
40
0.97±0.168
0.93±0.241
0.42±0.142*△
0.18±0.106*△
与3 h组比,*P<0.01;与10%缓冲福尔马林组比,△P<0.01
表3中可以看出,除20%缓冲福尔马林外,其余4种固定液在3~12 h内,都是随着时间的延长,抗原活性减低程度逐渐加重,固定12 h后,各种固定液都对抗原活性有非常严重的破坏作用(P<0.01),而20%缓冲福尔马林从3~12 h是由重到轻,但抗原活性明显低于10%缓冲福尔马林组(P<0.01)。在5种固定液中,以10%缓冲福尔马林、甲醇对抗原性影响相对较小,而95%乙醇对抗原性的破坏作用明显大于10%缓冲福尔马林(P<0.01)。
, http://www.100md.com
3 讨论
自微波金属盐修复或暴露抗原技术问世以来〔9,10〕,抗原修复虽然可以在很大程度上使变性抗原复性,但是最重要的还是弄清影响抗原性的各种因素,尽量避免人为因素对抗原活性的影响,实现各个环节的标准化操作,并尽可能最大限度地保存抗原的活性。
为了了解固定液的浓度、种类和固定时间等因素对蛋白质抗原活性的影响,我们用小鼠IgG为样本,在排除了制片过程、阻止内源酶活性和抗原修复等多种因素对抗原活性的影响后,应用Western(蛋白)印迹分析法研究发现,不论是固定的种类还是固定时间,都对小鼠IgG活性有着十分明显的影响。为了达到保存良好的组织形态结构、防止自溶、阻止内源性、外源性细胞内分解酶活性的目的,要用固定液对组织及时固定〔2,3〕。实验结果提示:为了达到固定目的、减少固定时间对抗原活性的影响,我们认为活检材料以10%缓冲福尔马林固定3~6 h为最佳条件,最长不要超过12 h,因为以0.6 cm厚的组织为例,用10%福尔马林在室温固定4.275 h就能达到目的〔2,3〕,而且抗原性受破坏程度也轻。
, http://www.100md.com
过去的研究认为醛类固定剂因醛基与抗原蛋白质中的氨基交联形成羧甲基,使构像决定簇折叠排列的三维结构发生异常改变,出现空间障碍,而降低抗体与抗原决定簇的结合反应,而且固定时间越长、对抗原性的影响就越大〔4,5〕。我们的实验进一步证实了上述观点,乙醇作为固定液虽然不与蛋白质抗原分子中的氨基交联形成羧甲基,但对抗原性也有很大的破坏作用,其机制有待于进一步研究。
作者简介:熊正文,男,37岁,副主任技师
参考文献
1,蔡文琴,王伯沄主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川科学技术出版社,1994:1~20
2,熊正文.免疫组织化学技术中抗原修复的研究进展.中华病理学杂,1997;26:124
3,熊正文,王伯沄,丁华野.影响免疫组织化学抗原性的因素分析与对策.诊断病理学杂志,1997;4:171
, 百拇医药
4,Ng CS, Chan JK, Lo STH et al. Critial assesment of four monoclonal antibody reactive with B-cell in formalin fixed paraffin-embedded tissue. Histopathology, 1987;1:1243
5,Brandtzage P, Rognum TO. Evalnation of nine different fixative. 2. preservation of IgG, IgA and secretory comonet in anartifi-cial immunohistochemical test subtrate, Histochemistry, 1984;8:213
6,李成文编著.现代免疫化学技术.上海:上海科学技术出版,1992:83~86
, http://www.100md.com
7,孙志贤主编.现代生物化学理论与研究技术.北京:军事医学科学出版社,1995:404~408
8,田玉旺,丁华野,邓永江等.免疫组织化学反应产物图像定量分析术.细胞与分子免疫学杂志,1997;13(增1):63
9,Shi SR, Key ME, Kalra KL. Antigen retrieval in formalin fixed, paraffin-embedded, tissues: an enhancement method for immunohi-stochemical staining based on microwave oven heating tissues sestion. J Histochem Cytochem, 1991;39:741
10,Brown RW, Chiralae R. Utility of microwave-citrate retrieval in diagnostic immunohistochomistry. J Mod Pathol, 1995;8:515
收稿日期:1998-03-25, 百拇医药
单位:熊正文 李达 李春光(解放军第二五一医院病理科,张家口 075000);王伯沄 丁华野(第四军医大学病理学教研室,西安 710032)
关键词:组织包埋;免疫组织化学;抗原活性;免疫印迹
临床与实验病理学杂志990330分类号 R361.2; R392 文献标识码 A
文章编号 1001-7399(1999)03-0263-02
免疫组织化学染色(ICS)以其突出的优点,已广泛用于病理学诊断、鉴别诊断及相关学科的研究之中〔1,2〕,其染色成功与否和抗原性的妥善保存极为重要。影响石蜡切片中抗原性的主要因素有固定、制片、ICS中的封闭内源酶、抗原修复或暴露、组织存档时间等〔3~5〕,但排除其它各种因素,单从固定这一环节看来,其对抗原性的影响如何,尚不十分清楚。我们应用蛋白质的Western blot技术、并与图像分析相结合,观察了不同的固定液和时间对小鼠IgG抗原活性的影响,现报道如下。
, 百拇医药
1 材料和方法
1.1 材料 鼠IgG及HRP标记羊抗鼠IgG(1∶500)为军事医学科学院五所产品,醋酸纤维素膜为浙江黄岩产品,酪蛋白、吐温20、联苯胺等试剂购于北京化学试剂商店,均为国产。YWY 781 A型医用微波炉为浙江临安爱迪电子仪器厂产品,CMIAS-B真彩色图像分析仪为北京空军总医院研制。
1.2 主要试剂配制〔6,7〕 ①封闭液:TBS加入0.05%吐温-20(TTBS),再加入1%酪蛋白。②PBST洗片液:1 000 ml PBS加入0.5 ml吐温-20。③DAB显色液:0.05 mol。L-1 TB 100 ml加入DAB 50 mg,过滤后加30%H2O2 50 μl。
1.3 实验分组 将鼠IgG抗原用0.01 mol。L-1 PBS按7.5 mg。L-1稀释后,用微量加样器取3 μl加在醋酸纤维素膜的无光泽面,将点样的醋酸纤维素膜放在湿盒内,放于4℃冰箱结合24 h,然后分成固定组与非固定组。固定组分别用为10%缓冲福尔马林、20%缓冲福尔马林、4%多聚甲醛缓冲液、95%乙醇和甲醇在室温(22℃)下处理3、6、12、24 h,PBS洗后在相同条件下作Western blot〔6,7〕。主要步骤为:①封闭60 min,②PBST洗3 min×3次,③HRP-IgG 60 min,④PBST洗3 min×3次,⑤DAB显色8 min。
, 百拇医药
1.4 图像分析〔8〕 将免疫印迹的醋酸纤维素膜放于有充足光源的摄像翻拍台上,通过摄像机将结果摄入,并传到计算机内的图像处理系统,标定未点样处的光密度(OD)值后,在监视器上利用不同的图像分割方法和编缉功能,计算每组结果的平均OD值,其值代表膜上小鼠IgG抗原活性的相对值。图像分析结果以
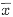 ±s表示,作方差分析和t检验。
±s表示,作方差分析和t检验。2 结果
2.1 固定对小鼠IgG抗原活性的影响 见表1。从表1中可以看出:固定与不固定相比,不论是采用何种固定液都对小鼠IgG活性有非常明显的影响(P<0.01)。所用固定液中10%缓冲福尔马林和甲醇对抗原活性影响相对较小,而20%缓冲福尔马林、4%多聚甲醛和95%乙醇对抗原活性的影响均比10%缓冲福尔马林大(P<0.01)。
表1 未固定与固定组对IgG抗原活性的影响(光密度,
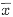 ±s) 分 类
±s) 分 类, http://www.100md.com
n
光密度
未固定
20
1.070±0.181
10%缓冲福尔马林
40
0.710±0.316*
20%缓冲福尔马林
40
0.543±0.278*△
4%多聚甲醛
, http://www.100md.com
40
0.545±0.271*△
95%乙醇
40
0.423±0.180*△
甲醇
40
0.625±0.388*△
与未固定组比,*P<0.05;与10%缓冲甲醛组比,△P<0.01
2.2 固定时间对小鼠IgG抗原活性的影响 见表2。
, 百拇医药
表2 固定时间对小鼠IgG抗原活性的影响(光密度,
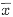 ±s) 时间(h)
±s) 时间(h)n
光密度
0
20
1.070±0.181
3
100
0.762±0.218
6
100
, http://www.100md.com
0.724±0.169*
12
100
0.582±0.203*△
24
100
0.208±0.054*△
与0 h组比,*P<0.05;与3 h、6 h组比,△P<0.01
从表2中可以看出,固定时间从3 h开始都对抗原活性有非常明显的影响(P<0.01),随着固定时间的增长,抗原性减低的程度不断加重,在3、6、12、24 h 4个时相点中,3 h与6 h差异无显著性(P>0.05),而12 h后均与3、6 h差异有显著性(P<0.05)。2.3 5种固定液的种类和固定时间对小鼠IgG活性的影响 见表3。
, http://www.100md.com
表3 各种固定液的种类和固定时间对小鼠IgG活性影响(光密度,
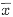 ±s) 分 类
±s) 分 类n
固定时间(h)
3
6
12
24
10%缓冲福尔马林
20
0.97±0.161
0.82±0.166*
, http://www.100md.com
0.80±0.196*
0.250.091*
20%缓冲福尔马林
40
0.58±0.143△
0.64±0.148△
0.80±0.236*
0.15±0.059*△
4%多聚甲醛
40
, 百拇医药
0.76±0.122△
0.74±0.590
0.50±0.165*△
0.18±0.076*△
95%乙醇
40
0.53±0.096△
0.49±0.169△
0.39±0.131*△
0.28±0.154*
, http://www.100md.com
甲醇
40
0.97±0.168
0.93±0.241
0.42±0.142*△
0.18±0.106*△
与3 h组比,*P<0.01;与10%缓冲福尔马林组比,△P<0.01
表3中可以看出,除20%缓冲福尔马林外,其余4种固定液在3~12 h内,都是随着时间的延长,抗原活性减低程度逐渐加重,固定12 h后,各种固定液都对抗原活性有非常严重的破坏作用(P<0.01),而20%缓冲福尔马林从3~12 h是由重到轻,但抗原活性明显低于10%缓冲福尔马林组(P<0.01)。在5种固定液中,以10%缓冲福尔马林、甲醇对抗原性影响相对较小,而95%乙醇对抗原性的破坏作用明显大于10%缓冲福尔马林(P<0.01)。
, http://www.100md.com
3 讨论
自微波金属盐修复或暴露抗原技术问世以来〔9,10〕,抗原修复虽然可以在很大程度上使变性抗原复性,但是最重要的还是弄清影响抗原性的各种因素,尽量避免人为因素对抗原活性的影响,实现各个环节的标准化操作,并尽可能最大限度地保存抗原的活性。
为了了解固定液的浓度、种类和固定时间等因素对蛋白质抗原活性的影响,我们用小鼠IgG为样本,在排除了制片过程、阻止内源酶活性和抗原修复等多种因素对抗原活性的影响后,应用Western(蛋白)印迹分析法研究发现,不论是固定的种类还是固定时间,都对小鼠IgG活性有着十分明显的影响。为了达到保存良好的组织形态结构、防止自溶、阻止内源性、外源性细胞内分解酶活性的目的,要用固定液对组织及时固定〔2,3〕。实验结果提示:为了达到固定目的、减少固定时间对抗原活性的影响,我们认为活检材料以10%缓冲福尔马林固定3~6 h为最佳条件,最长不要超过12 h,因为以0.6 cm厚的组织为例,用10%福尔马林在室温固定4.275 h就能达到目的〔2,3〕,而且抗原性受破坏程度也轻。
, http://www.100md.com
过去的研究认为醛类固定剂因醛基与抗原蛋白质中的氨基交联形成羧甲基,使构像决定簇折叠排列的三维结构发生异常改变,出现空间障碍,而降低抗体与抗原决定簇的结合反应,而且固定时间越长、对抗原性的影响就越大〔4,5〕。我们的实验进一步证实了上述观点,乙醇作为固定液虽然不与蛋白质抗原分子中的氨基交联形成羧甲基,但对抗原性也有很大的破坏作用,其机制有待于进一步研究。
作者简介:熊正文,男,37岁,副主任技师
参考文献
1,蔡文琴,王伯沄主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川科学技术出版社,1994:1~20
2,熊正文.免疫组织化学技术中抗原修复的研究进展.中华病理学杂,1997;26:124
3,熊正文,王伯沄,丁华野.影响免疫组织化学抗原性的因素分析与对策.诊断病理学杂志,1997;4:171
, 百拇医药
4,Ng CS, Chan JK, Lo STH et al. Critial assesment of four monoclonal antibody reactive with B-cell in formalin fixed paraffin-embedded tissue. Histopathology, 1987;1:1243
5,Brandtzage P, Rognum TO. Evalnation of nine different fixative. 2. preservation of IgG, IgA and secretory comonet in anartifi-cial immunohistochemical test subtrate, Histochemistry, 1984;8:213
6,李成文编著.现代免疫化学技术.上海:上海科学技术出版,1992:83~86
, http://www.100md.com
7,孙志贤主编.现代生物化学理论与研究技术.北京:军事医学科学出版社,1995:404~408
8,田玉旺,丁华野,邓永江等.免疫组织化学反应产物图像定量分析术.细胞与分子免疫学杂志,1997;13(增1):63
9,Shi SR, Key ME, Kalra KL. Antigen retrieval in formalin fixed, paraffin-embedded, tissues: an enhancement method for immunohi-stochemical staining based on microwave oven heating tissues sestion. J Histochem Cytochem, 1991;39:741
10,Brown RW, Chiralae R. Utility of microwave-citrate retrieval in diagnostic immunohistochomistry. J Mod Pathol, 1995;8:515
收稿日期:1998-03-25, 百拇医药