具强杀菌活性的兔Ⅱ型磷脂酶A2互补DNA克隆及其顺序确定的研究
作者:梁宁生 杨帆 陆益 肖晓兰 蒙子卿 Jerrold Weiss
单位:梁宁生 杨帆 陆益 肖晓兰 蒙子卿 广西肿瘤防治研究所药理室 南宁 530021;Jerrold Weiss 美国纽约大学(NYU)医学院微生物系
关键词:磷脂酶A2;杀菌功能;互补DNA的克隆;结构与功能的关系
广西医科大学学报990301
摘要 目的:确定具强杀菌活性的兔Ⅱ型磷脂酶A2(PLA2)cDNA和蛋白质的一级结构,了解其杀菌功能与蛋白质一级结构的关系。方法:用PCR方法从兔骨髓cDNA库中克隆出Ⅱ型磷脂酶A2 cDNA并确定DNA顺序,推断出它的蛋白质一级结构;并与其它一些动物PLA2的结构进行比较。结果:成功获得了该磷脂酶A2的cDNA和蛋白质一级结构。它是目前上百种已知蛋白质一级结构的磷脂酶A2中碱性最强的蛋白,氨基酸组成中碱性氨基酸较丰富。其它具杀菌活性的哺乳动物Ⅱ型磷脂酶A2也都是碱性强的蛋白。结论:磷脂酶A2一级结构中富于碱性氨基酸是其具有杀菌功能的关键,而杀菌活性的强弱与其分子碱性强度呈正相关。
, http://www.100md.com
中国图书资料分类法分类号 Q753
A STUDY OF COMPLEMENTARY DNA CLONING AND SEQUENCE DETERMINATION OF RABBIT TYPE Ⅱ PLA2 WITH POTENT BACTERICIDAL ACTIVITY
Liang Ningsheng,Yan Fan,Lu Yi,et al
Department of Pharmacology,Guangxi Cancer Institute,Nanning 530021
Abstract Objective:To determine cDNA and protein primary structure of rabbit type Ⅱ PLA2 with potent bactericidal activity,and to understand the relationship of bactericidal function and protein primary structure.Methods:Cloning cDNA of rabbit type Ⅱ PLA2 from bone marrow cDNA library by PCR and determining DNA sequence;deducing protein primary sequence from cDNA sequence;comparing the primary structure with some others PLA2 structure.Results:cDNA and protein primary structure of rabbit type Ⅱ PLA2 were obtained sucessfully;the PLA2 is the most basic protein among one hundred different PLA2s which protein primary structure were known;other PLA2s with bactericidal activity from mammal are very basic protein,too;amino acid compositions of the protein are rich in basic residues.Conclusion:Amino acid compositions which are rich in basic residues are critically important for bactericidal activity and the potency of PLA2 bactericidal activity is positively correlating to basicity of the protein.
, 百拇医药
Key words phospholipase A2;bactericidal function;cDNA cloning;relationship of structure and function
磷脂酶A2(Phospholipase A2,PLA2)是一类广泛分布于自然界中,能催化水解磷脂的酶。该类酶除能水解磷脂外,还具有多种功能,而在蛋白质一级结构上存在一些差别。本文提到的PLA2,指的是分子量在13000~15000u的PLA2。有关PLA2的研究已持续了一个世纪,至今学者们对它的探索仍兴趣不减[1]。1995年,一种新的且很重要的活性——杀菌功能被发现[2],源于哺乳动物的一些PLA2具杀菌的功能,在宿主防御细菌方面起重要的作用。我们的研究发现,兔子的Ⅱ型PLA2具有很强的杀革兰氏阳性菌的作用,比人的Ⅱ型PLA2强5倍[3],它也是我们至今研究过的PLA2中杀菌活性最强的酶。本研究的目的旨在通过克隆兔的Ⅱ型PLA2的互补DNA(complementary DNA,cDNA)及分析该DNA顺序,并与其它已知结构的PLA2比较,以期了解PLA2的结构与其杀菌功能的关系,为今后重组PLA2提供必要的前提。
, http://www.100md.com
1 材料和方法
1.1 制备兔骨髓cDNA库:新西兰白兔,体质量3.2 kg。处死后取四肢骨髓,用RNA提取试剂Ultraspec RNA(美国Biotex公司产品)提取总RNA(具体操作按照该公司提供的资料进行)。得到的总RNA送Novagen公司(美国)制备cDNA库。大于300碱基对的cDNA片段被克隆入λScreen载体的EcoR I和Hind Ⅲ内切点。
1.2 用多聚酶链式反应(Polymerase chain reaction,PCR)方法克隆兔骨髓cDNA库中的Ⅱ型PLA2 cDNA。
1.2.1 PCR引物的设计:引物A,通过比较已知氨基酸和DNA顺序的Ⅱ型PLA2(包括人、豚鼠、大白鼠、小白鼠),找出它们共同的保留片段,即相当于蛋白质一级结构中第28至34位氨基酸片段。这一片段内无论是氨基酸顺序或是DNA顺序都几乎相同。据此合成了引物A:5′-TGTGGCGTGGGTGGCAG-
, 百拇医药
AGG,见图1。
引物B,此段引物是根据已知DNA片段合成。Jacques等从兔软骨细胞中得到一段不完整的Ⅱ型PLA2 cDNA片段。由于骨髓中的Ⅱ型PLA2应与之一致或极为相近。因此,我们根据该DNA片段的一部分,即相当于氨基酸顺序中第110至116位残基,合成了引物B:5′-GCGATTGTTGGGGTAGAACTG,见图1。
引物C,经PCR克隆出Ⅱ型PLA2 cDNA片段AB,见图1。进行DNA顺序分析确定该片段DNA顺序后,据此合成引物C,它相应于氨基酸顺序中第60至67位残基。其顺序为:5′-ACAGGACTCTTGTAGGAGCCAG,见图1。
引物D和E,这两种引物是非特异性的,即与PLA2 DNA无关的引物,见图1。它们是根据cDNA库载体的已知顺序合成,引物D相应于T7启动子区域,顺序为:5′-CAGATCTGCATTTAGGTGACACTG。引物E相应于SP6启动子区域,顺序为:5′-GCTAGTTATTGCTCAGCGG。
, http://www.100md.com
1.2.2 PCR前cDNA库的处理:根据cDNA库制备公司(Novagen)的建议,取兔骨髓cDNA库10 μl,加水至100 μl,在99℃中加热10 min,然后迅速放置入碎冰中待用。10 μl处理后的cDNA库溶液用于一次PCR(50 μl的总量)。
1.2.3 PCR条件:PCR仪、Taq DNA多聚酶,PCR缓冲液,αNTP等均为Perkin-Elmer公司产品。在50 μl的PCR反应液中,含10 mmol αNTP,2~4 mmol MgSO4,1~2 u Taq DNA多聚酶及30 pmol的相应引物,见图1。PCR的第一个循环,先在94℃变性5 min,然后进入下一步。在最后一个循环,72℃中延长至10 min。克隆AB段时:变性,94℃1 min;退火,61℃1 min;延长,72℃2 min;共35个循环。DB段:变性,94℃1 min;退火,54℃1 min,延长,72℃2 min,共30个循环。CE段:变性,94℃1 min;退火,60℃1 min;延长,72℃2 min,总共30个循环。
, http://www.100md.com
1.2.4 PCR产物的纯化、扩增及DNA顺序的分析:由PCR得到的产物,经琼脂糖电泳(1%~2%),使用QIAgen产品,从琼脂糖中分离和纯化有关DNA片段。得到以的DNA片段连接到载体质粒PCR上(Invitrogen产品),再转化大肠杆菌(Oneshot,Invitrogen产品)及扩增质粒。质粒经纯化(使用QIAgen产品),再确定克隆DNA片段的顺序(使用ABI 373A DNA自动分析仪)。每一段DNA均分析其双链的顺序。
1.3 PLA2一级结构净电荷的计算:在一级结构中,每一个赖氨酸或精氨酸残基计正电荷1,每一个谷氨酸或天冬氨酸计负电荷1,得到正、负电荷总数后,两者相减之余数即为该分子所带的净电荷。净正电荷数高,说明分子中碱性氨基酸残基所占比例高,蛋白质碱性强。反之说明该分子中酸性氨基酸残基多,酸性强。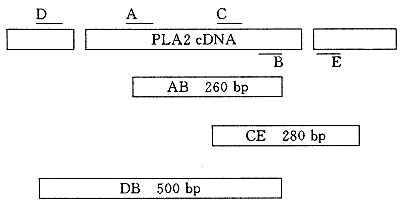
图1 PCR引物及产物的示意图bp(base pair):碱基对
, http://www.100md.com
2 结果
2.1 兔Ⅱ型PLA2 cDNA和蛋白质一级结构顺序
用PCR方法,结合使用特异性和非特异性的引物,我们成功地从兔骨髓cDNA库中克隆出了PLA2 cDNA的AB、CE和DB片段,并确定了DNA顺序,见图1。综合3个片段的资料,我们得到了完整cDNA顺序的资料(图2),并由此推断出其相应蛋白质的一级结构。cDNA全长527对碱基,它包括了完整的翻译部分和5′及3′端的非翻译部分。推断出的蛋白质一级结构全长144个氨基酸残基,其中信号多肽长20个残基及成熟蛋白124个氨基酸残基。
Forst等[4]曾从兔腹腔炎性渗出物中纯化出Ⅱ型PLA2,并做了N-末端氨基酸顺序分析,得到从第1至39位氨基酸顺序。我们将从兔骨髓cDNA克隆出的Ⅱ型PLA2与之相比,两者在上述片段上基本一致。但前者的顺序中缺了第19位、34位和38位氨基酸,而我们得出的顺序中这三个氨基酸分别为酪氨酸、甘氨酸和天冬氨酸。另外,Forst所得Ⅱ型PLA2的顺序中,第27位是丝氨酸,但我们得出的是组氨酸,我们曾重复我们的工作,确认此为组氨酸。另外,在与其它哺乳动物已知顺序的Ⅱ型PLA2比较也发现,此位上均为组氨酸,这也从侧面证实了我们的研究结果是正确的。
, 百拇医药
与兔软骨细胞中克隆的PLA2 cDNA片段比较[5],有一个重要的不同。在DNA顺序中339位上,软骨细胞的是脱氧鸟嘌呤核苷(G),骨髓来源的是脱氧腺嘌呤核苷(A)。这一不同,使它们编码的是性质相反的氨基酸,在103位,软骨细胞的是酸性氨基酸——谷氨酸,而骨髓的是碱性氨基酸——赖氨酸。
图2 兔Ⅱ型PLA2 cDNA顺序
黑体加下划线的密码子为起始密码子,钭体加下划线的为终止密码子。A,脱氧腺嘌呤核苷;C,脱氧胞嘧啶核苷;G,脱氧鸟嘌呤核苷;T,脱氧胸腺嘧啶核苷。
2.2 与其它已知蛋白质一级结构的哺乳动物的Ⅱ型PLA2比较(图3)
, http://www.100md.com 除兔Ⅱ型PLA2外,已知一级结构的还有人[6],大白鼠[7],小白鼠[8]和豚鼠[9]。它们的一级结构颇为相似,类似性在60%~70%。我们发现,源于哺乳动物的Ⅱ型PLA2有一共性,即均为碱性很强的蛋白,尤以兔PLA2为甚。兔、人、豚鼠、小白鼠和大白鼠,它们带的净正电荷分别为17,15,15,15和12。这些分子的氨基酸组成中,碱性氨基酸(赖氨酸和精氨酸)占的比例较高。在分子量约为14 000 u的分子里,带有如此高净正电荷,这无论在PLA2或其它分子,都是少见的。
在目前已知蛋白质一级结构的上百种PLA2中,这5种哺乳动物Ⅱ型PLA2带的净正电荷远高于其它的PLA2,杀菌活性也都是较强的。兔的PLA2是目前已知带净正电荷最多的PLA2,而其杀菌活性也是最强的。


, http://www.100md.com
图3 哺乳动物Ⅱ型PLA2蛋白质一级结构的比较及所带的净电荷
1、2、3、4及5分别为兔、人、豚鼠、大白鼠和小白鼠的PLA2。有下划线的为信号多肽;*代表与兔一致的氨基酸;-为缺失的氨基酸
3 讨论
虽然早已知道哺乳动物的白细胞中有Ⅱ型PLA2,而知道这些PLA2有杀菌的功能却是近二三年的事[4,10,11]。自发现它们在宿主防御革兰氏阳性菌感染起关键作用后,就为PLA2的研究开辟了一个新的领域。尽管所有PLA2都共同具有催化水解磷脂的作用,且水解细菌来源的磷脂活性相近[12],但绝大多数已知PLA2并不具有实际意义的杀菌功能。为何只有少数的PLA2具有杀菌功能众所周知,任何蛋白质分子的功能,都是由它的结构,特别是一级结构(氨基酸排列顺序)所决定的,故我们的研究从PLA2的一级结构入手。到我们的研究开始前为止,已有上百种PLA2的蛋白质一级结构被确定,其中多数是从蛇毒中分离出来的PLA2。源于哺乳动物的较少,只有10多种,而具有杀菌作用的有4种,即人、豚鼠、大白鼠和小白鼠的Ⅱ型PLA2。而目前杀菌活性最强的兔Ⅱ型PLA2至今尚未有完整的蛋白质一级结构报道[4,5]。为此,我们首先要做的便是明确它的一级结构。
, 百拇医药
Forst和Weiss等[4,10]曾利用从兔白细胞和腹腔炎性渗出物纯化出的Ⅱ型PLA2进行氨基酸序列的分析,得到N-末端39个氨基酸残基的顺序,还不到完整顺序的1/3(总长144氨基酸)。Jacques等[5]从兔软骨细胞克隆出一段Ⅱ型PLA2 cDNA,据此推断出的氨基酸顺序也只有70个左右,大约为完整顺序的一半。这些结果无法使我们全面了解PLA2的一级结构。我们利用PCR的方法,结合使用特异性和非特异性的引物,成功的从兔骨髓的cDNA库中克隆出兔Ⅱ型PLA2 cDNA,并由此推断出其完整的蛋白质一级结构。
在比较和分析兔以及其它哺乳动物Ⅱ型PLA2一级结构时,我们发现这些具有杀菌功能的蛋白均为碱性颇强的分子,其氨基酸组成中,碱性氨基酸占较高的比例,带的净正电荷在12~17之间,这种现象在同类分子量的蛋白分子中很少见。而同样来源于哺乳动物的Ⅰ型PLA2,它们的分子量也和Ⅱ型一样,一级结构也在一定程度上是类似的,但它们带的净电荷在0左右[13,14],分子中碱性氨基酸占的比例不高,也都不具备杀菌的作用。从分子进化的观点看来,哺乳动物Ⅱ型PLA2的分子碱性如此强,自然与一些重要的功能有关。我们认为,它们之所以能杀菌,是由它们分子的一级结构里,碱性氨基酸多,带的正电荷多所决定,而其它PLA2不具杀菌作用,是由它们的分子带的净正电荷少或不带净正电荷决定的。我们注意到,在具杀菌作用的PLA2里,其杀菌活性的强弱与其蛋白质碱性的强弱呈正相关。蛋白质带的正电荷多,碱性强,其杀菌作用就强,反之就弱。从我们的实验得知,兔、人、小白鼠和大白鼠的PLA2杀菌浓度LD90(金黄色葡萄球菌,1×106/ml)分别为10,50,50和300μg/L(豚鼠的LD90无详细资料)。而它们带的净正电分别为17,15,15,12。
, 百拇医药
在研究中我们发现,兔软骨细胞Ⅱ型PLA2蛋白质一级结构的103位上是酸性氨基酸谷氨酸,而我们从兔骨髓得到的是碱性氨基酸赖氨酸。考虑到碱性氨基酸在杀菌功能中的重要性,为排除PCR中DNA多聚酶会偶尔结合上错误的核苷,从而给cDNA顺序带来错误信息的可能性,我们重复了该实验,结果仍是赖氨酸。这提示我们,兔的不同组织中的Ⅱ型PLA2,可能由于功能不完全一样,故在结构上也可有不同,或可能是Jacques的DNA顺序有误所致。
过去对哺乳动物PLA2的研究,都是从组织细胞或体液中提取PLA2供研究。由于含量低,特别是Ⅱ型PLA2,不易获取足够的蛋白,使研究受到限制。故至今上百种已知一级结构的PLA2中,哺乳动物的只占极少一部分。本研究发现的ⅡPLA2 cDNA顺序及其蛋白质一级结构,丰富了哺乳动物PLA2的资料,也为我们能利用基因重组技术大量生产Ⅱ型PLA2和定点改变其结构提供了必要的前提。同时,由于PLA2在抗菌作用方面潜在的应用前景[15],利用目前PLA2中杀菌活性最强的兔Ⅱ型PLA2顺序资料,有目的增加其一级结构中的碱性氨基酸,为我们创造出杀菌活性更强的PLA2提供了合理改变结构的依据。
, 百拇医药
本研究的部分工作是在美国纽约大学医学院微生物系,Weiss J教授的实验室完成,特表感谢
*广西科技厅青年科学基金和广西肿瘤防治研究所博士启动基金资助项目
参考文献
1 Tischfield JA.A reassessment of the low molecular weight phospholipase A2 gene family in mammal.J Biol Chem,1997,272(28):17247~17250
2 Hawig SS,Tan L,Qu XD,et al.Bactericidal properties of murine intestinal phospholipase A2.J Clin Invest,1995,95:603~610
, 百拇医药
3 Weinrauch Y,Esbach P,Madsen L,et al.The potent anti-staphylococcus aureus activty of a sterile rabbit inflamnatory fluid is due to a 14-KD phospholipase A2.J Clin Invest,1996,97(1):250~257
4 Forst S,Weiss J,Elsbach P.Structural and functional properties of a phospholipase A2 purified from an inflommatory exudate.Biochemistry,1986,25:8 381~8385
5 Jacques C,Berziat G,Humber L,et al.Posttranscription effect of insulin-like growth factor-I Interleukin-1 β induced type Ⅱ secreted phospholipase A2 gene expression in rabbit articular chondrocytes.J Clin Invest,1997,99(8):1864~1872
, 百拇医药
6 Seilhamer J,Pruzanski W,Vadas P,et al.Cloning and recombinant expression of phospolipase A2.J Biol Chem,1989,264(10):5335~5338
7 Ishizaki J,Ohara O,Nakamura E,et al.cDNA cloning and sequence determination of rat membrane associated PLA2.Bioch and Bioph Res Comm,1989,162(3):1030~1036
8 Mulherkar R,Rao RS,Wagle AS,et al.Enhancing Factor,a paneth cell specific protein from mouse small intestines:predicted amino acid sequence from RT-PCR amplified cDNA and its expression.Bioch and Bioph Res Comm,1993,195(3):1254~1 263
, 百拇医药
9 Vial D,Senorale-Dose M,Havet N,et al.Expression of Type-Ⅱ phospholipase A2 in alveolar macrophages.J Biol Chem,1995,270(29):17327
10 Wright GW,Ooi CE,Weiss J,et al.Purification of a cellular (granulocyte) and an extracellular (serum) phospholipase A2 that participate in destruction of E coli in a rabbit inflammatory exudate.J Biol Chem,1990,265:6675~6681
11 Weinrauch Y,Abad C,Liang NS,et al.Mobilization of potent plasma bactericidal activity during systemic bacterial challenge-role of Ⅱ A phospholipase A2.J Clin Invest,1998,102(3):633~638
, 百拇医药
12 Elsbach P,Weiss J.Utilization of labeled Escherichia coli as phospholipase substrate.Method in Enzymology,1991,197:24~31
13 Ohara O,Tamaki M,Nakamura E,et al.Dog and rat pancreatic phospholipases A2:Complete amino acid sequences deduced from complementary DNAs.J Biochem,1986(3):733~739
14 Scott DL,White SP,Browning JL,et al.Structures of free and inhibited human secretory phospholipase A2 from inflammatory exudate.Science,1991,254:1007~1 010
15 Elsbach P and Weiss J.Prospects for the use of recombinant BPI in the treatment of Gram-negative bacterial in fection.Infect Agents Dis,1995,4:102~109
收稿日期:1998-11-30, 百拇医药
单位:梁宁生 杨帆 陆益 肖晓兰 蒙子卿 广西肿瘤防治研究所药理室 南宁 530021;Jerrold Weiss 美国纽约大学(NYU)医学院微生物系
关键词:磷脂酶A2;杀菌功能;互补DNA的克隆;结构与功能的关系
广西医科大学学报990301
摘要 目的:确定具强杀菌活性的兔Ⅱ型磷脂酶A2(PLA2)cDNA和蛋白质的一级结构,了解其杀菌功能与蛋白质一级结构的关系。方法:用PCR方法从兔骨髓cDNA库中克隆出Ⅱ型磷脂酶A2 cDNA并确定DNA顺序,推断出它的蛋白质一级结构;并与其它一些动物PLA2的结构进行比较。结果:成功获得了该磷脂酶A2的cDNA和蛋白质一级结构。它是目前上百种已知蛋白质一级结构的磷脂酶A2中碱性最强的蛋白,氨基酸组成中碱性氨基酸较丰富。其它具杀菌活性的哺乳动物Ⅱ型磷脂酶A2也都是碱性强的蛋白。结论:磷脂酶A2一级结构中富于碱性氨基酸是其具有杀菌功能的关键,而杀菌活性的强弱与其分子碱性强度呈正相关。
, http://www.100md.com
中国图书资料分类法分类号 Q753
A STUDY OF COMPLEMENTARY DNA CLONING AND SEQUENCE DETERMINATION OF RABBIT TYPE Ⅱ PLA2 WITH POTENT BACTERICIDAL ACTIVITY
Liang Ningsheng,Yan Fan,Lu Yi,et al
Department of Pharmacology,Guangxi Cancer Institute,Nanning 530021
Abstract Objective:To determine cDNA and protein primary structure of rabbit type Ⅱ PLA2 with potent bactericidal activity,and to understand the relationship of bactericidal function and protein primary structure.Methods:Cloning cDNA of rabbit type Ⅱ PLA2 from bone marrow cDNA library by PCR and determining DNA sequence;deducing protein primary sequence from cDNA sequence;comparing the primary structure with some others PLA2 structure.Results:cDNA and protein primary structure of rabbit type Ⅱ PLA2 were obtained sucessfully;the PLA2 is the most basic protein among one hundred different PLA2s which protein primary structure were known;other PLA2s with bactericidal activity from mammal are very basic protein,too;amino acid compositions of the protein are rich in basic residues.Conclusion:Amino acid compositions which are rich in basic residues are critically important for bactericidal activity and the potency of PLA2 bactericidal activity is positively correlating to basicity of the protein.
, 百拇医药
Key words phospholipase A2;bactericidal function;cDNA cloning;relationship of structure and function
磷脂酶A2(Phospholipase A2,PLA2)是一类广泛分布于自然界中,能催化水解磷脂的酶。该类酶除能水解磷脂外,还具有多种功能,而在蛋白质一级结构上存在一些差别。本文提到的PLA2,指的是分子量在13000~15000u的PLA2。有关PLA2的研究已持续了一个世纪,至今学者们对它的探索仍兴趣不减[1]。1995年,一种新的且很重要的活性——杀菌功能被发现[2],源于哺乳动物的一些PLA2具杀菌的功能,在宿主防御细菌方面起重要的作用。我们的研究发现,兔子的Ⅱ型PLA2具有很强的杀革兰氏阳性菌的作用,比人的Ⅱ型PLA2强5倍[3],它也是我们至今研究过的PLA2中杀菌活性最强的酶。本研究的目的旨在通过克隆兔的Ⅱ型PLA2的互补DNA(complementary DNA,cDNA)及分析该DNA顺序,并与其它已知结构的PLA2比较,以期了解PLA2的结构与其杀菌功能的关系,为今后重组PLA2提供必要的前提。
, http://www.100md.com
1 材料和方法
1.1 制备兔骨髓cDNA库:新西兰白兔,体质量3.2 kg。处死后取四肢骨髓,用RNA提取试剂Ultraspec RNA(美国Biotex公司产品)提取总RNA(具体操作按照该公司提供的资料进行)。得到的总RNA送Novagen公司(美国)制备cDNA库。大于300碱基对的cDNA片段被克隆入λScreen载体的EcoR I和Hind Ⅲ内切点。
1.2 用多聚酶链式反应(Polymerase chain reaction,PCR)方法克隆兔骨髓cDNA库中的Ⅱ型PLA2 cDNA。
1.2.1 PCR引物的设计:引物A,通过比较已知氨基酸和DNA顺序的Ⅱ型PLA2(包括人、豚鼠、大白鼠、小白鼠),找出它们共同的保留片段,即相当于蛋白质一级结构中第28至34位氨基酸片段。这一片段内无论是氨基酸顺序或是DNA顺序都几乎相同。据此合成了引物A:5′-TGTGGCGTGGGTGGCAG-
, 百拇医药
AGG,见图1。
引物B,此段引物是根据已知DNA片段合成。Jacques等从兔软骨细胞中得到一段不完整的Ⅱ型PLA2 cDNA片段。由于骨髓中的Ⅱ型PLA2应与之一致或极为相近。因此,我们根据该DNA片段的一部分,即相当于氨基酸顺序中第110至116位残基,合成了引物B:5′-GCGATTGTTGGGGTAGAACTG,见图1。
引物C,经PCR克隆出Ⅱ型PLA2 cDNA片段AB,见图1。进行DNA顺序分析确定该片段DNA顺序后,据此合成引物C,它相应于氨基酸顺序中第60至67位残基。其顺序为:5′-ACAGGACTCTTGTAGGAGCCAG,见图1。
引物D和E,这两种引物是非特异性的,即与PLA2 DNA无关的引物,见图1。它们是根据cDNA库载体的已知顺序合成,引物D相应于T7启动子区域,顺序为:5′-CAGATCTGCATTTAGGTGACACTG。引物E相应于SP6启动子区域,顺序为:5′-GCTAGTTATTGCTCAGCGG。
, http://www.100md.com
1.2.2 PCR前cDNA库的处理:根据cDNA库制备公司(Novagen)的建议,取兔骨髓cDNA库10 μl,加水至100 μl,在99℃中加热10 min,然后迅速放置入碎冰中待用。10 μl处理后的cDNA库溶液用于一次PCR(50 μl的总量)。
1.2.3 PCR条件:PCR仪、Taq DNA多聚酶,PCR缓冲液,αNTP等均为Perkin-Elmer公司产品。在50 μl的PCR反应液中,含10 mmol αNTP,2~4 mmol MgSO4,1~2 u Taq DNA多聚酶及30 pmol的相应引物,见图1。PCR的第一个循环,先在94℃变性5 min,然后进入下一步。在最后一个循环,72℃中延长至10 min。克隆AB段时:变性,94℃1 min;退火,61℃1 min;延长,72℃2 min;共35个循环。DB段:变性,94℃1 min;退火,54℃1 min,延长,72℃2 min,共30个循环。CE段:变性,94℃1 min;退火,60℃1 min;延长,72℃2 min,总共30个循环。
, http://www.100md.com
1.2.4 PCR产物的纯化、扩增及DNA顺序的分析:由PCR得到的产物,经琼脂糖电泳(1%~2%),使用QIAgen产品,从琼脂糖中分离和纯化有关DNA片段。得到以的DNA片段连接到载体质粒PCR上(Invitrogen产品),再转化大肠杆菌(Oneshot,Invitrogen产品)及扩增质粒。质粒经纯化(使用QIAgen产品),再确定克隆DNA片段的顺序(使用ABI 373A DNA自动分析仪)。每一段DNA均分析其双链的顺序。
1.3 PLA2一级结构净电荷的计算:在一级结构中,每一个赖氨酸或精氨酸残基计正电荷1,每一个谷氨酸或天冬氨酸计负电荷1,得到正、负电荷总数后,两者相减之余数即为该分子所带的净电荷。净正电荷数高,说明分子中碱性氨基酸残基所占比例高,蛋白质碱性强。反之说明该分子中酸性氨基酸残基多,酸性强。

图1 PCR引物及产物的示意图bp(base pair):碱基对
, http://www.100md.com
2 结果
2.1 兔Ⅱ型PLA2 cDNA和蛋白质一级结构顺序
用PCR方法,结合使用特异性和非特异性的引物,我们成功地从兔骨髓cDNA库中克隆出了PLA2 cDNA的AB、CE和DB片段,并确定了DNA顺序,见图1。综合3个片段的资料,我们得到了完整cDNA顺序的资料(图2),并由此推断出其相应蛋白质的一级结构。cDNA全长527对碱基,它包括了完整的翻译部分和5′及3′端的非翻译部分。推断出的蛋白质一级结构全长144个氨基酸残基,其中信号多肽长20个残基及成熟蛋白124个氨基酸残基。
Forst等[4]曾从兔腹腔炎性渗出物中纯化出Ⅱ型PLA2,并做了N-末端氨基酸顺序分析,得到从第1至39位氨基酸顺序。我们将从兔骨髓cDNA克隆出的Ⅱ型PLA2与之相比,两者在上述片段上基本一致。但前者的顺序中缺了第19位、34位和38位氨基酸,而我们得出的顺序中这三个氨基酸分别为酪氨酸、甘氨酸和天冬氨酸。另外,Forst所得Ⅱ型PLA2的顺序中,第27位是丝氨酸,但我们得出的是组氨酸,我们曾重复我们的工作,确认此为组氨酸。另外,在与其它哺乳动物已知顺序的Ⅱ型PLA2比较也发现,此位上均为组氨酸,这也从侧面证实了我们的研究结果是正确的。
, 百拇医药
与兔软骨细胞中克隆的PLA2 cDNA片段比较[5],有一个重要的不同。在DNA顺序中339位上,软骨细胞的是脱氧鸟嘌呤核苷(G),骨髓来源的是脱氧腺嘌呤核苷(A)。这一不同,使它们编码的是性质相反的氨基酸,在103位,软骨细胞的是酸性氨基酸——谷氨酸,而骨髓的是碱性氨基酸——赖氨酸。

图2 兔Ⅱ型PLA2 cDNA顺序
黑体加下划线的密码子为起始密码子,钭体加下划线的为终止密码子。A,脱氧腺嘌呤核苷;C,脱氧胞嘧啶核苷;G,脱氧鸟嘌呤核苷;T,脱氧胸腺嘧啶核苷。
2.2 与其它已知蛋白质一级结构的哺乳动物的Ⅱ型PLA2比较(图3)
, http://www.100md.com 除兔Ⅱ型PLA2外,已知一级结构的还有人[6],大白鼠[7],小白鼠[8]和豚鼠[9]。它们的一级结构颇为相似,类似性在60%~70%。我们发现,源于哺乳动物的Ⅱ型PLA2有一共性,即均为碱性很强的蛋白,尤以兔PLA2为甚。兔、人、豚鼠、小白鼠和大白鼠,它们带的净正电荷分别为17,15,15,15和12。这些分子的氨基酸组成中,碱性氨基酸(赖氨酸和精氨酸)占的比例较高。在分子量约为14 000 u的分子里,带有如此高净正电荷,这无论在PLA2或其它分子,都是少见的。
在目前已知蛋白质一级结构的上百种PLA2中,这5种哺乳动物Ⅱ型PLA2带的净正电荷远高于其它的PLA2,杀菌活性也都是较强的。兔的PLA2是目前已知带净正电荷最多的PLA2,而其杀菌活性也是最强的。



, http://www.100md.com
图3 哺乳动物Ⅱ型PLA2蛋白质一级结构的比较及所带的净电荷
1、2、3、4及5分别为兔、人、豚鼠、大白鼠和小白鼠的PLA2。有下划线的为信号多肽;*代表与兔一致的氨基酸;-为缺失的氨基酸
3 讨论
虽然早已知道哺乳动物的白细胞中有Ⅱ型PLA2,而知道这些PLA2有杀菌的功能却是近二三年的事[4,10,11]。自发现它们在宿主防御革兰氏阳性菌感染起关键作用后,就为PLA2的研究开辟了一个新的领域。尽管所有PLA2都共同具有催化水解磷脂的作用,且水解细菌来源的磷脂活性相近[12],但绝大多数已知PLA2并不具有实际意义的杀菌功能。为何只有少数的PLA2具有杀菌功能众所周知,任何蛋白质分子的功能,都是由它的结构,特别是一级结构(氨基酸排列顺序)所决定的,故我们的研究从PLA2的一级结构入手。到我们的研究开始前为止,已有上百种PLA2的蛋白质一级结构被确定,其中多数是从蛇毒中分离出来的PLA2。源于哺乳动物的较少,只有10多种,而具有杀菌作用的有4种,即人、豚鼠、大白鼠和小白鼠的Ⅱ型PLA2。而目前杀菌活性最强的兔Ⅱ型PLA2至今尚未有完整的蛋白质一级结构报道[4,5]。为此,我们首先要做的便是明确它的一级结构。
, 百拇医药
Forst和Weiss等[4,10]曾利用从兔白细胞和腹腔炎性渗出物纯化出的Ⅱ型PLA2进行氨基酸序列的分析,得到N-末端39个氨基酸残基的顺序,还不到完整顺序的1/3(总长144氨基酸)。Jacques等[5]从兔软骨细胞克隆出一段Ⅱ型PLA2 cDNA,据此推断出的氨基酸顺序也只有70个左右,大约为完整顺序的一半。这些结果无法使我们全面了解PLA2的一级结构。我们利用PCR的方法,结合使用特异性和非特异性的引物,成功的从兔骨髓的cDNA库中克隆出兔Ⅱ型PLA2 cDNA,并由此推断出其完整的蛋白质一级结构。
在比较和分析兔以及其它哺乳动物Ⅱ型PLA2一级结构时,我们发现这些具有杀菌功能的蛋白均为碱性颇强的分子,其氨基酸组成中,碱性氨基酸占较高的比例,带的净正电荷在12~17之间,这种现象在同类分子量的蛋白分子中很少见。而同样来源于哺乳动物的Ⅰ型PLA2,它们的分子量也和Ⅱ型一样,一级结构也在一定程度上是类似的,但它们带的净电荷在0左右[13,14],分子中碱性氨基酸占的比例不高,也都不具备杀菌的作用。从分子进化的观点看来,哺乳动物Ⅱ型PLA2的分子碱性如此强,自然与一些重要的功能有关。我们认为,它们之所以能杀菌,是由它们分子的一级结构里,碱性氨基酸多,带的正电荷多所决定,而其它PLA2不具杀菌作用,是由它们的分子带的净正电荷少或不带净正电荷决定的。我们注意到,在具杀菌作用的PLA2里,其杀菌活性的强弱与其蛋白质碱性的强弱呈正相关。蛋白质带的正电荷多,碱性强,其杀菌作用就强,反之就弱。从我们的实验得知,兔、人、小白鼠和大白鼠的PLA2杀菌浓度LD90(金黄色葡萄球菌,1×106/ml)分别为10,50,50和300μg/L(豚鼠的LD90无详细资料)。而它们带的净正电分别为17,15,15,12。
, 百拇医药
在研究中我们发现,兔软骨细胞Ⅱ型PLA2蛋白质一级结构的103位上是酸性氨基酸谷氨酸,而我们从兔骨髓得到的是碱性氨基酸赖氨酸。考虑到碱性氨基酸在杀菌功能中的重要性,为排除PCR中DNA多聚酶会偶尔结合上错误的核苷,从而给cDNA顺序带来错误信息的可能性,我们重复了该实验,结果仍是赖氨酸。这提示我们,兔的不同组织中的Ⅱ型PLA2,可能由于功能不完全一样,故在结构上也可有不同,或可能是Jacques的DNA顺序有误所致。
过去对哺乳动物PLA2的研究,都是从组织细胞或体液中提取PLA2供研究。由于含量低,特别是Ⅱ型PLA2,不易获取足够的蛋白,使研究受到限制。故至今上百种已知一级结构的PLA2中,哺乳动物的只占极少一部分。本研究发现的ⅡPLA2 cDNA顺序及其蛋白质一级结构,丰富了哺乳动物PLA2的资料,也为我们能利用基因重组技术大量生产Ⅱ型PLA2和定点改变其结构提供了必要的前提。同时,由于PLA2在抗菌作用方面潜在的应用前景[15],利用目前PLA2中杀菌活性最强的兔Ⅱ型PLA2顺序资料,有目的增加其一级结构中的碱性氨基酸,为我们创造出杀菌活性更强的PLA2提供了合理改变结构的依据。
, 百拇医药
本研究的部分工作是在美国纽约大学医学院微生物系,Weiss J教授的实验室完成,特表感谢
*广西科技厅青年科学基金和广西肿瘤防治研究所博士启动基金资助项目
参考文献
1 Tischfield JA.A reassessment of the low molecular weight phospholipase A2 gene family in mammal.J Biol Chem,1997,272(28):17247~17250
2 Hawig SS,Tan L,Qu XD,et al.Bactericidal properties of murine intestinal phospholipase A2.J Clin Invest,1995,95:603~610
, 百拇医药
3 Weinrauch Y,Esbach P,Madsen L,et al.The potent anti-staphylococcus aureus activty of a sterile rabbit inflamnatory fluid is due to a 14-KD phospholipase A2.J Clin Invest,1996,97(1):250~257
4 Forst S,Weiss J,Elsbach P.Structural and functional properties of a phospholipase A2 purified from an inflommatory exudate.Biochemistry,1986,25:8 381~8385
5 Jacques C,Berziat G,Humber L,et al.Posttranscription effect of insulin-like growth factor-I Interleukin-1 β induced type Ⅱ secreted phospholipase A2 gene expression in rabbit articular chondrocytes.J Clin Invest,1997,99(8):1864~1872
, 百拇医药
6 Seilhamer J,Pruzanski W,Vadas P,et al.Cloning and recombinant expression of phospolipase A2.J Biol Chem,1989,264(10):5335~5338
7 Ishizaki J,Ohara O,Nakamura E,et al.cDNA cloning and sequence determination of rat membrane associated PLA2.Bioch and Bioph Res Comm,1989,162(3):1030~1036
8 Mulherkar R,Rao RS,Wagle AS,et al.Enhancing Factor,a paneth cell specific protein from mouse small intestines:predicted amino acid sequence from RT-PCR amplified cDNA and its expression.Bioch and Bioph Res Comm,1993,195(3):1254~1 263
, 百拇医药
9 Vial D,Senorale-Dose M,Havet N,et al.Expression of Type-Ⅱ phospholipase A2 in alveolar macrophages.J Biol Chem,1995,270(29):17327
10 Wright GW,Ooi CE,Weiss J,et al.Purification of a cellular (granulocyte) and an extracellular (serum) phospholipase A2 that participate in destruction of E coli in a rabbit inflammatory exudate.J Biol Chem,1990,265:6675~6681
11 Weinrauch Y,Abad C,Liang NS,et al.Mobilization of potent plasma bactericidal activity during systemic bacterial challenge-role of Ⅱ A phospholipase A2.J Clin Invest,1998,102(3):633~638
, 百拇医药
12 Elsbach P,Weiss J.Utilization of labeled Escherichia coli as phospholipase substrate.Method in Enzymology,1991,197:24~31
13 Ohara O,Tamaki M,Nakamura E,et al.Dog and rat pancreatic phospholipases A2:Complete amino acid sequences deduced from complementary DNAs.J Biochem,1986(3):733~739
14 Scott DL,White SP,Browning JL,et al.Structures of free and inhibited human secretory phospholipase A2 from inflammatory exudate.Science,1991,254:1007~1 010
15 Elsbach P and Weiss J.Prospects for the use of recombinant BPI in the treatment of Gram-negative bacterial in fection.Infect Agents Dis,1995,4:102~109
收稿日期:1998-11-30, 百拇医药